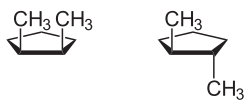
cis - trans -isomerismi

Cis - trans- isomerian tai ( Z ) - ( E ) isomeriaa kuvataan erityinen muoto kokoonpanon isomerian kemian , jossa molekyylit eroavat ainoastaan, onko vai ei kaksi substituenttia ovat samalla puolella viite tasossa. Vertailutaso voidaan määritellä esimerkiksi kaksoissidoksella tai rengasjärjestelmällä . cis- ja trans -isomeerit eroavat toisistaan kemiallisten ja fysikaalisten ominaisuuksiensa suhteen , kuten sulamislämpötila , kiehumislämpötila , sitoutumisentalpia . Toisin kuin konformerit , ne voidaan muuttaa toisiksi vain rikkomalla sidos.
Peruskonseptit
Yleisesti:
- Kaksi substituenttia on cis -konfiguroitu, jos ne ovat vertailutason samalla puolella.
- Kahdella substituentilla on trans -konfiguraatio, jos ne ovat vertailutason vastakkaisella puolella.
Perinteinen cis - trans merkintä voi olla epäselvä jos on enemmän kuin kaksi substituenttia. Tässä tapauksessa on joko määriteltävä vertailusubstituentti tai käytettävä selkeyden varmistamiseksi IUPAC: n määrittämää ( Z ) - ( E ) -merkintää. Silloin otetaan huomioon ne lähisubstituentit , joilla on Cahn-Ingold-Prelog-yleissopimuksen mukaan kussakin tapauksessa suurempi prioriteetti. Tässä tapauksessa saat selkeän nimen seuraavasti:
- ( Z ) -järjestelyä käytetään, kun kaksi ensisijaista substituenttia vertailutason samalla puolella ( z ovat yhteensä).
- ( E ) -laitetta käytetään, kun vertailutason vastakkaisella puolella olevat kaksi ensisijaista substituenttia ( esim. Geeni) sijaitsevat.
cis - ja trans - tai ( Z ) - ja ( E ) - itseään kutsutaan kuvauksiksi ja ne sijoitetaan systemaattisen aineen nimen eteen.
cis - trans -isomerismi kaksoissidoksissa
cis - trans- isomerian tapahtuu, kun molemmat atomit kaksoissidoksen on erilaisia substituentteja. Tässä tapauksessa vertailutaso on se taso, joka sisältää kaksoissidoksen akselin ja joka on samanaikaisesti kohtisuorassa tasoon nähden, jossa substituenttien σ-sidokset sijaitsevat.
Eräs esimerkki cis - trans- isomeria on isomeeri pari cis -buteenidi- happo ( maleiinihappo ) ja trans- -buteenidi- happo ( fumaarihappo ). Kaksi karboksyyliryhmää , että cis- isomeerin ovat yhdessä samalla puolella tasossa, joka on kohtisuorassa molekyyli- tason ja sisältää kaksoissidoksen akseli, että trans- isomeerin ne ovat vastakkaisella puolella. Tässä tapauksessa cis -konfiguroitu on myös ( Z ) -isomeeri ja trans -konfiguroitu on myös ( E ) -isomeeri (katso yllä oleva kuva).
Jos vetyatomi ja suurempi substituentti on kiinnitetty kumpaankin kaksoissidoksen hiiliatomiin ( vierekkäiset kaksoissidokset), cis- ja trans -määritykset ovat selkeitä ja näitä perinteisiä nimikkeistöjä voidaan käyttää. Jos toisaalta substituentteja on enemmän, on käytettävä ( E / Z ) -nimikkeistöä, jolle on määritelty selkeä prioriteettijärjestys sekvenssisäännön avulla.
Perinteistä nimeämistä ei aina voida yksinkertaisesti muuttaa ( E / Z ) -nimikkeistöksi rinnastamalla cis arvoon ( Z ) ja trans merkiksi ( E ) . Furyylifuramidi tarjoaa vastaesimerkin . Perinteisesti isomeerit erotetaan samanlaisten furyylisubstituenttien asemasta . Kuitenkin, koska CIP -sopimuksen mukaan karboksamidiryhmän C -atomilla on korkeampi prioriteetti kuin furaanirenkaan C -atomilla (toinen pallo: C, O), koska se sitoutuu toisella alalla ( O , N ) , tässä tapauksessa ( Z ) -Isomeeri, jossa furyylisubstituentit ovat trans -toisiaan.
Kahdella konjugoidulla kaksoissidoksella (esim. 1,3-butadieenilla) s-cis- ja s-trans- konformaatio ovat mahdollisia. Kaksoissidoksia voidaan kiertää niiden välisen yksinkertaisen sidoksen ympärillä ja ne voivat olla joko samalla puolella ( s-cis- konformaatio) tai vastakkain ( s-trans ). Tässä esitetty " s " tarkoittaa kahden kaksoissidoksen välistä sigmasidosta ja osoittaa, että emme käsittele tässä kahta eri isomeeriä, vaan vain saman yhdisteen konformaatioita. Joissakin tapauksissa sen rakenteen vuoksi yhdisteessä on mahdollista vain yksi konformaatio. Esimerkkejä ovat syklopentadieeni tai sykloheksa-1,3-dieeni . Ne voivat esiintyä vain s-cis- konformaatiossa, koska syklinen rakenne estää vapaan pyörimisen yksittäisen sidoksen ympärillä. Sitä vastoin 1,2,3,5,6,7-heksahydronaftaleenilla voi olla vain s-trans- konformaatio rengasrakenteen vuoksi .
cis - trans -isomerismi rengasjärjestelmissä
On myös cis - trans- isomerian syklisiä yhdisteitä, esimerkiksi monocycles, joilla on substituentteja eri hiiliatomeissa, tai polkupyörien. Jos haluat nimetä rengasjärjestelmät IUPAC -sääntöjen mukaisesti, etuliitteet " cis -" ja " trans -" asetetaan yhteyden nimen eteen kursiivilla, ja niitä käytetään vain aakkosjärjestykseen, jos nimet ovat samat.
Esimerkki monosyklinen yhdisteen cis - trans- isomeria on 1,2-dimetyylisyklopentaani : Kaksi metyyli substituentit voivat olla joko samalla puolella molekyyli- tason ( cis -muoto) tai vastakkaisilla puolilla ( trans- muoto).
6-renkaissa, kuten 1,2-dimetyylisykloheksaanissa , cis- ja trans- isomeerejä on vaikea nähdä, koska yhdisteitä ei tule pitää tasomaisina renkaina. Tämäntyyppiset yhdisteet ovat enimmäkseen energeettisesti edullista tuolin rakennetta . Koska renkaan kääntymisen vuoksi on kaksi tuolikonformaatiota , esimerkiksi trans -1,2 -dimetyylisykloheksaania ja cis -1,2 -dimetyylisykloheksaania ei voida tunnistaa suoraan. Tapauksessa trans -1,2-dimetyylisykloheksaani, molemmat metyyli ryhmät ovat joko päiväntasaajan tai aksiaalisen . Että cis- muodot, yksi metyyliryhmä sijaitsee ekvatoriaalisesti, toinen aksiaalisesti.

|

|
| (1a) ja (1b) puheenjohtaja konformaatioita ja trans -1,2-dimetyylisykloheksaani; (2a) ja (2b) cis -1,2 -dimetyylisykloheksaanin tuolimallit. | Asemat tuolin rakenteessa sykloheksaani . Vetyatomit aksiaalisessa asennossa on merkitty punaisella ja trans -positioned toisiinsa . Päiväntasaajan asemassa olevat vetyatomit on merkitty sinisellä ja ovat myös trans -asemassa toisiinsa , mutta tätä on vaikeampi nähdä. |
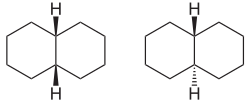
Esimerkki bisyklisestä yhdisteestä on dekaliini , koska kaksi kuusijäsenistä rengasta voidaan yhdistää toisiinsa: Liitoskohtien kaksi vetyatomia voivat olla joko dekaliinimolekyylin samalla puolella ( cis- muoto) tai vastakkaisilla puolilla ( trans lomake).
Keskinäinen muutos
| Tasapaino katalysoi jonka peptidyyli-prolyl- cis - trans- -isomerase (PPIase): Ilman entsymaattinen katalyysi, pyörimista sininen- merkityn akselin peptidin välisen sidoksen N -terminaalisessa päässä on L - proliinin ja C- terminus toisen aminohapon happo tapahtuu vain hitaasti. |
Tapauksessa kaksoissidoksen, cis- ja trans- isomeerit voidaan muuntaa keskenään ( cis - trans interkonversio). Tämä edellyttää π -sidoksen väliaikaista hajoamista, joka tehdään yleensä fotokemiallisesti tai korkeammissa lämpötiloissa. Valokemiallinen keskinäinen muunnosprosessi tapahtuu täällä elektronisen virityksen avulla singletin spin -tilaan. Kiertymätön molekyylirakenne on sekä steerisesti että energisesti epäedullinen. Tämän jälkeen spin käänteinen elektronin viritetään pois HOMO (nyt SOMO ; yksi miehitetty molekyyliorbitaali) osaksi triplettitilan, joka on tasapainossa cis - trans- rekombinaatio. Kun reaktiolämpötilaa nostetaan, saadaan termodynaaminen trans -tuote.
cis - trans -muunnokset ovat esim. B. visuaalisen prosessin keskeinen osa (katso verkkokalvo ).
Amidisidos (peptidisidos) läsnä välillä N- päähän L -proliini ja C- terminaalissa toisen aminohapon peptidien voi olla trans sekä että cis- konfiguraatiossa, koska tämä sidos on tietty kaksoissidos merkki. Muutos näiden kahden kokoonpanoissa tapahtuu vain hitaasti, mutta se voidaan entsymaattisesti katalysoitu , jonka peptidyyli-prolyyli -cis - trans- isomeraasia.
Katso myös
kirjallisuus
- Tulo cis-trans-isomerismiin. Julkaisussa: Römpp Online . Georg Thieme Verlag, käytetty 13. kesäkuuta 2014.
- Jerry March: Kehittynyt orgaaninen kemia. Reaktiot, mekanismit ja rakenne. Kolmas painos, John Wiley & Sons, New York 1985.
Yksilöllisiä todisteita
- ^ A b G. P. Moss: Stereokemian perus terminologia (IUPAC Recommendations 1996) . Julkaisussa: Pure and Applied Chemistry , 1996, osa 68, nro 12, s. 2203-2204. doi : 10.1351 / pac199668122193 .
- ↑ D. Hellwinkel: Orgaanisen kemian järjestelmällinen nimikkeistö. 5. painos, Springer, 2005, ISBN 3-540-26411-6 , s.188 .
- ↑ M. Tomoeda, R. Kitamura: Escherichia colin cis-trans-isomeroiva aktiivisuus. Isomerointi 2- (2-furyyli) -3-cis- (5-nitro-2-furyyli) akryyliamidista (furyylifuramidi) sen trans-isomeeriksi . Julkaisussa: Biochimica et Biophysica Acta (BBA) - Enzymology , 1977, osa 480, nro 1, s. 315-325. doi : 10.1016 / 0005-2744 (77) 90344-8 .
- ↑ B.Kalyanaraman, Ronald P.Mason, Roger Rowlettb LD Kispert: Elektronin spin-resonanssitutkimus ja anioniradikaalin välituotteen molekyylin kiertoradan laskeminen furyylifuramidin, eteenin nitrofuraanijohdannaisen, entsymaattisessa cis-trans-isomeroinnissa . Julkaisussa: Biochimica et Biophysica Acta (BBA) - Enzymology , 1981, nide 660, nro 1, s. 102-109. doi : 10.1016 / 0005-2744 (81) 90114-5 .
- ↑ James Ashenhurst: Dienesin s-cis ja s-trans Conformations . Julkaisussa: Master Organic Chemistry . 12. toukokuuta 2017 ( masterorganicchemistry.com [käytetty 3. syyskuuta 2021]).
- ^ Albert Gossauer: Biomolekyylien rakenne ja reaktiivisuus , Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 978-3-906390-29-1 , s.102 .
- ↑ Paula Yurkanis Bruice , Oliver Reiser : Organic Chemistry Pearson Studium, München 2007, ISBN 978-3-8273-7190-4, s.159 .
- ↑ Michael W. Tausch : Valokemialliset cis-trans-isomeroinnit ; Matemaattisten ja luonnontieteiden opetus (MNU), 1987, 40/2, s. 92-103.