hiiltä
| ominaisuudet | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Yleisesti | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nimi , symboli , atominumero | Hiili, C, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elementtiluokka | Ei-metallit | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ryhmä , piste , lohko | 14 , 2 , s | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ulkomuoto | musta (grafiitti) väritön (timantti) kellanruskea (lonsdaleite) tummanharmaa (chaoite) |
||||||||||||||||||||||||||||||||||||||||||||||||
| CAS -numero | |||||||||||||||||||||||||||||||||||||||||||||||||
| EY -numero | 231-153-3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA InfoCard | 100.028.321 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Massiivinen osa maan verhosta | 0,087% | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomi | |||||||||||||||||||||||||||||||||||||||||||||||||
| Atomimassa | 12.011 (12.0096-12.0116) u | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomisäde (laskettu) | 70 (67) pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenttinen säde | 76 illalla | ||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsin säde | 170 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronikonfiguraatio | [ Hän ] 2 s 2 2 p 2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisointienergia | 11.260 288 0 (11) eV ≈ 1 086.45 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisointienergia | 24.383 154 (16) eV ≈ 2 352.62 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisointienergia | 47.88778 (25) eV ≈ 4 620.47 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisointienergia | 64.49352 (19) eV ≈ 6 222.68 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisointienergia | 392.090 515 (25) eV ≈ 37 831 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Fyysisesti | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fyysinen tila | kiinteä | ||||||||||||||||||||||||||||||||||||||||||||||||
| Muutokset | 3 (mukaan lukien grafiitti (G) ja timantti (D)) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallirakenne | G: kuusikulmainen D: kasvokeskinen kuutio |
||||||||||||||||||||||||||||||||||||||||||||||||
| tiheys | G: 2,26 g / cm 3 D: 3,51 g / cm 3 |
||||||||||||||||||||||||||||||||||||||||||||||||
| Mohsin kovuus | G: 0,5 D: 10 |
||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismi |
diamagneettinen (D: Χ m = −2,2 10 −5 ; G: enintään −4,5 10 −4 ) |
||||||||||||||||||||||||||||||||||||||||||||||||
| Sublimaatiopiste | 3915 K (3642 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Molaarinen tilavuus | G: 5,31 · 10 −6 m 3 / mol D: 3,42 · 10−6 m 3 · mol −1 |
||||||||||||||||||||||||||||||||||||||||||||||||
| Haihtumislämpö | Sublimaatio : 715 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Äänen nopeus | D: 18350 m · s −1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ominaislämpökapasiteetti | G: 709 J / (kg K) D: 427 J kg −1 K −1 |
||||||||||||||||||||||||||||||||||||||||||||||||
| Työtoiminto | 4,81 eV | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiallisesti | |||||||||||||||||||||||||||||||||||||||||||||||||
| Hapettumistilat | −4, −3, −2, −1, 0, 1, 2, 3, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatiivisuus | 2,55 ( Paulingin asteikko ) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isotoopit | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Katso muut isotoopit isotooppiluettelosta | |||||||||||||||||||||||||||||||||||||||||||||||||
| NMR -ominaisuudet | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| turvallisuusohjeet | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
|
SI -yksiköitä käytetään mahdollisuuksien mukaan ja tavanomaisesti . Ellei toisin mainita, annetut tiedot koskevat vakio -olosuhteita . | |||||||||||||||||||||||||||||||||||||||||||||||||
Hiili ( Urm. Kul-a-, kul-ō (n)- , hiili ') tai hiili ( latinalaisesta karbo , puuhiili', latinoitu karboneumi tai hiili ) on kemiallinen alkuaine , jonka elementtisymboli C ja atominumero 6 . vuonna jaksollisen se on neljännen pääryhmän tai 14. IUPAC-ryhmän tai hiili-ryhmä ja toinen ajan .
Sitä esiintyy luonnossa sekä arvokkaassa (puhtaassa) muodossa ( timantti , grafiitti , chaoite ) että kemiallisesti sitoutunut (esim. Karbidien , karbonaattien , hiilidioksidin , raakaöljyn , maakaasun ja hiilen muodossa ). Erityisen elektronikonfiguraationsa (puolitäytetty L-kuori) ansiosta sillä on kyky muodostaa monimutkaisia molekyylejä ja sillä on suurin valikoima kemiallisia yhdisteitä kaikista kemiallisista elementeistä . Tämä ominaisuus tekee hiilestä ja sen yhdisteistä elämän perustan maan päällä.
Esiintyminen

Hiili on biosfäärin olennainen osa ; kaikissa elävissä olennoissa - hapen ( veden ) jälkeen - se on painon kannalta tärkein elementti. Kaikki elävä kudos koostuu (orgaanisista) hiiliyhdisteistä.
Toisaalta geologisesti hiili ei ole yksi yleisimmistä alkuaineista, koska maankuoren hiilen massaosuus on vain 0,027%.
Elottomassa luonnossa hiiltä esiintyy sekä alkuaineina ( timantti , grafiitti ) että yhdisteissä. Timanttien pääpaikat ovat Afrikka (erityisesti Etelä -Afrikka ja Kongon demokraattinen tasavalta) ja Venäjä. Timantteja löytyy usein vulkaanisista kivistä, kuten kimberliitistä . Grafiitti on suhteellisen harvinaista hiilipitoisissa metamorfisissa kivissä . Tärkeimmät talletukset ovat Intiassa ja Kiinassa.
Yli puolet hiilestä on epäorgaanisen karbonaattikiven muodossa (noin 2,8 · 10 16 t). Karbonaattikivet ovat yleisiä ja muodostavat joskus vuoria. Tunnettu esimerkki karbonaattivuorista on Italian Dolomiitit . Tärkeimmät karbonaatti mineraalit ovat kalsiumkarbonaatti (muutokset: kalkkikivi , liitu , marmori ) CaCO 3 , kalsiummagnesiumkarbonaattia ( dolomiitti ) CaCO 3 · MgCO 3 , rauta (II) karbonaatti ( rauta spar ) Feco 3 ja sinkki karbonaatti ( sinkki spar ) ZnCO 3 .
Tunnettuja hiilikerrostumia ovat fossiiliset raaka- ainehiili , raakaöljy ja maakaasu . Nämä eivät ole puhtaita hiiliyhdisteitä, vaan monien eri orgaanisten yhdisteiden seoksia . Ne luotiin muuttamalla kasvi- (kivihiili) ja eläin (öljy, maakaasu) jäännökset korkean paineen alaisina. Tärkeitä hiiliesiintymiä on Yhdysvalloissa, Kiinassa ja Venäjällä, tunnettu saksalainen Ruhrin alueella . Tärkeimmät öljyvarat ovat Arabian niemimaalla (Irak, Saudi -Arabia). Meksikonlahdella ja Pohjanmerellä on muitakin tärkeitä öljyvarastoja. Kiinteästä metaanihydraatista syvänmeren alueella tiedetään vähän .
Hiiltä esiintyy edelleen ilmassa hiilidioksidina (lyhyt hiilidioksidi). Hiilidioksidia muodostuu, kun hiilipitoisia yhdisteitä poltetaan, hengitettäessä ja tulivuoren aikana, ja se hyödynnetään kasvien fotosynteesissä . CO 2 liuotetaan myös veteen (noin 0,01% massaosuus meressä). Vuodesta 2015 lähtien ilmakehässä oli noin 830 miljardia tonnia hiiltä. Koska polttaminen fossiilisten polttoaineiden alusta teollistumisen on lisätty pitkän aikavälin CO 2 on materiaalivirrat ympäristössä , osuus koostumuksesta ilman kasvaa asteittain. Vuonna 2015 osuus oli 400 ppm eli 0,04%; lisääntynyt noin 120 ppm verrattuna esiteolliseen arvoon 280 ppm. Fossiilisista polttoaineista on vapautunut teollistumisen alusta lähtien yhteensä noin 530 miljardia tonnia hiiltä, joista lähes puolet jäi ilmakehään ja hyvä neljännes kumpikin imeytyi valtameriin ja maan ekosysteemeihin.
Määrällisesti suurin osa hiilestä varastoituu kivikuoreen ( litosfääri ). Kaikki muut talletukset muodostavat vain noin 1/1000 kokonaishiilestä.
ominaisuudet
Fyysiset ominaisuudet
Hiiltä esiintyy useissa allotrooppisissa muunnoksissa . Kaikki hiilipohjaiset kiintoaineet voidaan jäljittää kahteen perustyyppiin timantti ja grafiitti.
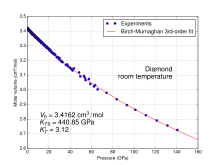
Timantissa hiili on kovalenttisesti sidottu kolmessa ulottuvuudessa . Timantti on eristävä ja läpinäkyvä. Se on vaikein tunnettu luonnonmateriaali ja sitä käytetään hioma -aineena.
Grafiitissa kovalenttinen sidos perustasojen sisällä on vahvempi kuin timantissa, kun taas tasot ovat löyhästi van der Waalsin voimien sitomia. Vapaat π-elektronit ovat vastuussa syvästä mustasta väristä, helposta katkaisusta ja korkeasta johtavuudesta perustasoissa. Grafiittia käytetään korkean lämpötilan kestävästä tiivistysmateriaalia ja voiteluaineen sekä perusmateriaalina irtolyijyt .
Toisin kuin yleisesti uskotaan, grafiitin tunnetut voiteluominaisuudet eivät kuitenkaan ole grafiitin ominaisuus sinänsä, vaan ne löytyvät vain kosteusjälkien läsnä ollessa. Tyhjiössä tai hyvin kuivassa ilmakehässä grafiitin kitkakerroin kasvaa dramaattisesti.
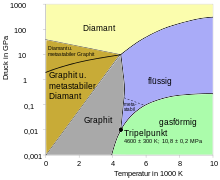
Normaalipaineessa ja alle 4000 K: n lämpötiloissa grafiitti on hiilen termodynaamisesti vakaa modifikaatio (katso vaihekaavio). Korkean aktivointienergian ansiosta timantti on myös stabiili huoneenlämmössä ja muuttuu vain huomattavasti grafiitiksi yli 500 ° C: n lämpötilassa. Päinvastoin, muutos grafiitista timantiksi vaatii vähintään 20000 barin (2 GPa) paineen. Jotta reaktio olisi riittävän nopea, lämpötilan tulisi olla yli 1500 ° C 60 000 barin paineessa vaihekaavion mukaisesti.
Hiilellä on korkein lämpötilankesto kaikista tunnetuista materiaaleista. Se sublimoituu normaalissa paineessa 3915 K: ssa (3642 ° C) menettämättä lujuutta. Kolmoispisteen on (10,8 ± 0,2) MPa ja (4600 ± 300) K.
Hiili on diamagneettinen. Pyrolyyttisesti talletettu grafiitti on suuri anisotropia , että magneettinen alttius (rinnakkaisia: = -85 · 10 -6 , vertikaalinen: = -450 · 10 -6 ), timantti, toisaalta, on isotrooppinen ( = -22 · 10 -6 ).
Hiilillä on erilaisissa muunnelmissaan hyvin erilaisia ominaisuuksia. Hiili on vaikein alkuaine: kiteisenä timanttina saavutetaan Knoopin kovuusasteikolla absoluuttinen maksimiarvo 90 GPa. Grafiitin muodossa hiili on kolmanneksi pehmein alkuaine rubidin ja cesiumin jälkeen 0,12 GPa: n kanssa. Hiilellä on myös suurin lämmönjohtavuus, joka on reilusti yli 2000 W / (m · K) huoneenlämmössä.
Kemiallisia ominaisuuksia
Molekyylihiilellä on alhainen kemiallinen aktiivisuus sen vakaan kokoonpanon vuoksi . Se voi reagoida , jos atomi on mukana ylimääräistä energiaa ja elektronien ulkokuori on katkaista. Tällä hetkellä valenssi elementin tulee 4, ja tästä syystä hiili yhdisteitä on hapetustila on +2, +4 ja -4. Kaikki hiilen reaktiot metallien ja ei-metallien kanssa tapahtuvat korkeissa lämpötiloissa . Tämä alkuaine voi olla sekä hapettava että pelkistävä aine . Vähentää ominaisuudet hiiltä ovat vahvoja, jotta elementtiä käytetään , että metalliteollisuudessa .
Hiilen kyky käydä läpi kemiallisia reaktioita riippuu tekijöistä, kuten reaktiolämpötilasta, allotrooppisesta modifikaatiosta ja dispergoitumisasteesta. Se ei reagoi emästen ja happojen kanssa ja hyvin harvoin halogeenien kanssa . Yksi hiilen pääominaisuuksista on elementin kyky muodostaa pitkiä ketjuja keskenään. Ketjut sulkeutuvat syklisesti ja muodostuu oksia. Tällä tavalla syntyy miljoonia orgaanisia yhdisteitä . Nämä yhdisteet voivat sisältää myös muita alkuaineita: happea , typpeä , rikkiä , fosforia , halogeeneja tai metalleja .
Hiilen atomimalli
Atomi- ja molekyylibataalien malli havainnollistaa, miten hiilen eri ilmenemismuodot syntyvät.
Hiilissä on kuusi elektronia. Mukaan kuoren malli, kaksi elektronia miehittää sisemmän 1s kuori. 2s taso toisen kuoren hyväksyy myös kaksi elektronia, kaksi enemmän 2px ja 2PY tasolla. Vain toisen kuoren neljä ulkoista elektronia esiintyvät kemiallisesti. Todennäköisyys, että elektronit ovat tasolla s, on pallomainen. On p tasolla on anisotrooppinen. Elektronit täyttävät tiimalasin muotoisen tilan, puolet tiimalasista vasemmalle ja oikealle keskeltä x-akselia pitkin, jos kuvitellaan, että atomi on sijoitettu suorakulmaisen koordinaatiston keskelle . Py- ja pz -kiertorata (y- ja z -akselin mukaan) ovat kohtisuorassa tähän nähden .
Timanttirakenne ( sp 3 )
2s taso voi hybridisoitua kanssa 3 2p tasoa ja muodostaa 4 energeettisesti yhtä sp 3 -orbitaalien. Tämä voidaan selittää selkeästi siten, että yksi elektronista nostetaan aiemmin tyhjään p -kiertoradalle ja kaikkien neljännen toisen tason kiertoradan kiertorataenergia tasataan. Äskettäin nousevilla kiertoradilla on pitkänomainen, epäsymmetrinen kyynelmuoto. Jos p- orbitaalien muodot järjestettiin piste-symmetrisesti keskikohtaan nähden, ne näyttävät nyt suurentuneina yhteen suuntaan kuin mailan. Kuvassa päälohko, sivulohko on jätetty pois selvyyden vuoksi. Neljä sp 3 -orbitaalia on suunnattu symmetrisesti avaruuteen mahdollisimman kaukana toisistaan, ne osoittavat kuvitteellisen tetraedrin kulmiin .
Jos atomien sp 3 -kiertoradat ovat päällekkäin , ne voivat muodostaa kiinteitä kovalenttisia sidoksia , jotka sitten heijastavat tetraedristä rakennetta. Ne muodostavat timanttihilan perusrakenteen (katso kiderakenne siellä.)
Grafiittirakenne ( sp 2 )
Jos vain 2 3 p orbitaalit osallistuvat hybridisaatioon, ns sp 2 -orbitaalien syntyy . Sp 2 -orbitaalien kohdista kaksiulotteisesti (kuten pinnan tai taso); Tämän pinnan ylä- ja alapuolella jäljellä oleva p -orbitaali muodostaa kumpikin kiertoradan. Esimerkiksi, jos p silmäkuopan on kohtisuorassa xy-tasossa , sp 2 orbitaalit ovat trigonal xy-tasossa. Niillä on sama 120 ° kulma toisiinsa nähden. Vasemmanpuoleinen kuva kuvaa tilannetta. Hybridisoitumaton p -kiertorata jätetään pois selvyyden vuoksi.
sp 2 hiiliatomia voi muodostaa kovalenttisia sidoksia keskenään, jotka sitten sijaitsevat yhdessä tasossa. Niiden rakenne on trigonaalinen; tämä on grafiitin tasotasojen perusrakenne (katso kiderakennerakenne siellä). Jäljellä olevat p -orbitaalien myös vuorovaikutuksessa toistensa kanssa. Ne muodostavat pi sidoksia merkittävästi alentaa sitovia energialähteet kuin sigma sidokset sp 2 tai sp 3 -orbitaalien ja muodostavat ns elektroni kaasun muodossa atomi ydin riippumaton ( ”delokalisoituneina”) pi elektroneja yläpuolella ja alapuolella sigma sidos lentokone .
Kemiallisesti puhutaan kaksoissidoksesta . Merkintä C = C jättää huomiotta molempien joukkovelkakirjojen erilaisen luonteen. Timanttimaisen tetraedrisen sp 3 -sidoksen 'C-C' sitomisenergia on 350 kJ / mol, grafiittimaisen trigonaalin sp 2 kaksoissidoksen C = C sitoutumisenergia on vain 260 kJ / mol suurempi. Kuusikulmaisessa hiilirenkaassa, jossa on kuusi hiiliatomia, pi -sidos stabiloidaan siirtämällä renkaan sisällä olevat elektronit (lisätietoja tästä, katso bentseeni ).
Kolmoissidos ( sp 1 )
Jos vain yksi p -orbitaali hybridisoituu s -kiertoradan kanssa, tuloksena on kaksi lineaarisesti järjestettyä pi -sidoslohkoa. Jos suuntaamme ne x-akselia pitkin, loput p- orbitaalit sijaitsevat y- ja z-akseleilla. Kaksi sp -hybridisoitua atomia voi muodostaa hiilen kolmoissidoksen. Yksi esimerkki on kaasueeteeni (asetyleeni) HC ≡ CH . Vaikka sp 3- sidokset muodostavat kolmiulotteisia rakenteita ja sp 2 kaksiulotteisia rakenteita , sp 1- sidokset muodostavat korkeintaan yksiulotteisia (lineaarisia) ketjuja, kuten H-C≡C-C≡C-H.
Hiilen muodot

Alkuainehiiltä esiintyy kolmessa muunnoksessa, jotka perustuvat sidosrakenteisiin sp 3 ja sp 2 : timantti, grafiitti ja fullereeni.
Näiden kolmen muunnoksen lisäksi on muitakin alkuainehiilen muotoja.
Muutokset
grafiitti
Sp 2 -covalently kuusikulmainen sitoutuneet hiiliatomit muodostavat lujia konetta. Van der Waalsin joukot sitovat tasot vain löyhästi . Makroskooppisesti pilkkominen hallitsee tasomaisia tasoja. Koska koneet ovat niin ohuita, niiden poikkeuksellinen lujuus ei näy grafiitilla.
Tämän rakenteen vuoksi grafiitti käyttäytyy hyvin anisotrooppisesti : kiteitä pitkin grafiitti on lämpöä ja sähköä hyvin johtava, mutta lämmönjohtavuus tai varauksen siirto kristallitasosta kristallitasoon toisaalta toimii suhteellisen huonosti.
timantti-
Sp 3 -covalently tetragonally sitoutunut hiiliatomia ei ole vapaita elektroneja. Materiaali on eristin, jonka kaistarako on 5,45 eV, joka ei absorboi näkyvää valoa. Vieraiden atomien lisääminen luo tiloja kaistarakoon ja muuttaa siten sähköisiä ja optisia ominaisuuksia. Monien luonnon timanttien kellertävä sävy johtuu typestä, kun taas boorisekoitetut timantit näyttävät sinertäviltä ja puolijohtavilta. Ilman puuttuessa timantti muuttuu grafiitiksi noin 1500 ° C: n lämpötilassa. Se palaa hiilidioksidiksi noin 700–800 ° C: ssa.
Timanttia pidetään yleensä hiilen metastabiilisena muotona normaaleissa olosuhteissa (1 bar, 25 ° C) . Viimeaikaisten tutkimusten perusteella tämä ei kuitenkaan ole enää varmaa, koska
- termodynaaminen vakaus ekstrapoloidaan vain mataliin PT -olosuhteisiin,
- Tasapainotutkimuksissa ympäristön vaikutusta - pienillä epäpuhtauksien jäämillä, jotka ovat nykyisen havaitsemisrajan alapuolella, voi jo olla rajuja vaikutuksia reaktion tasapainoasemaan - ei otettu huomioon, ja lopulta
- Kiinalaisten tutkijoiden kokeet osoittavat, että metallisen natriumin ja magnesiumkarbonaatin välisessä reaktiossa hiili ja timantti ovat rinnakkain vierekkäin.
Lonsdaleit
Lonsdaleite, joka tunnetaan myös kuusikulmaisena timanttina , on erittäin harvinainen timantin muunnos. Se tapahtuu, kun grafiitti muuttuu timantiksi iskujen, kuten korkean paineen ja korkean lämpötilan, kuten törmäystapahtumien, vaikutuksesta . Kiderakenteen kuusikulmainen luonne säilyy, mutta toisin kuin grafiitti, jokainen hiiliatomi on sitoutunut kovalenttisesti neljään muuhun .
Chaoite
Chaoite on hyvin harvinainen muutos, joka kiteytyy grafiitin kaltaisessa kuusikulmaisessa kidejärjestelmässä, mutta jolla on erilaiset hilaparametrit ja hieman erilainen kiderakenne. Kuten Lonsdaleit, se syntyy shokin metamorfoosista grafiittisessa gneississä.
Fullereenit
Säännöllinen kuusikulmainen hunajakennokuvio, koska se muodostuu grafiitin perustasojen hiiliatomeista, on tasomainen. Jos muutama kuusikulmio korvataan viisikulmioilla, syntyy kaarevia pintoja, jotka "rullautuvat" muodostaen suljetut kappaleet, joissa on tietyt viiden ja kuuden renkaan suhteelliset järjestelyt. Tällaisia rakenteita on toteutettu , että fullereenit . Sp 2 joukkovelkakirjat eivät ole enää yhdessä tasossa, vaan muodostavat avaruudellisesti suljettu rakenne. Pienin mahdollinen rakenne koostuu vain viisikulmioista ja vaatii 20 hiiliatomia, vastaava kappale on viisikulmallinen dodekaedri . Tämä yksinkertaisin fullereeni on toistaiseksi havaittu vain massaspektrometrialla . Yksi vakaimmista fullereeneistä koostuu 60 hiiliatomista ja sisältää kuusikulmia lukuun ottamatta vain viisikulmioita, joilla ei ole yhteistä reunaa minkään muun viisikulmion kanssa. Tuloksena oleva kuvio ( katkaistu ikosaedri , Archimedoksen keho ) muistuttaa (vanhanaikaisen) jalkapallon mallia . Se on nimetty Buckminster fullereeniksi Richard Buckminster Fullerin kunniaksi . Fullereenien molekyylipallot ovat sidoksissa toisiinsa suhteellisen heikkojen van der Waals -vuorovaikutusten kautta , samanlaisia kuin grafiitin perustasot. Tällä välin on eristetty useita erikokoisia fullereeneja ja joissakin tapauksissa myös kiteytynyt; niitä voidaan siksi pitää todellisina muutoksina . Fullereenien uskotaan löytyvän kaikesta nokista, esimerkiksi kynttilän liekkien yläpuolella olevasta nokesta.
Cyclo [18] hiili
Syklo [18] hiili on syklinen muunnos hiilestä, joka löydettiin vuonna 2019 empiirisellä kaavalla C 18 , joka on vakaa alhaisissa lämpötiloissa lähellä absoluuttista nollaa.
Muut hiilen muodot
Amorfinen hiili
Amorfisessa hiilessä (aC) atomit verkostoituvat ilman pitkän kantaman järjestystä. Materiaali voidaan valmistaa lähes millä tahansa sp 2 : sp 3 -hybridisaatiosuhteella, jolloin materiaalin ominaisuudet siirtyvät tasaisesti grafiitin ominaisuuksista timantin ominaisuuksiin. Tässä tapauksessa termiä timanttimainen pinnoite tai timanttimainen hiili (DLC) käytetään usein teollisuudessa. Jos sp 3- hybridisaation osuus on yli 70%, puhutaan tetraedrisestä amorfisesta hiilestä (ta-C). Tälle materiaalille on ominaista korkea sähkövastus, äärimmäinen kovuus ja optinen läpinäkyvyys. Tuotanto voidaan suorittaa käyttämällä PVD- tai PECVD -menetelmiä. Materiaali kerrostetaan kerroksena (amorfinen hiilikerros ).
Hiilikuidut
Hiilikuidut koostuvat grafiittimaisesta sp 2 -sidotusta hiilestä. Isotrooppiset kuidut käyttäytyvät samalla tavalla kuin monikiteinen grafiitti ja niillä on vain heikko lujuus. Kuumamattoja ja nippuja käytetään lämpötiivisteisiin. Venyttämällä valmistuksen aikana on mahdollista kohdistaa perustasot kuidun akselia pitkin. Korkean lujuuden omaavia kuituja saadaan ominaisuuksilla, jotka vastaavat grafiitin teoreettisia arvoja perustasoja pitkin. Anisotrooppiset hiilikuidut ovat kevyitä, erittäin jäykkiä ja vahvoja, ja niitä käytetään komposiittimateriaaleissa .
Lasimainen hiili
Lasimainen hiili ("lasimainen hiili") yhdistetään puhtaan hiilen korkean teknologian materiaalin, grafiitin lasimaisten ja keraamisten ominaisuuksien kanssa. Toisin kuin grafiitti, lasimaisella hiilellä on fullereenimainen mikrorakenne. Tämä johtaa monenlaisiin positiivisiin materiaalin ominaisuuksiin. Johtavuus on esimerkiksi alhaisempi kuin grafiitin.
Kaavio

Sp 2 -hybridisoidun hiilen grafiittitason perustasoa kutsutaan kuvaajaksi . Ohuet kerrokset saadaan jakamalla grafiitti kemiallisesti. Muoviin upotettuna se soveltuu lähtöaineeksi uusille komposiittimateriaaleille tai kaksiulotteisten kiteiden tutkimiseen, ja tutkimusta tehdään myös elektroniikan sovelluksista .
Aktiivihiili
Orgaanisten materiaalien, kuten kookoskuorten, huolellinen grafitointi johtaa huokoiseen hiileen. Ontelot on yhdistetty toisiinsa kuin sieni ja muodostavat erittäin suuren sisäpinnan. Aktiivihiili suodattaa liuenneita aineita pieninä pitoisuuksina nesteistä ja voi adsorboida kaasuja.
noki
Noki on myös valmistettu grafiittipohjaisesta hiilestä. Mitä puhtaampi hiilimusta, sitä selvemmin grafiitin ominaisuudet tulevat esiin. Lampun tai kynttilän noki on voimakkaasti saastunut orgaanisilla yhdisteillä, jotka estävät suurempien grafiittiyhdistelmien muodostumisen.
Hiilinanoputket
Toisessa muodossa hiilellä sp 2 hybridisoitunut hiiliatomia järjestetty sylinterimäiseen tavalla . Sen geometria luodaan tasomaisesta grafiittikerroksesta, joka rullataan sylinteriksi. Tuloksena oleva putki voidaan myös kiertää, mikä muuttaa sähköisiä ominaisuuksia. Useat yksiseinäiset putket voivat olla samankeskisesti toistensa sisällä, joten puhutaan moniseinäisistä hiilinanoputkista (MWCNT), toisin kuin yksiseinäisistä hiilinanoputkista (SWCNT).
Hiilinanoputket
Hiilinanoputket yhdistävät hiilinanoputkien ja fullereenien ominaisuudet.
Hiilinanopohja
Hiilinanopohja , aerogeeli , on satunnaisesti suuntautunut, verkkomainen järjestely hiili-grafiittikerroksista. Se on samanlainen kuin lasimainen hiili, vain merkittävästi suuremmilla silloitetuilla onteloilla. Niiden keskimääräinen halkaisija on kuudesta yhdeksään nanometriä .
Tämä on erotettava hiili -aerogeelistä , joka koostuu nanohiukkasista, jotka ovat kasvaneet yhteen. Sen tiheys on 200-1000 kg / m 3 .
Aerographite
Aerographite koostuu huokoisten hiiliputkien verkostosta ja on yksi maailman kevyimmistä kiintoaineista, jonka tiheys on 0,2 milligrammaa kuutiosenttimetriä kohti. Aerographite voidaan puristaa jopa 95% ja irrottaa uudelleen alkuperäiseen muotoonsa.
Ei-grafiittinen hiili
"Ei -grafiittinen hiili koostuu kuusikulmaisesti järjestettyjen, sp 2 -hybridisoitujen hiiliatomien kerroksista . Nämä kerrokset pinotaan lähes yhdensuuntaisesti ilman kolmiulotteista pitkän kantaman järjestystä. ”Tämä materiaali koostuu pinoista grafeenikerroksia, jotka on kierretty ja siirretty toisiaan vasten . Tätä järjestelyä kutsutaan myös turbostratistiseksi. Kerrosten välinen etäisyys voi poiketa merkittävästi grafiitista löydetystä kerrosetäisyydestä. Materiaalin mikrorakenneanalyysi on mahdollista muun muassa käyttämällä WAXS -järjestelmää , mutta merkittävän häiriön aiheuttamien leveiden ja päällekkäisten maksimien vuoksi standardimenetelmiä, kuten Scherrer -yhtälöä, ei voida käyttää.
Karbiini (helminauhat)
Vuonna 2016 oli mahdollista syntetisoida suoraketjut, jotka tunnetaan karabiinina ja jotka koostuvat yli 6000 atomista, kaksiseinäisissä nanoputkissa .
Q-hiili
Q-Carbon on ihmisen tekemä timanttimainen allotrooppinen hiilen muoto, jota kuvataan ferromagneettiseksi ja kovemmaksi kuin timantti.
linkkejä
Hiili on alkuaine, joka voi muodostaa useimmat yhdisteet kaikista elementeistä vedyn jälkeen (vety tulee ensin, koska useimmat hiiliyhdisteet sisältävät myös vetyä). Hiilen erityispiirteet ovat ketjujen ja renkaiden muodostaminen itsensä ja muiden elementtien kanssa sekä kaksois- ja kolmoissidokset π -orbitaalien osallistuessa. Kohtuullisen elektronegatiivisuutensa vuoksi se sitoutuu hyvin sekä sähköpositiivisempiin että elektronegatiivisempiin elementteihin. Kaikki hapetustilat -IV - + IV tapahtuvat luonnollisesti epäorgaanisissa tai orgaanisissa yhdisteissä.
Muutamia poikkeuksia lukuun ottamatta hiiliyhdisteet sisällytetään perinteisesti orgaaniseen kemiaan ; Tätä kutsutaan joskus hiilen kemiaksi. Orgaaninen kemia sisältää enemmän yhdisteitä kuin kaikki epäorgaaninen kemia, koska hiili pystyy muodostamaan pitkiä ketjuja ja kovalenttisia sidoksia muiden atomien kanssa . Myös biokemia on osa orgaanista hiilikemiaa. Yksinkertaisimpia orgaanisia yhdisteitä ovat alkaanit metaani ja etaani .
Vain suhteellisen vähän hiiliyhdisteitä on perinteisesti sijoitettu epäorgaanisten yhdisteiden viereen, joista määrällisesti tärkeimmät ovat happiyhdisteet:
- Karbidit , tyypin E x C y hiilielementtiyhdisteet, joissa hiili on elektronegatiivisempi reagenssi. Monet metallit voivat muodostaa karbideja, joista osa on erittäin kovia ja joita käytetään leikkaustyökaluihin (esim. Volframikarbidi ).
- Hiilimonoksidi CO on erittäin myrkyllinen kaasu, jolla on voimakas pelkistävä vaikutus ja jolla on tärkeä rooli metallien (esim. Raudan ) sulatuksessa .
- Hiilidioksidi CO 2 on kasvihuonekaasu, joka syntyy monissa palamisprosesseissa . Useimmat elävät olennot hengittävät sitä ulos ja kasvit käyttävät sitä fotosynteesissä . Hiilidioksidi on nyt noin 0,04% osa ilmakehästä, esiteollisella aikakaudella osuus oli 0,028%.
- Hiilihappo H 2 CO 3 on metastabiili tuote vedestä ja veteen liuotetusta CO 2 : sta ; kohtalaisen vahva happo, mutta kun otetaan huomioon jatkuva konversio hiilihapon ja liuenneen CO 2: n välillä, se yleensä yhdistetään CO 2: een .
- Suboksidit , kuten trikarbonidi (malonihappoanhydridi, C 3 O 2 ), tetrahiilidioksidi (C 4 O 2 ), pentakarboksidi (C 5 O 2 ), oksaalihappoanhydridi (C 4 O 6 ) ja meliittihappoanhydridi (C 12 O 9) ).
- Vetykarbonaatit tai bikarbonaatit E + HCO 3 - , joista tunnetuin edustaja on natriumvetykarbonaatti , jota käytetään muun muassa hapatusaineena .
- Karbonaatit E 2+ CO 3 2− ovat hiilihapon kaksiarvoisia suoloja . Kaksi tunnetuinta karbonaattia ovat natriumkarbonaatti , yleinen nimi sooda, tärkeä raaka-aine lasin valmistuksessa, ja kalsiumkarbonaatti , josta z. B. simpukat ja etanat rakentavat kuoret ja tallettavat kovat korallit . Niiden ja muiden prosessien kautta pitkän ajan kuluessa muodostunut kalsiumkarbonaatti muodostaa nyt kokonaisia vuoria (katso: Kalkkikivi ). Kalsiumkarbonaatti on edelleen tärkeä rakennusmateriaali.
- Hiili-rikkiyhdisteet, joista tunnetuin on hiilidisulfidi ( hiilidisulfidi , CS 2 ), erittäin myrkyllinen neste.
- Hiili-typpiyhdisteet, kuten syanidit , joiden tunnetuin edustaja on kaliumsyanidi, erittäin voimakas myrkky, joka estää hengityksen . Monet muut syanidit ovat samalla tavalla myrkyllisiä.
Isotoopit
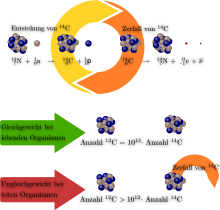
Tunnetaan yhteensä 15 isotooppia välillä 8 C - 23 C hiiltä. Näistä kaksi, isotoopit 12 C ja 13 C, ovat stabiileja ja esiintyvät luonnossa. Isotooppi, jolla on suurempi osuus luonnollisesta isotooppikoostumuksesta, on 12 ° C ja 98,93%, 13 ° C on 1,07%. Pisimpään eli epävakaa isotoopit ovat 11 ° C, mikä muuttuu ja 11 B , joissa on puoli-elämän on 20,364 minuutin ajan β + säteilyä , ja 14 C, joka hajoaa ja 14 N , jossa puoli-elämän 5730vuosi beta rappeutuminen. Kaikilla muilla isotoopeilla on vain lyhyt puoliintumisaika sekunteja tai millisekunteja.
Määritelmän mukaan 12 C on atomipainayksikön vertailupiste . 13 ° C voidaan havaita NMR -spektroskooppisissa tutkimuksissa, koska toisin kuin 12 ° C, sillä on magneettinen momentti. Näiden kahden isotoopin suhdetta kutsutaan Δ13C: ksi, ja sitä käytetään geokemiassa , paleoklimatologiassa ja paleokeanografiassa .
14 C syntyy 14 N : n reaktiosta kosmisen säteen kanssa . Elävät organismit, jotka ottavat osaa hiilen kierto näyttää samassa suhteessa 14 C suhteessa hiilen kokonaismäärästä ne sisältävät ilmakehän. Kun aineenvaihdunta on päättynyt, esimerkiksi puun kaatamisen jälkeen, tämä osuus pienenee vähitellen radioaktiivisen hajoamisen vuoksi. Sen vuoksi 14 C: n osuuden määrittäminen kokonaishiilipitoisuudesta mahdollistaa orgaanisesta materiaalista valmistettujen esineiden iän määrittämisen, radiohiilimenetelmän , jota käytetään pääasiassa arkeologiassa .
CO 2 saatu maakaasua tai öljyä ja maan vaipan sisällä juuri lainkaan 14 C, joka hajoaa kanssa puoli-elämän 5730vuosi, verrattuna CO 2 ilmasta, jossa 14 C-isotooppi jatkuvasti toistetaan. 14 C voidaan tämän vuoksi käyttää eräänlaisena merkkiaineen jotta käytön scintillation spektrometrit määrittää polun tai sisältöä molekyylejä, jotka perustuvat vaseliiniin tai tulevat maan vaipan kasveissa. Esimerkiksi, CO 2 liikenteen Hengitysketjun .
Lyhytaikaista isotooppia 11 C käytetään PET-nuklidina . Tätä tarkoitusta varten se tuotetaan syklotronilla ja muunnetaan radiofarmaseuttisiksi lääkkeiksi , kuten [ 11 C] koliiniksi, käyttäen sopivia kemiallisia prosesseja .
kirjallisuus
- AF Holleman , E.Wiberg , N.Wiberg : Epäorgaanisen kemian oppikirja . 102 painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s. 861-918.
- NN Greenwood, A.Earnshaw: Elementtien kemia. 1. painos. VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9 , s. 327-419.
nettilinkit
Yksilöllisiä todisteita
- ↑ Harry H. Binder: Kemiallisten alkuaineiden sanakirja. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Ominaisuuksien arvot (tietoruutu) on otettu osoitteesta www.webelements.com (hiili) , ellei toisin mainita .
- ↑ IUPAC: n suosittelema vakioarvo on annettu, koska tämän elementin isotooppikoostumus voi vaihdella paikallisesti, suluissa ilmoitettu massa -alue johtaa keskimääräiseen atomipainoon. Katso: Michael E. Wieser, Tyler B. Coplen: Elementtien atomipainot 2009 (IUPAC Technical Report). Julkaisussa: Pure and Applied Chemistry , 2010, s.1 ( doi: 10.1351 / PAC-REP-10-09-14 ).
- ^ IUPAC, Standard Atomic Weights Revised 2013 .
- ↑ a b c d e entry on carbon in Kramida, A., Ralchenko, Yu., Reader, J. and NIST ASD Team (2019): NIST Atomic Spectra Database (versio 5.7.1) . Toim.: NIST , Gaithersburg, MD. doi : 10.18434/T4W30F ( https://physics.nist.gov/asd ). Haettu 11. kesäkuuta 2020.
- ↑ b c d e merkintä hiilen klo WebElements, https://www.webelements.com , pääsee 11. kesäkuuta 2020 mennessä.
- ^ AF Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 102 painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s.864.
- ↑ Robert C.Weast (toim.): CRC Handbook of Chemistry and Physics . CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9 , s. E-129-E-145. Siellä olevat arvot perustuvat g / mol ja annetaan cgs -yksiköissä. Tässä määritetty arvo on siitä laskettu SI -arvo ilman mittayksikköä.
- ↑ a b M. D. Simon, AK Geim: Diamagneettinen levitaatio: Lentävät sammakot ja kelluvat magneetit. Julkaisussa: Journal of Applied Physics . 87, 2000, s. 6200-6204 ( doi: 10.1063 / 1.372654 ).
- ↑ a b David R. Lide (toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, s. 4-8.
- ↑ David R.Lide (toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, s.4-135.
- ↑ b Merkintä hiili on GESTIS aine tietokanta IFA , pääsee 30. huhtikuuta 2017 mennessä. (JavaScript vaaditaan)
- ^ A b Theodore L. Brown, H. Eugene Le May, Bruce E. Bursten: Kemia Keskeinen tiede . MZ Pearson Studium Deutschland GmbH, München 2007, ISBN 978-3-8273-7191-1 , s. 1123 .
- ↑ Markus Reichstein : kaikkialla ja kaikkialla. Maanpäällinen hiilikierto ilmastojärjestelmässä. Julkaisussa: Jochem Marotzke , Martin Stratmann (Toim.): Ilmaston tulevaisuus. Uusia oivalluksia, uusia haasteita. Raportti Max Planck Societylta. Beck, München 2015, ISBN 978-3-406-66968-2 , s. 125–127.
- ↑ Bing K. Yen, Birgit E. Schwickert: Alkuperäinen alhaisen kitkan käyttäytymistä grafiitti tutkittiin pinta röntgendiffraktiolla. (PDF; 215 kB), toukokuu 2004.
- ^ A. Greenville Whittaker: Kiistanalainen hiili-kiinteä-nestehöyry-kolmoispiste . Julkaisussa: Nature . nauha 276 , 1978, s. 695-696 , doi : 10.1038 / 276695a0 .
- ↑ JM Zazula: Grafiittimuunnoksista korkeassa lämpötilassa ja paineessa, joka aiheutuu LHC -säteen absorboitumisesta. (PDF) CERN, 1997, käytetty 6. kesäkuuta 2009 .
- ↑ GIT -laboratoriolehti. Numero 9/2013, s. 596, Jürgen Quadbeck-Seegerin (toim.) Mukaan: Chemistry Records. Wiley-VCH.
- ↑ MEL Science: Hiilen ominaisuudet ja ominaisuudet sekä sen reaktiot hapen kanssa ( Memento 4. elokuuta 2019 Internet -arkistossa )
- ^ MA Carpenter: Mineraalien vaiheiden siirtymien termodynamiikka: makroskooppinen lähestymistapa. Julkaisussa: Minerals Stability. Chapman & Hall, Lontoo 1992.
- ^ E. Salje: Vaihesiirrot ferroelastisissa ja koelastisissa kiteissä. Cambridge University Press, Cambridge 1990.
- ↑ Katharina Kaiser, Lorel M.Scriven, Fabian Schulz, Przemyslaw Gawel, Leo Gross, Harry L.Anderson: Sp-hybridisoitunut molekyylihiilialotrooppi, syklo [18] hiili . Julkaisussa: Science . 2019, s. eaay1914 , doi : 10.1126 / science.aay1914 .
- ^ Käännös E. Fitzer, K.-H. Kochling, HP Boehm, H. Marsh: Suositeltu terminologia hiilen kuvaamiseen kiinteänä aineena (IUPAC -suositukset 1995). Julkaisussa: Pure and Applied Chemistry , 1995, 67, s. 473-506 ( doi: 10.1351 / pac199567030473 ): "Ei-grafiittiset hiili koostuu kerroksista kuusikulmaisesti järjestettyjä sp 2- hiiliatomeja, jotka on pinottu lähes yhdensuuntaisesti ilman kolmiulotteisia pitkän kantaman tilaus. "
- ↑ Kemia: Ennätyksen pituus: hiili helminauhana. on: orf.at , 4. huhtikuuta 2016, katsottu 4. huhtikuuta 2016.
- ↑ G.Audi, FG Kondev, Meng Wang, WJ Huang, S.Naimi : NUBASE2016 -arviointi ydinominaisuuksista. Julkaisussa: Chinese Physics C.41, 2017, S. 030001, doi : 10.1088 / 1674-1137 / 41/3/030001 ( koko teksti ).