jalokaasut
|
Sijainti jaksollisessa taulukossa
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ryhmä | 18. päivä |
| Pääryhmä | 8. |
| aikana | |
| 1 |
2 Hän |
| 2 |
10 Ne |
| 3 |
18 aaria |
| Neljäs |
36 kr |
| 5 |
54 Xe |
| 6. |
86 kohta |
| Seitsemäs |
118 edellä |
Jalokaasut , myös inerttien kaasujen tai inerttien kaasujen, muodostavat ryhmän , että jaksollisen järjestelmän elementtien , joka sisältää seitsemän elementtiä : helium , neon , argon , krypton , ksenon , radioaktiivisen radonin ja keinotekoisesti, myös radioaktiivisia oganesson . Ryhmää kutsutaan järjestelmällisesti 8. pääryhmäksi tai jaksollisen taulukon uudemman luokituksen mukaan ryhmäksi 18 ja se näkyy jaksollisen taulukon oikeassa reunassa halogeenien vieressä .
Kaikkien jalokaasuatomien yhtenäinen pääominaisuus on, että kaikki niiden elektronikuoret ovat joko kokonaan elektronien varassa tai tyhjiä ( jalokaasukonfiguraatio ): On vain täysin täytettyjä atomirataaleja , mikä tarkoittaa, että jalokaasut tulevat kemiallisiin reaktioihin vain äärimmäisissä olosuhteissa ; ne eivät myöskään muodosta molekyylejä keskenään, mutta ovat yksiatomisia ja kaasuja huoneenlämpötilassa . He ovat velkaa ryhmänimensä tälle matalalle reaktiivisuudelle , joka perustuu jalometalleihin , jotka eivät myöskään ole kovin reaktiivisia .
Helium on ylivoimaisesti yleisin jalokaasu. Argoni on yleisin maan päällä; kaikki muut ovat maan harvinaisia ainesosia. Kaasuihin ne ovat osia ilman ; Maakaasussa olevaa heliumia lukuun ottamatta niitä esiintyy maankuoressa vain hyvin pieninä määrinä. Ne löydettiin - lukuun ottamatta oganessonia, jota tuotettiin vasta vuonna 2006 - nopeasti peräkkäin vuosina 1868 (helium) - 1900 (radon). Suurin osa jalokaasuista eristettiin ensin brittiläisen kemian William Ramsayn toimesta .
Jalokaasuja käytetään pääasiassa suojakaasuna , esim. B. in hehkulamput , ne ovat tärkeitä täyttö kaasua kaasupurkauslamppuja , jossa ne hehkuvat tunnusomainen väri kunkin kaasun. Raskaampien jalokaasujen, erityisesti ksenonin, matalasta reaktiivisuudesta huolimatta kemialliset yhdisteet tunnetaan. Tärkein näistä on voimakas hapetin ksenon (II) fluoridi .
historia
Henry Cavendish löysi ensimmäisen merkin siitä, että ilma sisältää reagoimattoman kaasun vuonna 1783 . Hän sekoitti ilmaa ja happea siten, että sen sisältämät alkuaineet, typpi ja happi staattisen sähkön avulla reagoivat täysin typpioksidit . Reagoimaton jäännös jätettiin taakse. Hän ei kuitenkaan tajunnut, että se oli uusi kaasu - argonin ja muiden jalokaasujen seos - eikä jatkanut kokeitaan.
Ensimmäisenä jalokaasuna Jules Janssen ja Norman Lockyer löysivät heliumin toisistaan riippumatta vuonna 1868 . Kaksi tähtitieteilijät - Janssen Intiassa, Lockyer Englannissa - havaittu auringon spektrin ja löysi aiemmin tuntemattoman keltainen spektriviivan , jonka aallonpituus on 587,49 nm . Edward Frankland nimitti uuden elementin heliumiksi antiikin Kreikan ἥλιος héliosin mukaan auringolle . Ensimmäiset todisteet maapallon heliumista onnistuivat vuonna 1892 Luigi Palmierissa suorittamalla Vesuviuksen - Lavan spektrianalyysi .
Lord Rayleigh jatkoi Cavendishin kokeita ilman tutkimiseen vuodesta 1888 eteenpäin. Hän huomasi, että ilmasta saadulla "typellä" on erilainen tiheys kuin ammoniakin hajotessa . Rayleigh epäili siksi, että ilmassa on oltava vielä tuntematon, inertti ainesosa. Siksi hän ja William Ramsay yrittivät poistaa typpeä ilmanäytteestä reagoimalla magnesiumin kanssa ja eristää tämän tuntemattoman kaasun. Vuonna 1894 he onnistuivat lopulta spektroskopi- jotka sijoittuvat uuden elementin, joka he nimesivät argon jälkeen Kreikan ἀργός Argos , "hidas" .
Sen jälkeen kun heliumin ja argonin tärkeimmät ominaisuudet oli määritetty, havaittiin, että nämä kaasut, toisin kuin muut ilmakehän kaasut, ovat monatomisia. Tämän tunnisti se tosiasia, että vakiopaineella olevan molaarisen lämpökapasiteetin C p suhde jalokaasujen vakiotilavuuteen perustuvaan lämpökapasiteettiin C V on erittäin suuri, 1,67 (= C p / C V ), kun taas piimaa- ja polyatomisilla kaasuilla on merkittävästi pienemmät arvot. Sitten William Ramsay epäili, että kausijärjestelmässä on oltava joukko sellaisia kaasuja, jotka muodostavat erillisen ryhmän, ja hän alkoi etsiä niitä. Vuonna 1898 hän ja Morris William Travers onnistuneet eristämään ilmassa, neon , krypton ja ksenon mukaan jakotislauksella .
Viimeinen luonnossa esiintyviä jalokaasuja 1900 Friedrich Ernst Dorn kuten radium ilmentymä (uloshengityksen of radium että) Radon löysi ja merkitään symbolilla Em. Tämä oli marginaalinumero isotooppi 222. Muut radonisotoopit löysivät Ernest Rutherford ja André-Louis Debierne, ja niiden uskottiin alun perin olevan erillisiä elementtejä. Vasta sen jälkeen, kun William Ramsay määritti spektrin ja muut ominaisuudet vuonna 1910, hän tajusi, että se oli yksi elementti. Aluksi hän kutsui tätä nitonia (Nt), nimeä radoni on käytetty vuodesta 1934. Oganesson , viimeinen osa ryhmän, voitaisiin tuottaa ensimmäisen kerran vuonna 2002-2005 on Yhdistyneessä Institute for Nuclear Research in Dubnan jälkeen useita epäonnistuneita yrityksiä .
Pian löydön jälkeen yritettiin syntetisoida jalokaasujen yhdisteitä. Vuonna 1894 Henri Moissan yritti saada aikaan argonin reaktion fluorin kanssa , mutta epäonnistui. Vuonna 1924 A. von Antropoff väitti syntetisänne ensimmäisen kryptoniyhdisteen punaisen stabiilin kiinteän aineen muodossa kryptonista ja kloorista . Myöhemmin kuitenkin kävi ilmi, että tämä yhdiste ei sisältänyt kryptonia, vaan typpimonoksidia ja kloorivetyä .
Kanssa ksenon hexafluoroplatinate , Neil Bartlett löysi ksenon yhdiste ensimmäisen kerran vuonna 1962 ja näin ollen ensimmäinen jalokaasuyhdiste koskaan. Vain muutaman kuukauden kuluttua tämän löydön, elokuussa 1962 synteesi ksenon (II) fluoridi , jonka Rudolf Hoppe ja että ksenon (IV) fluoridi , jonka johtama American kemistit C. L. Chernick ja H. H. Claassen jälkeen lähes samanaikaisesti . Pian ensimmäisen salausyhteyden jälkeen voitiin osoittaa, että alun perin A. V. Grosse kryptontetrafluoridi katsoi, että kuitenkin uusien kokeiden jälkeen tunnistettiin kryptonidifluoridi . Vuonna 2000 syntetisoitiin ensimmäinen argoniyhdiste, erittäin epästabiili argonfluorihydridi .
Esiintyminen
| elementti | Aurinkokunta (atomit suhteessa Si: ään (Si = 1 · 10 6 )) |
Maan ilmakehä (tilavuus, ppm) |
Maan kuori (massa, ppm) |
|---|---|---|---|
| Hei | 2.21 · 10 9 | 5.24 | 0,008 |
| Ei | 3,44 · 10 6 | 18.18 | 0,005 |
| Ar | 1.172 · 10 5 | 9340 | 3.5 |
| Kr | 46.8 | 1.14 | 0,0001 |
| Xe | 5.38 | 0,09 | 3 · 10 −5 |
| Marg | 0.06 ... 18 · 10 −19 | 4 · 10 −13 |
Jalokaasuja esiintyy pääasiassa maan ilmakehässä , mutta vähemmässä määrin myös maankuoressa; niiden taajuudet ovat kuitenkin hyvin erilaisia. Ylivoimaisesti yleisimpiä ovat argon, jonka tilavuusosuus on 0,934% (9340 ppm), muodostaa merkittävän osan koko ilmakehästä. Kaikki muut ovat paljon harvinaisempia, joiden osuudet ovat alle 20 ppm, joten ne lasketaan hivekaasuihin . Krypton, ksenoni ja radoni ovat maan harvinaisimpia elementtejä. Helium on myös osa maakaasua , josta se voi olla jopa 16% tilavuudesta.
Alhaisen tiheyden vuoksi pieni määrä heliumia jättää jatkuvasti maapallon ilmakehän avaruuteen ja maan päällä muodostuu jatkuvasti jalokaasuja, jotka määräävät merkittävästi niiden taajuudet ja isotooppisuhteet. Argoni, erityisesti isotooppi 40 Ar, muodostuu kaliumisotoopin 40 K. hajoamisen seurauksena . Heliumia tuotetaan raskaiden alkuaineiden, kuten uraanin tai toriumin (alfa-hiukkaset) alfa-hajoamisessa , ksenonia harvinaisessa spontaanissa uraanin hajoamisessa . Lyhytikäinen radoni-isotooppi 222 Rn, jonka puoliintumisaika on 3,8 päivää, on yleisin ja välituote 238 U .: n hajoamissarjassa . Muut, jopa lyhyempiä isotoopit, kuuluvat myös uraanin, toriumin hajoamissarjaan. tai neptunium-isotoopit. Näiden hajoamisprosessien ansiosta jalokaasut löytyvät myös loukussa kiviin. Heliumia löytyy monista uraanimalmeista, kuten uraniniitista ja argonista, valtameren kuoren basaltista ; se vapautuu vasta, kun ympäröivä kivi sulaa.
Frekvenssijakauma jalokaasujen maailmankaikkeudessa voidaan pitkälti selittää , että nukleosynteesi reittejä. Mitä raskaampi jalokaasu, sitä harvinaisempi se on. Helium, joka muodostuu sekä alkeellisella nukleosynteesillä että tähtien nukleosynteesillä vedystä, on toiseksi yleisin alkuaine vedyn jälkeen. Neon ja argon ovat myös yleisimpiä elementtejä maailmankaikkeudessa. Kryptoni ja ksenoni, joita ei tuoteta tähtien nukleosynteesillä ja jotka muodostuvat vain harvoissa tapauksissa, kuten supernoovat , ovat paljon harvinaisempia. Harkinsin säännön mukaan jalokaasut ovat säännöllisen rakenteensa ansiosta parillisella määrällä protoneja yleisempiä kuin monet samanlaiset raskaat alkuaineet.
Uuttaminen
Suurta osaa heliumia ja radioaktiivisia aineita lukuun ottamatta jalokaasut uutetaan yksinomaan ilmasta. Niitä esiintyy sivutuotteina Linden prosessin typen ja hapen tuotannossa . Pääasiassa rektifikaatiokolonniin , jossa happi ja typpi erotetaan, eri jalokaasujen kerätä eri kohdissa. Ne voidaan kuitenkin siirtää omaan pylvääseensä ja erottaa siellä kaikista muista kaasuista. Vaikka argoni voidaan helposti erottaa ja se on vapautettava vain typestä ja hapesta, heliumin ja neonin, mutta myös kryptonin ja ksenonin, ongelmana on, että ne ensin kertyvät yhdessä ja sitten ne on erotettava. Tämä voidaan tehdä toisen tasasuuntauskolonnin kautta tai adsorpoimalla eri tavalla kaasuja sopiviin adsorptioväliaineisiin.
Heliumia on saatu pääasiassa maakaasusta ainakin vuodesta 1980 lähtien . Tämä helium lähde havaittiin ensimmäisen kerran vuonna Yhdysvalloissa , myöhemmin käytetään myös Neuvostoliitossa, tänään muutamissa muissa maissa ja kasveja, esimerkiksi Algeriassa, saantoa, joka nesteytetyn alhaisissa lämpötiloissa, on lähetetty jotta Marseille ja siten Euroopassa on 40-jalka kontti . Se voidaan erottaa maakaasun muista komponenteista raakaheliumina joko pakastamalla kaikki muut kaasut tai tunkeutumalla sopiviin kalvoihin . Sitten helium on vapautettava häiritsevistä kaasuista, kuten typestä tai vedystä , paineenvaihteluadsorptiolla , kemiallisilla tai kryoteknisillä prosesseilla.
Radonia ei voida saada suurina määrinä sen lyhyen puoliintumisajan vuoksi. Pienemmässä mittakaavassa radium toimii lähteenä, radonia syntyy, kun tämä alkuaine hajoaa ja kaasuttuu vastaavasta valmisteesta. Oganesson voitaisiin valmistaa keinotekoisesti osa muutaman atomin pommittamalla kalifornium kanssa kalsium -atomia.
ominaisuudet
Fyysiset ominaisuudet
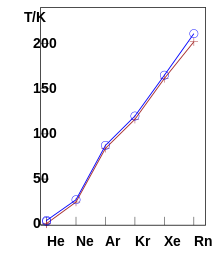
Kaikki jalokaasut ovat yksiatomisia, värittömiä ja hajuttomia kaasuja normaaleissa olosuhteissa. Ne tiivistyvät ja kiinteytyvät vain hyvin matalissa lämpötiloissa, sulamis- ja kiehumispisteet ovat korkeammat, sitä suurempi on atomimassa. Kiehumispiste helium on 4,224 K (-268,926 ° C), vain absoluutti- sen nollapisteen yläpuolella, raskain jalokaasun radon kiehuu 211,9 K (-61,25 ° C).
Heliumin erikoisuus on, että se on ainoa alkuaine, joka ei jähmetä ilmakehän paineessa ja selvästi sen yläpuolelle. Sen sijaan 2,17 K: n lämpötilassa se muuttuu aineen erityistilaksi, ylivirtaukseksi . Tässä neste menettää sisäisen kitkansa ja voi esimerkiksi ryömiä korkeamman astian seinämien yli ( Onnes-vaikutus ). Vain paineissa, jotka ovat yli 25 316 bar, heliumi jähmettyy 0,775 K: n lämpötilassa. Nämä lämpötilat ja paineet koskevat vain yleistä isotooppia 4 He, harvinaisella, toisella, kevyemmällä, stabiililla isotoopilla 3 He, toisaalta, on huomattavasti erilaiset ominaisuudet. Siitä tulee supernestettä vain alle 2,6 · 10 −3 K. Sulamispiste, kiehumispiste ja kriittinen piste ovat myös eri lämpötiloissa ja paineissa.
Heliumia lukuun ottamatta, joka kiteytyy kuusikulmaisessa kristallijärjestelmässä , kaikilla jalokaasuilla on kasvokeskeinen kuutiomainen kiderakenne. Kuten kasvavilta atomisäteiltä odotetaan, hilaparametri a kasvaa neonista radoniksi.
Kuten odotettiin, jalokaasujen tiheydet korreloivat myös atomimassan kanssa. Vedyn jälkeen helium on kaasu, jolla on pienin tiheys. Ainoana muuna jalokaasuna neonilla on alhaisempi tiheys kuin ilman, kun taas argon , krypton , ksenoni ja radoni ovat tiheämpiä. Radonin tiheys on 9,73 kg / m 3, joten se on kaikkien tiheimpiä kaasuja.
| elementti | Helium ( 3 Häntä ja 4 Häntä) | neon | argon | krypton | ksenoni | radon | |
|---|---|---|---|---|---|---|---|
| Värillinen kaasupurkaus |  |
 |
 |
 |
 |
punainen | |
| Sulamispiste (1013 hPa) | 0,319 K (−272,831 ° C) (29,315 bar) |
0,775 K (−272,375 ° C) (25,316 bar) |
24,57 K (−248,58 ° C) |
84,0 K (−189,2 ° C) |
116,2 K (−157,0 ° C) |
161,4 K (−111,8 ° C) |
noin 202 K (noin −71 ° C) |
| Kiehumispiste (1013 hPa) | 3,1905 K (−269,9595 ° C) |
4,224 K (−268,926 ° C) |
27,09 K (−246,06 ° C) |
87,295 K (-185,855 ° C) |
119,79 K (-153,36 ° C) |
165,03 K (-108,12 ° C) |
211,9 K (-61,3 ° C) |
| Kriittinen piste |
|
|
|
|
|
|
|
| Kolmoispiste | ei käytettävissä |
|
|
|
|
|
|
| Tiheys (0 ° C, 1013 hPa) | 0,13448 kg / m 3 | 0,177847 kg / m 3 | 0,9000 kg / m 3 | 1,7839 kg / m 3 | 3,7493 kg / m 3 | 5,8971 kg / m 3 | 9,73 kg / m 3 |
| rakenne |  |
 |
 |
 |
 |

|
|
| Kristallijärjestelmä | kuusikulmainen | kuutio | kuutio | kuutio | kuutio | kuutio | |
| Säleparametrit |
|
a = 4,43 Å |
a = 5,26 Å |
a = 5,72 Å |
a = 6,20 Å |
a = 6,55 Å (laskettu) |
|
Oganessonin ominaisuuksia ei voida määrittää kokeellisesti sen lyhyen puoliintumisajan vuoksi. Mukaan Teoreettisesti ajatellen , koska relativistiset vaikutuksia ja korkea polaarisuus oganesson atomi, voidaan olettaa, että oganesson on huomattavasti reaktiivisempi kuin radon. On myös epätodennäköistä, että se on kaasumaista vakio-olosuhteissa ; kiehumispiste välillä 320-380 K voidaan olettaa ekstrapoloimalla.
- Jalokaasut kaasupurkauslampuissa
Atomiominaisuudet
Jalokaasujen tapauksessa kaikki elektronikuoret ovat joko kokonaan elektronien käytössä tai tyhjiä. Siksi tätä tilaa kutsutaan myös jalokaasukonfiguraatioksi . Helium on ainoa jalokaasu, jossa vain yksi kiertorata on täysin varattu (koska 1p-kiertorataa ei ole), kaikkien muiden kanssa syrjäisin käytössä oleva kiertorata on p-kiertorata . Kvanttimekaniikan lakien mukaan tämä orbitaalien tila on erityisen suotuisa energian suhteen. Siksi myös muiden alkuaineiden atomeilla on taipumus saavuttaa jalokaasukonfiguraatio vapauttamalla tai hyväksymällä elektroneja ( jalokaasusääntö ).
Jalokaasujen ominaisuudet määrää selvästi se, että ne eivät saavuta jalokaasukonfiguraatiota vapauttamalla tai hyväksymällä elektroneja, vaan pikemminkin neutraalissa, ionisoimattomassa tilassa. Jalokaasut ovat sen vuoksi monatomisia, niillä on suuri ionisaatioenergia ja ne eivät melkein reagoi muiden alkuaineiden tai yhdisteiden kanssa.
Kemialliset ominaisuudet
Jalokaasuatomien rakenteesta huolimatta raskaat jalokaasut eivät ole täysin reagoimattomia ja voivat muodostaa joitain yhdisteitä. Tämä johtuu valenssielektronien ja ytimen suuremmasta etäisyydestä , joka vähentää ionisaatioenergiaa, sekä relativistisista vaikutuksista . Suurin valikoima yhdisteitä tunnetaan ksenonista eikä odotetusti radonista, koska voimakas radioaktiivisuus ja lyhyt puoliintumisaika vaikeuttavat yhdisteiden muodostumista ja niiden tutkimista.
Ainoa elementti, joka pystyy reagoimaan suoraan ksenonin, radonin ja tietyissä olosuhteissa kryptonin kanssa, on fluori . Vaikka kryptonin ja fluorin reaktiossa muodostunut krypton (II) -fluoridi on termodynaamisesti epästabiili ja sitä voidaan siten syntetisoida vain matalissa lämpötiloissa, ksenoni- ja radonfluoridit ovat stabiileja myös huoneenlämpötilassa. Muut alkuaineet eivät reagoi jalokaasujen kanssa, mutta tunnetaan useita muita yhdisteitä, joihin pääsee fluoridireaktioiden kautta.
Lukuun ottamatta yhtä tunnettua argoniyhdistettä, HArF: ää, kevyiden jalokaasujen heliumin, neonin ja argonin yhdisteiden reaktiivisuutta ja stabiilisuutta voitiin tutkia vain teoreettisesti. Niinpä neonia pidetään vähiten reaktiivisena jalokaasuna. Laskelmat osoittivat, että ainoan teoreettisesti stabiilin heliumyhdisteen, HHeF: n, neonanalogin ei pitäisi olla stabiili.
Jalokaasujen kemiallisten yhdisteiden puuttumisen vuoksi niiden elektronegatiivisuuksien numeerisia arvoja ei ollut pitkään aikaan - toistaiseksi vain Pauling- asteikon arvot kahdelle alkuaineelle - ksenonille (2,6) ja kryptonille (3,0) ) voidaan määrittää suunnilleen vastaavaksi kuin halogeenit. Toisaalta Mullikenin , Allredin ja Rochow'n mukaan uudemmissa elektronegatiivisuusasteikoissa numeeriset arvot voidaan laskea myös muille jalokaasuille, jotka tässä tapauksessa ylittävät halogeenien arvot. Esimerkiksi heliumille ne ovat 5,50 Allred-Rochow'n mukaan ja 4,86 Mullikanin mukaan.
käyttää


Jalokaasuja käytetään kaasupäästöissä niiden matalan reaktiivisuuden, matalien sulamispisteiden ja ominaisvärien vuoksi. Erityisesti argonia ja heliumia käytetään suuremmassa mittakaavassa, muita jalokaasuja voidaan tuottaa vain pienemmissä määrissä ja ne ovat siten kalliita. Alhaista reaktiivisuutta käytetään inertinä tai suojakaasuna esimerkiksi kaasusuojatussa hitsauksessa ja tiettyjen metallien, kuten titaanin tai tantaalin, tuotannossa . Argonia käytetään pääasiassa tähän aina, kun halvempaa mutta reaktiivisempaa typpeä ei voida käyttää.
Kaasupäästöjen tapauksessa jokainen jalokaasu lähettää tyypillisen väristä valoa. Esimerkiksi neonissa emittoitunut valo on punainen, argonin kanssa violetti ja kryptonin tai ksenonin kanssa sininen. Tätä käytetään kaasupurkauslampuissa . Ksenonilla on erityinen merkitys, koska ksenonkaasupurkauslampun spektri vastaa suunnilleen päivänvalon spektriä . Siksi sitä käytetään myös auton ajovaloissa " ksenonvalona ". Myös tähän periaatteeseen perustuvat putket , ensimmäisen käytetyn hiilikaasun Neon jälkeen, niitä kutsutaan myös loistelampuiksi . Sen sijaan fluoresoivat lamput, jotka tunnetaan puhekielellä nimellä "neonputket", eivät käytä jalokaasua, vaan pikemminkin elohopeahöyryä valonlähteenä. Jopa lamput ovat täynnä jalokaasuja, kryptonia tai argonia usein. Tämän seurauksena hehkulangan efektiivinen haihtumisnopeus on pienempi, mikä mahdollistaa korkeamman lämpötilan ja siten paremman valosaannon.
Alhaisten sulamis- ja kiehumispisteidensä vuoksi jalokaasut ovat tärkeitä jäähdytysnesteinä . Ennen kaikkea nestemäisellä heliumilla on merkitys tässä, koska se mahdollistaa erityisen alhaisen lämpötilan saavuttamisen. Tämä on tärkeää esimerkiksi suprajohtaville magneeteille , joita käytetään esimerkiksi ydinmagneettisen resonanssin spektroskopiassa . Jos sovellukseen ei tarvitse saavuttaa niin alhaisia lämpötiloja kuin nestemäisen heliumin tarjoamat lämpötilat, voidaan käyttää myös korkeammalla kiehuvia jalokaasuja, kuten neonia.
Kuten kaikkien kaasujen, jalokaasujen on narkoottinen vaikutus, riippuen paine, estämällä kalvot on hermosoluja . Heliumille ja neonille vaadittavat paineet ovat niin korkeat, että ne voidaan saavuttaa vain laboratoriossa; neonille tarvittava paine on 110 bar. Koska ne eivät voi aiheuttaa syvä myrkytyksen , nämä kaksi kaasua ovat sekoitetaan happea ( " heliox 'ja' Neox '), myös hapen ja typen (' Trimix "), jota käytetään hengityskaasujen kun sukellus . Näillä on mahdollista saavuttaa suurempia syvyyksiä kuin ilman avulla. Ksenon, toisaalta, on narkoottinen vaikutus jopa ympäristön paineessa ja voidaan siksi käyttää kuin inhalaatioanesteetin sijasta typpioksiduulia . Sitä käytetään kuitenkin harvoin sen korkean hinnan ja alhaisen saatavuuden vuoksi.
Helium täyttö ja nostamalla kaasun ja kaasun ilmapalloja ja zeppeliinejä . Heliumin lisäksi voidaan käyttää myös vetyä . Tämä on kevyempää ja sallii enemmän hyötykuormaa, mutta se voi reagoida ilmassa olevan hapen kanssa ja palaa. Tätä vaaraa ei ole olemassa reagoimattomalla heliumilla.
Jalokaasuja tuotetaan eri määrinä niiden taajuuden ja saatavuuden mukaan. Vuonna 1998 tuotetun argonin määrä oli noin 2 miljardia m 3 , kun taas heliumia eristettiin noin 130 miljoonaa m 3 . Sen sijaan maailman ksenonin vuosituotannon arvioidaan olevan vain 5000–7000 m 3 vuodelle 1998 (kullekin tavanomaiselle kuutiometrille ). Kaasujen hinnat ovat vastaavasti erilaiset: argon maksaa noin 15 euroa kuutiometriltä (vakio-olosuhteissa, laboratorion laatu), ksenoni maksaa 10000 euroa kuutiometriltä (vuodesta 1999).
linkkejä
Ksenoniyhdisteet
Ksenonilla on suurin valikoima jalokaasuyhdisteitä. Tärkeimmät ja vakain ovat ksenonfluoridit ksenon (II) fluori , ksenon (IV) fluori ja ksenon (VI) fluori , jotka syntetisoidaan reagoimalla ksenonilla ja fluorilla eri suhteissa. Ksenon (II) fluoridi on ainoa jalokaasuyhdiste, jota käytetään teknisesti pieninä määrinä; se toimii vahvana hapettimena ja fluorattavana aineena orgaanisessa kemiassa.
Hapen avulla ksenoni saavuttaa korkeimman mahdollisen hapetustason +8. Tämä saavutetaan ksenon (VIII) oksidi ja oxyfluoride ksenondifluoridin trioksidi Xeo 3 F 2 ja perxenates on muodossa Xeo 4 - . Lisäksi, ksenon (VI) oksidi ja oxyfluorides Xeo 2 F 2 ja XeOF 4 hapetustilassa +6 ja oxyfluoride XeOF 2 kanssa neliarvoisen xenon tunnetaan. Kaikki ksenonoksidit ja oksifluoridit ovat epävakaita ja usein räjähtäviä. Ksenonin yhdisteet typen, kloorin ja hiilen kanssa tunnetaan myös. Metallien kanssa komplekseja, kuten kulta tai elohopea voitaisiin myös syntetisoida mukaisesti erittäin happamissa olosuhteissa .
Muiden jalokaasujen yhdisteet
Muista jalokaasuista tunnetaan vain pieni määrä yhdisteitä. Radoniyhdisteiden tulisi olla termodynaamisesti yhtä stabiileja kuin ksenoniyhdisteet, mutta niiden synteesi ja tarkka karakterisointi ovat äärimmäisen vaikeita radoni-isotooppien voimakkaan radioaktiivisuuden ja lyhyen puoliintumisajan vuoksi . Stabiilin radon (II) fluoridin olemassaolon oletetaan olevan olemassa, koska radonia ei voida enää havaita nestemäisen klooritrifluoridin läpäisyn jälkeen, ja sen on sen vuoksi oltava reagoitunut. Jos tämän liuoksen jäännökset liuotetaan veteen tai happoihin, muodostuvat hajoamistuotteet ovat happi ja fluorivety samassa suhteessa kuin kryptonin tai ksenonidifluoridin kanssa.
Kaikki tunnetut kevyempien jalokaasujen yhdisteet ovat termodynaamisesti epästabiileja, hajoavat helposti ja ovat siten syntetisoitavissa vain alhaisissa lämpötiloissa, jos ollenkaan. Tärkein ja stabiilin kryptoniyhdiste on krypton (II) fluoridi , joka on yksi tehokkaimmista tunnetuista hapettimista ja fluorausaineista. Krypton (II) -fluoridia voidaan tuottaa suoraan alkuaineista ja se on lähtötuote useille muille kryptoniyhdisteille.
Vaikka helium- ja neoniyhdisteet ovat edelleen ainoa teoreettinen tutkimus ja laskelmat ovat osoittaneet, että korkeintaan yhden heliumyhdisteen (HHeF), mutta ei yhden neonyhdisteen, pitäisi olla stabiili, ensimmäinen argoniyhdiste on nyt syntetisoitu: fotolyysillä ja fluorivetyä yhdessä 7,5 K jäähdytettiin argonin matriisi, erittäin epävakaa argonfluorihydridi voidaan muodostaa, joka hajoaa sen osien uudelleen, kun kaksi molekyyliä joutumaan tai kuumennettaessa yli 27 K.
Clathrates
Argoni, krypton ja ksenoni muodostavat klatraatteja , inkluusioyhdisteitä, joissa jalokaasu on fyysisesti suljettu ympäröivään kiinteään aineeseen. Tyypillisiä esimerkkejä tästä ovat jalokaasun hydraatit, joissa kaasut ovat suljettuina jäähän . Argonihydraatti muodostuu hitaasti vain −183 ° C: ssa, kryptonin ja ksenonin hydraatit jo −78 ° C: ssa. Jalokaasujen klatraattien tiedetään esiintyvän myös muiden aineiden, kuten hydrokinonin, kanssa .
kirjallisuus
- P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V.Stenke, E.Leicht, H.Stenger: Jalokaasut. Julkaisussa: Ullmann's Encyclopedia of Industrial Chemistry . Wiley-VCH, Weinheim 2006 ( doi : 10.1002 / 14356007.a17_485 ).
- Jalokaasujen pääsy . Julkaisussa: Römpp Online . Georg Thieme Verlag, luettu 19. kesäkuuta 2014.
- AF Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 102. painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , sivut 417-429.
nettilinkit
Yksittäiset todisteet
- ↑ Horst Briehl: Materiaalikemia. 2. painos 2007, Springer, ISBN 978-3-8351-0223-1 , s.14 .
- ^ A b c d William H. Brock: Viewegs kemian historiaa. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5 , sivut 211-216.
- ^ RK Kochhar: Ranskalaiset tähtitieteilijät Intiassa 1600--1900- luvuilla. Julkaisussa: Journal of the British Astronomical Association. 1991, 101, s. 95 - 100 ( artikkeli ).
- ↑ b merkintä heliumia. Julkaisussa: Römpp Online . Georg Thieme Verlag, luettu 19. kesäkuuta 2014.
- ^ Lord Rayleigh: Typen tiheys . Kirjeet toimittajalle. Julkaisussa: Nature . nauha 46 , ei. 1196 , syyskuu 1892, s. 512-513 , doi : 10.1038 / 046512c0 (englanti, https://web.lemoyne.edu/~giunta/rayleigh0.html , https://archive.org/details/scientificpapers04rayliala/page/1 - Tuotantomenetelmä ammoniakista oli Ramsay.): "Typen tiheys […] kahdelle valmistusmenetelmälle saan melko selkeät arvot. Suhteellinen ero [...] voidaan katsoa johtuvan vain kaasun luonteen vaihtelusta. "
- ^ Günther Bugge: Suurten kemistien kirja , Verlag Chemie, Weinheim 1974, ISBN 3-527-25021-2 , s. 255.
- ↑ a radon b- merkintä . Julkaisussa: Römpp Online . Georg Thieme Verlag, luettu 19. kesäkuuta 2014.
- ↑ a b Yu. Ts. Oganessian, VK Utyonkov, Yu. V.Lobanov, F.Sh. Abdullin, AN Polyakov, RN Sagaidak, IV Shirokovsky, Yu. Tsyganov, AA Voinov, GG Gulbekian, SL Bogomolov, BN Gikal, AN Mezentsev, S. Iliev, VG Subbotin, AM Sukhov, K.Subotic, VI Zagrebaev, GK Vostokin, MG Itkis : Elementtien 118 ja 100 isotooppien synteesi 116 249 Cf- ja 245 Cm + 48 Ca -fuusioreaktioissa . Julkaisussa: Phys. Rev. C. 2006, 74, 4, s. 044602-1-044602-1, doi : 10.1103 / PhysRevC.74.044602 .
- ^ A b John F.Lehmann, Hélène PA Mercier, Gary J.Schrobilgen: Kryptonin kemia. Julkaisussa: Coordination Chemistry Reviews . 2002, 233/234, s. 1-39, doi : 10.1016 / S0010-8545 (02) 00202-3 .
- ↑ Neil Bartlett: Ksenoniheksafluoriplatinaatti (V) Xe + [PtF] - . Julkaisussa: Proceedings of the Chemical Society. 1962, s. 218, doi : 10.1039 / PS9620000197 .
- ↑ R. Hoppe: valenssi yhdisteet jalokaasut. Julkaisussa: Angewandte Chemie. 1964, 76, 11, s. 455-463, doi : 10.1002 / anie.19640761103 .
- ^ A b Leonid Khriachtchev, Mika Pettersson, Nino Runeberg, Jan Lundell, Markku Räsänen: Vakaa argonyhdiste . Julkaisussa: Nature. 2000, 406, s. 874-876, doi : 10.1038 / 35022551 .
- ^ AGW Cameron: Aurinkokunnan elementtien runsaus. Julkaisussa: Space Science Reviews , 1970, 15, s. 121-146 ( PDF ).
- ^ A b David R.Williams: Earth Fact Sheet . NASA , Greenbelt, 20. toukokuuta 2009.
- ↑ David R. Lide (Toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, geofysiikka, tähtitiede ja akustiikka, s.14-18.
- B a b c d e f g h i j k l P. Häussinger, R. Glatthaar, W. Rhode, H. Kick, C. Benkmann, J. Weber, H.-J. Wunschel, V.Stenke, E.Leicht, H.Stenger: Jalokaasut. Julkaisussa: Ullmann's Encyclopedia of Industrial Chemistry . Wiley-VCH, Weinheim 2006 ( doi : 10.1002 / 14356007.a17_485 ).
- ↑ Chris J.Ballentine: Geokemia: Maa pitää hengityksen. Julkaisussa: Nature . 2007, 449, s. 294-296, doi : 10.1038 / 449294a .
- ↑ Klaus Hoffmann: Voitko tehdä kultaa? Roistot, jonglöörit ja tutkijat. Kemiallisten alkuaineiden historiasta . Urania-Verlag, Leipzig Jena Berlin 1979, ei ISBN-numeroa, s.67.
- ↑ b c d e A. GM Ferreira, LQ Lobo: On höyrynpaine radon. Julkaisussa: Journal of Chemical Thermodynamics. 2007, 39, 10, s. 1404-1406, doi : 10.1016 / j.jct.2007.03.017
- ↑ K. Schubert: malli kiderakenteet alkuaineet . Julkaisussa: Acta Crystallographica . 1974, 30, s. 193-204, doi : 10.1107 / S0567740874002469 .
- ^ AV Grosse: Elementin 118 (Eka-Em) ja elementin 86 (Em) fysikaaliset ja kemialliset ominaisuudet. Julkaisussa: Journal of Inorganic and Nuclear Chemistry. 1965, 27, 3, s. 509-519, doi : 10.1016 / 0022-1902 (65) 80255-X .
- ↑ Clinton S. Nash: Elementtien 112, 114 ja 118. atomien ja molekyylien ominaisuudet. Julkaisussa: J. Phys. Chem. A. 2005, 109, 15, s. 3493-3500, doi : 10.1021 / jp050736o .
- ^ Wiese, WL: = atomi-, molekyyli- ja optisen fysiikan käsikirja . Toim.: Drake, GWF American Institute of Physics, 1996, ISBN 1-56396-242-X (englanti).
- B a b Errol G.Lewars: Modeling Marvels: Computational Ennakation of Novel Molecules. Springer Verlag, 2008, ISBN 978-1-4020-6972-7 , s. 69-80.
- ^ LC Allen, JE Huheey: Elektronegatiivisuuden määritelmä ja jalokaasujen kemia. Julkaisussa: Journal of Inorganic and Nuclear Chemistry . 1980, 42, s. 1523-1524, doi : 10.1016 / 0022-1902 (80) 80132-1 .
- ↑ Hans-Hermann Braess, Ulrich Seiffert: Viewegin käsikirja autotekniikasta. 5. painos, Vieweg + Teubner Verlag, 2007, ISBN 978-3-8348-0222-4 , s.674-676.
- ^ Walter J. Moore, Dieter O. Hummel: Fysikaalinen kemia. 4. painos, de Gruyter, 1986, ISBN 978-3-11-010979-5 , s.284.
- ^ Alfred A.Bove, Jefferson Carroll Davis: Boven ja Davisin sukelluslääke. 4. painos, Elsevier, 2004, ISBN 978-0-7216-9424-5 , s. 119-121.
- ^ T. Marx, M. Schmidt, U. Schirmer, H. Reinelt: Ksenonanestesia . Julkaisussa: Journal of the Royal Society of Medicine. Osa 93, numero 10, lokakuu 2000, s.513-517, doi : 10.1177 / 014107680009301005 , PMID 11064688 , PMC 1298124 (ilmainen kokoteksti) (arvostelu).
- ↑ Merkintä ksenonliitännöistä. Julkaisussa: Römpp Online . Georg Thieme Verlag, luettu 19. kesäkuuta 2014.
- ↑ Lawrence Stein: Ionic Radon Solutions. Julkaisussa: Science. 1970, 168, s. 362-364, doi : 10.1126 / science.168.3929.362 .
- ↑ Leonid Khriachtchev, Hanna Tanskanen, Arik Cohen, R. Benny Gerber, Jan Lundell, Mika Pettersson, Harri Kiljunen, Markku Räsänen: A Gate to Organokrypton Chemistry: HKrCCH. Julkaisussa: Journal of the American Chemical Society . 2003, 125, 23, s. 6876-6877, doi : 10.1021 / ja0355269 .
- ↑ RM Barrer, DJ Ruzicka: Ei-stoikiometriset klatraattiyhdisteet vedestä. Osa 4. - Klatraattivaiheiden muodostumisen kinetiikka. Julkaisussa: Faraday Society -operaatiot. 1962, 58, s. 2262-2271, doi : 10.1039 / TF9625802262 .
- ↑ David R. Lide (Toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, Elementtien ja epäorgaanisten yhdisteiden ominaisuudet, s.4-4.