litium
| ominaisuudet | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Yleisesti | |||||||||||||||||||
| Nimi , symboli , atominumero | Litium, Li, 3 | ||||||||||||||||||
| Elementtiluokka | Alkalimetallit | ||||||||||||||||||
| Ryhmä , piste , lohko | 1 , 2 , s | ||||||||||||||||||
| Ulkomuoto | hopeanvalkoinen / harmaa | ||||||||||||||||||
| CAS -numero | |||||||||||||||||||
| EY -numero | 231-102-5 | ||||||||||||||||||
| ECHA InfoCard | 100,028,274 | ||||||||||||||||||
| Massiivinen osa maan verhosta | 60 ppm 27. Taajuus | ||||||||||||||||||
| Atomi | |||||||||||||||||||
| Atomimassa | 6,94 (6,938-6,997) ja vastaavat | ||||||||||||||||||
| Atomisäde (laskettu) | 145 (167) pm | ||||||||||||||||||
| Kovalenttinen säde | Klo 128 | ||||||||||||||||||
| Van der Waalsin säde | Klo 182 | ||||||||||||||||||
| Elektronikonfiguraatio | [ Hän ] 2 s 1 | ||||||||||||||||||
| 1. Ionisointienergia | 5.391 714 95 (4) eV ≈ 520.22 kJ / mol | ||||||||||||||||||
| 2. Ionisointienergia | 75.640 096 4 (13) eV ≈ 7 298.16 kJ / mol | ||||||||||||||||||
| 3. Ionisointienergia | 122.454 358 1 (8) eV ≈ 11 815.05 kJ / mol | ||||||||||||||||||
| Fyysisesti | |||||||||||||||||||
| Fyysinen tila | kiinteä | ||||||||||||||||||
| Muutokset | 1 | ||||||||||||||||||
| Kristallirakenne | runkoon keskittynyt kuutio | ||||||||||||||||||
| tiheys | 0,534 g / cm 3 (20 ° C ) | ||||||||||||||||||
| Mohsin kovuus | 0.6 | ||||||||||||||||||
| magnetismi | paramagneettinen ( Χ m = 1,4 10 −5 ) | ||||||||||||||||||
| Sulamispiste | 453,69 K (180,54 ° C) | ||||||||||||||||||
| kiehumispiste | 1603 K (1330 ° C) | ||||||||||||||||||
| Molaarinen tilavuus | 13,02 · 10 −6 m 3 · mol −1 | ||||||||||||||||||
| Haihtumislämpö | 136 kJ / mol | ||||||||||||||||||
| Fuusion lämpö | 3 kJ mol −1 | ||||||||||||||||||
| Äänen nopeus | 6000 m s −1 293,15 K. | ||||||||||||||||||
| Ominaislämpökapasiteetti | 3482 J kg −1 K −1 | ||||||||||||||||||
| Työtoiminto | 2,9 eV | ||||||||||||||||||
| Sähkönjohtavuus | 10,6 · 10 6 A · V −1 · m −1 | ||||||||||||||||||
| Lämmönjohtokyky | 85 W m −1 K −1 | ||||||||||||||||||
| Kemiallisesti | |||||||||||||||||||
| Hapettumistilat | +1 | ||||||||||||||||||
| Normaali potentiaali | −3,04 V | ||||||||||||||||||
| Elektronegatiivisuus | 0,98 ( Paulingin asteikko ) | ||||||||||||||||||
| Isotoopit | |||||||||||||||||||
| |||||||||||||||||||
| Katso muut isotoopit isotooppiluettelosta | |||||||||||||||||||
| NMR -ominaisuudet | |||||||||||||||||||
| |||||||||||||||||||
| turvallisuusohjeet | |||||||||||||||||||
| |||||||||||||||||||
|
SI -yksiköitä käytetään mahdollisuuksien mukaan ja tavanomaisesti . Ellei toisin mainita, annetut tiedot koskevat vakio -olosuhteita . | |||||||||||||||||||
Litium (johdettu antiikin kreikasta λίθος líthos , saksaksi 'kivi' ; ääntäminen [ ˈliːti̯ʊm ] tai myös [ ˈliːʦi̯ʊm ]) on kemiallinen elementti, jossa on symboli Li ja atomiluku 3. Se on osa IUPAC -ryhmää . ja Alkalimetallit , ja alue toisen jakson jaksollisen elementtejä. Litium on kevytmetallia ja on pienin tiheys on kiinteiden elementtien alle vakio-olosuhteissa .
Litiumia ei luonnossa esiinny alkeellisesti sen korkean reaktiivisuuden vuoksi. Ajan huoneen lämpötilassa se on stabiili vain pitkän aikaa täysin kuivaa ilmaa, mutta se reagoi hitaasti muodossa litium nitridi (Li 3 N). Kosteassa ilmassa pinnalle muodostuu nopeasti mattaharmaa litiumhydroksidikerros . Kuten kaikki alkalimetallit, alkuaine- litiumia reagoi joutuessaan iholle kosteutta ja siten johtaa vakavaan kemiallisia palovammoja ja palovammoja . Toisin kuin vastaavat natrium- ja kaliumyhdisteet , monet litiumyhdisteet, jotka muodostavat litiumioneja vesiliuoksessa, on merkitty haitallisiksi.
Kuten hivenaine , litium sen suolojen muodossa on yhteinen osa kivennäisvettä . Pieniä määriä litium ovat läsnä ihmisen organismissa ; elementti ei kuitenkaan ole olennainen eikä sillä ole tunnettua biologista tehtävää. Kuitenkin jotkut litiumsuolat on lääkinnällinen vaikutus, ja niitä käytetään litium terapiassa varten bipolar vaikuttavat häiriöt , mania , masennus ja klusterin päänsärkyä (ks lääketiede ).
tarina
Litiumruotsalaisen keksijä käyttää Johan August Arfwedsonia, että vuonna 1817 vieraan elementin esiintyminen petaliitissa (Li [4] Al [4] [Si 4 O 10 ]) ja pian sen jälkeen spodumeenissa (LiAl [Si 2 O 6 ]) ja lepidoliitti (K (Li, Al) 3 [(AI, Si) 4 O 10 ] (F, OH) 2 ), kun hän analysoitiin mineraali löytöjä saaren Utön on Ruotsi . Hänen akateeminen opettajansa Jöns Jakob Berzelius ehdotti litiumia , johdannaista kreikan kielestä λίθος líthos 'kivi', nimenä, joka kahden muun tuolloin tunnettujen alkalimetallien natriumin ja kaliumin nimien mukaan osoittaa materiaalin, josta se oli uutettu. Latinisoitu muoto litium on voittanut.
Vuonna 1818 saksalainen kemisti Christian Gottlob Gmelin huomasi, että litiumisuolat antavat punaisen liekin . Molemmat tutkijat epäonnistuivat yrittäessään eristää tätä elementtiä seuraavina vuosina. Vuonna 1818, William Thomas Brande ja Sir Humphry Davy onnistuivat ensimmäistä kertaa käyttäen elektrolyyttistä prosessi litiumoksidi (Li 2 O). Vuonna 1855 Robert Bunsen ja Augustus Matthiessen tuottivat suuria määriä puhdasta litiumia elektrolysoimalla litiumkloridia (LiCl). Vuonna 1917 Wilhelm Schlenk syntetisoi ensimmäiset organolitiumyhdisteet orgaanisista elohopeayhdisteistä .
Ensimmäisen kaupallisen tuotannon 1923, Saksan alkoi Metallgesellschaft on Hans-Heinrich Hut in Langelsheim hartsin sulamisvirtausno- litiumin ja kaliumkloridia (KCI) elektrolyysi oli.
Vasta hieman sen jälkeen, kun toisen maailmansodan oli tuskin mitään käyttötarkoitukset litium lukuun ottamatta sen käyttöä voiteluaineena (mineraaliöljy, sakeutetaan litium stearaatti ) ja lasiteollisuudessa ( litiumkarbonaatti tai litiumoksidia ). Tämä muuttui, kun Yhdysvallat tarvitsi litiumista uutettavaa tritiumia vetypommien valmistamiseen . Laaja tuotanto alkoi erityisesti Kings Mountainissa, Pohjois-Carolinassa . Lyhyen tritiumin puoliintumisajan vuoksi tarvittavien suurten litiummäärien vuoksi vuosien 1953 ja 1963 välillä kertyi suuri määrä litiumia, joka tuotiin markkinoille vasta vuodesta 1993 kylmän sodan päättymisen jälkeen . Kaivostoiminnan lisäksi nyt tuli tärkeämmäksi myös halvempi suolavedestä otto . Suurempia määriä litium käytetään nyt paristot , että polymerointi on elastomeerien , rakennusalalla ja orgaanisen synteesin lääkkeitä ja maatalouskemikaaleja. Vuodesta 2007 lähtien ensisijaiset paristot ja akut ( toissijaiset paristot ) ovat olleet tärkein segmentti.
Esiintyminen ja kaivostoiminta
Esiintyminen maan päällä
Litiumin osuus maapallon kuoresta on noin 0,006%. Sitä esiintyy jonkin verran harvemmin kuin sinkkiä ja useammin kuin kobolttia , tinaa ja lyijyä maankuorella. Vaikka litium on esimerkiksi yleisempi kuin lyijy, sen suurempi jakautuminen vaikeuttaa sen saamista. Litiumia löytyy juomavedestä ja joistakin elintarvikkeista, kuten lihasta, kalasta, munista ja maitotuotteista. 100 g lihaa sisältää noin 100 μg litiumia. Eri kasvit, kuten tupakka tai leinikki, imevät litiumyhdisteitä maaperästä ja rikastavat niitä. Kasvien kuiva -aineen keskimääräinen osuus on 0,5 ppm - 3 ppm. Merivesi sisältää keskimäärin 180 µg / l ja jokivesi noin 3 µg / l.
Loppu ja varaukset
Määrällisesti mitattuna 35 000 tonnia litiumia uutettiin Yhdysvaltojen ulkopuolella vuonna 2015 ja myytiin pääasiassa litiumkarbonaattina (Li 2 CO 3 ). Vuonna 2016 Chile oli suurin tuottaja. Australia kolminkertaisti tuotantonsa vuosina 2016-2017 ja kasvatti sitä jälleen lähes 50% vuoteen 2018 mennessä. Tällä hetkellä (2018) lähes kaksi kolmasosaa Australian litiumvarannoista saadaan kovakivikaivoksesta ja vain noin kolmannes suolavedestä. Varaa nykyisessä kaivoksissa arvioidaan noin 17 miljoonaa tonnia (tilanne tammikuussa 2020) aikana. Maailman talletukset mannermaisista suolavesistä, maalämpöliuoksista, hekoriittimineraalista, öljykentän suolavesistä ja magneettisesta pegmatiitista on arvioitu 80 miljoonaan tonniin.
Suurimmat resurssit ovat Boliviassa (21 miljoonaa tonnia), Argentiinassa (17 miljoonaa tonnia), Chilessä (9 miljoonaa tonnia), Yhdysvalloissa (6,8 miljoonaa tonnia), Australiassa (6,3 miljoonaa tonnia) ja Kiinassa (4,5 miljoonaa tonnia). Euroopassa suurimmat talletukset ovat Saksassa (2,5 miljoonaa tonnia) ja Tšekissä (1,3 miljoonaa tonnia).
| Maailmanlaajuinen tuotanto [tonnia] | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 (arvioitu) | Kaivosreservit | Maailman talletukset |
|---|---|---|---|---|---|---|---|---|
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 9 000 000 | 21 000 000 |
|
|
11500 | 10500 | 14 300 | 14 200 | 17 000 | 18 000 | 8 600 000 | 9 000 000 |
|
|
2300 | 2000 | 2300 | 6800 | 7 100 | 7500 | 1 000 000 | 4 500 000 |
|
|
13 300 | 14 100 | 14 000 | 40000 | 58 800 | 42000 | 2 800 000 | 6 300 000 |
|
|
3200 | 3600 | 5800 | 5700 | 6400 | 6400 | 1 700 000 | 17 000 000 |
|
|
300 | 200 | 400 | 800 | 800 | 1200 | 60000 | 250 000 |
|
|
160 | 200 | 200 | 200 | 300 | 300 | 95 000 | 400 000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 630 000 | 6 800 000 |
|
|
900 | 900 | 1000 | 800 | 1600 | 1600 | 230 000 | 540 000 |
|
|
n. v. | n. v. | n. v. | n. v. | 2400 | 200 | 370 000 | 1 700 000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 3 000 000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 1 000 000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 1 000 000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 1 700 000 |
|
|
n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | n. v. | 50000 |
| maailman- | 31 700 | 31 500 | 38000 | 69 000 | 95 000 | 77 000 | 17 000 000 | 80 000 000 |
Ensisijaiset talletukset
Litium esiintyy joissakin mineraalien litium pegmatiitit . Tärkeimmät mineraalit ovat amblygoniitti (LiAl [PO 4 ] F), lepidoliitti (K (Li, Al) 3 [(Al, Si) 4 O 10 ] (F, OH) 2 ), petaliitti (risiini; LiAl [Si 4 O 10 ]) ja spodumeeni (triphane; LiAI [Si 2 O 6 ]). Näiden mineraalien litiumpitoisuus on jopa 9% (amblygoniitille). Muita harvinaisempia litiummalmeja ovat kryoliitti -ioniitti (Li 3 Na 3 [AlF 6 ] 2 ), jolla on kaikista mineraaleista korkein litiumpitoisuus, trifyliini (Li (Fe II , Mn II ) [PO 4 ]) ja tsinnwaldiitti (K ( li, Fe, AI) 3 [(AI, Si) 4 O 10 ] (F, OH) 2 ). Litium Minerals on monen silikaatti - kiviä ennen, mutta yleensä vain pieninä pitoisuuksina. Suuria talletuksia ei ole. Koska litiumin uuttaminen näistä mineraaleista liittyy suureen ponnisteluun, niillä on nykyään ala -arvoinen rooli litium- tai litiumyhdisteiden louhinnassa, mutta tämä voi muuttua odotetun suuren kysynnän vuoksi. Tärkeimmät uutto sivustot ovat Greenbushes ja Mt. Cattlin kaivokset on Länsi-Australiassa , jonka pegmatiitti kiviä on korkea pitoisuus litiumin ja jossa litium on sivutuote tantaali uuttamalla . Myös joissakin muissa maissa, kuten Kanadassa ja Venäjällä , vuoteen 1998 asti myös Bassemer Cityssä , Pohjois -Carolinassa , spodumeenia louhitaan litiumtuotantoa varten.
Euroopassa on Li-rikas pegmatiitin kenttiä Kärntenin Weinebene vuonna Wolfsberg alueella , että Suomen alueella Pohjanmaalla , että Erzgebirge ja Espanjan ( Almendra ) ja Portugalissa ( Guarda piiri , Boticas ).
Vaikka ensimmäinen kaupallinen litiumyhdisteiden tuotanto sinänsä alkoi Harzin vuoristossa jo vuonna 1923, tuotanto Itävallassa ja Suomessa äskettäin kehitetyillä tärkeillä talletuksilla voi alkaa vuodesta 2021. Niitä operoi Global Strategic Metals tai Keliber . Itävallassa on Koralpe vuonna Lavanttal , testi tunnelit ovat osoittaneet paljon suurempi esiintyminen litiumia sisältäviä kallioperän, joka on arvioitu 22000000 tonnia. Tämä tekee siitä yhden Euroopan ensimmäisistä laajamittaisista litiumkaivoshankkeista ja sitä voitaisiin käyttää 20 vuoden ajan. Deutsche Lithium tutkii tapahtumaa Malmin vuoristossa Zinnwaldin lähellä .
Toissijaiset talletukset
Litiumisuoloja, erityisesti litiumkloridia , esiintyy laajalti myös suolavedessä, lähinnä suolajärvissä . Pitoisuus voi olla jopa yksi prosentti. Litiumpitoisuuden lisäksi magnesiumin ja litiumin suhde on tärkeä suolaveden laadun kannalta. Tällä hetkellä litiumia käytetään pääasiassa Chilessä ( Salar de Atacama , jonka litiumpitoisuus on 0,16%), Argentiinassa ( Salar de Hombre Muerto ), Yhdysvalloissa ( Silver Peak , Nevada) ja Kiinan kansantasavallassa ( Chabyêr Caka , Tiibet; Taijinaier -järvi , Qinghai). Bolivian suolajärvi Salar de Uyuni, jossa on arviolta 5,4 miljoonaa tonnia litiumia, on mahdollisesti suurin luonnonvara. Valtionyhtiö Yacimientos de Litio Bolivianos on investoinut saksalaisten ja kiinalaisten kumppaneidensa kanssa teollistamiseensa, mukaan lukien naapurimaat Salar de Coipasa ja Laguna Pastos Grandes , vuodesta 2018 lähtien . On olemassa muita litiumia sisältäviä suolajärviä, joita (huhtikuusta 2019 lähtien) ei vielä käytetä teolliseen kaivostoimintaan, esimerkiksi Kiinassa, Argentiinassa ja Afganistanissa . Vuonna 2016 tuli tunnetuksi, että USA: n Utahin osavaltion Paradox-altaassa esiintyi runsaasti suolaliuosta sisältävää syvää pohjavettä ( suolavettä ) öljyntorjuntakaivoissa jo 1960-luvulla , josta tuolloin tehtyjen analyysien mukaan jopa 1700 mg / L puhdasta litiumia saatiin.
Kaliumkarbonaattia (potaska), booraksia , cesiumin ja rubidiumin saadaan usein kuin sivu- tuotteiden litiumin tuotantoon .
Koska sähköajoneuvojen akkujen litiumkysynnän odotetaan olevan vahvaa, jotkut yritykset tutkivat vuonna 2010 litiumia sisältävien mineraalien ja suolaveden louhintaa eri puolilla maailmaa, myös Euroopassa. Litiumin uuttamista merivedestä tutkitaan myös. Noin 230 miljardia tonnia litiumia liukenee maailman valtameriin. Vuonna 2018 tutkijat esittivät uuttomenetelmän, jossa litiumia voidaan saada merivedestä käyttämällä aurinkokäyttöistä elektrolyysiä . He mainitsivat edun tavanomaiseen louhintaan verrattuna, että metallinen litium saadaan suoraan prosessissa ja siksi (monimutkainen ja energiaintensiivinen) jatkokäsittelystä voidaan luopua, kuten on tarpeen perinteisessä litiumlouhinnassa malmeista.
Tällä Leibniz Institute for New Materials , kaksivuotisen MERLIN tutkimusprojekti ( kaivos- vesi litium louhinta ) aloitettiin marraskuussa 2020 , jonka kanssa poistamaan litiumia peräisin kaivosveden halutaan testata.
Esiintyminen maan ulkopuolella
Jälkeen Big Bang , lisäksi vetyä ja heliumia isotooppeja, merkittävä määrä 7 Li isotooppi oli muodostunut. Suurin osa tästä ei ole enää saatavilla tänään, koska tähdissä litium sulatettiin vedyn kanssa protoni-protoni-reaktion II prosessissa ja kului siten. In ruskeita kääpiöitä , kuitenkin, massan ja lämpötila ei ole tarpeeksi korkea vedyn fuusio; niiden massa ei saavuta tarvittavaa noin 75 Jupiter -massan kokoa . Siksi alkuräjähdyksen aikana tuotettua litiumia säilytettiin vain suurempina määrinä ruskeissa kääpiöissä. Tästä syystä litium on myös suhteellisen harvinainen elementti maan ulkopuolelta , mutta sitä voidaan käyttää ruskeiden kääpiöiden havaitsemiseen.
Litiumin jakautuminen eri tähtiin on hyvin erilainen, vaikka ikä, massa ja metallisuus olisivat samanlaisia. Uskotaan, että planeetat vaikuttavat tähden litiumpitoisuuteen. Jos tähdellä ei ole planeettoja, litiumpitoisuus on korkea, kun taas planeettojen ympäröimillä tähdillä, kuten auringolla, on vain pieni litiumpitoisuus, joka tunnetaan myös nimellä litiumkuoppa . Syynä uskotaan olevan se, että planeettojen vuorovesivoimat myötävaikuttavat tähtien ulko- ja sisäkerrosten voimakkaampaan sekoittumiseen niin, että enemmän litiumia pääsee alueelle, joka on tarpeeksi kuuma sulattamaan sen.
Tuotantoprosessi
Litium saadaan pääasiassa suolavedestä (pohjavesi, suolajärvet) haihduttamalla. Uuttaminen kivistä avolouhoksessa on harvinaista .
Suolaisesta vedestä
Litiumin uuttamiseksi suolainen pohjavesi pumpataan pintaan ja johdetaan haihtumisaltaiden ketjun läpi, jossa haihtuminen auringossa tapahtuu useiden kuukausien ajan. Kun litiumkloridi on saavuttanut vaaditun pitoisuuden lammissa, liuos pumpataan käsittelylaitokseen, jossa ei -toivottu boori tai magnesium uutetaan ja suodatetaan pois. Sitten se käsitellään natriumkarbonaatilla . Saostunut litiumkarbonaatti suodatetaan ja kuivataan. Ylimääräinen suolavesi pumpataan takaisin suolajärveen. Kuivilla alueilla, kuten Chilessä, pohjaveden käyttö edistää maiseman kuivumista.
kuvaus
Litiumkarbonaatti saostetaan litiumia sisältävistä suolaliuoksista haihduttamalla vesi ja lisäämällä natriumkarbonaattia (sooda) . Tätä varten suolaliuos väkevöidään ensin ilmaan, kunnes litiumpitoisuus ylittää 0,5%. Heikosti liukoinen litiumkarbonaatti saostetaan lisäämällä natriumkarbonaattia:
- .
Metallisen litiumin saamiseksi litiumkarbonaatti saatetaan ensin reagoimaan suolahapon kanssa. Tämä muodostaa hiilidioksidia , joka poistuu kaasuna, ja liuennutta litiumkloridia . Tämä liuos väkevöidään tyhjiöhaihduttimessa, kunnes kloridi kiteytyy:
Litiumkloridin uuttamiseen käytettävät laitteet ja järjestelmät on valmistettava erikoisteräksistä tai nikkeliseoksista , koska suolavesi on erittäin syövyttävää . Metallinen litium on sulatettu suolaelektrolyysi 450-500 ° C: ssa sulavasta eutektisesta seoksesta , jossa oli 52 massaprosenttia litiumkloridia ja 48 painoprosenttia kaliumkloridia :
Kalium ei kerry elektrolyysin aikana, koska sillä on pienempi elektrodipotentiaali kloridisulalla . Kuitenkin myös natriumjälkiä kertyy ja ne tekevät litiumista erityisen reaktiivisen (edullista orgaanisessa kemiassa, huono Li -akuille). Nestemäinen litium kerääntyy elektrolyytin pinnalle ja voidaan siten poistaa suhteellisen helposti elektrolyysikennosta. Litiumia on myös mahdollista saada elektrolysoimalla litiumkloridi pyridiiniin . Tämä menetelmä soveltuu erityisesti laboratoriomittakaavassa.
Taloudellinen merkitys ja raaka -ainekauppa
Sen jälkeen uuttamalla, litium saavuttaa käsittelyä teollisuuden raaka-aineena kautta kaupan . In Hyödykekaupassa , erityisesti markkinoilla ja metallien , ole puhdas litium käydään kauppaa, se olisi kemiallisesti epävakaita. Sen sijaan vaihdetaan stabiileja litiumyhdisteitä, ts. d. Yleensä litiumsuolojen tai litiumpohjaisten kristallikasojen, pääasiassa litiumkarbonaatin tai litiumhydroksidimonohydraatin kanssa . Näitä aineita ovat mm. vaihdettiin Lontoon metallipörssissä . Vuonna 2020 litiumkarbonaatille (vähimmäispitoisuus 99,5%) kirjattiin 8,75 USD / kg ja litiumhydroksidimonohydraatille 10,25 USD / kg (vähimmäispitoisuus 56,5%).
Lisäksi lainaan litiumin raaka-aineena, litium indeksirahastoihin (ETF) ovat olemassa vuodesta 2010 , joka voidaan käydä kauppaa pörssissä. Nämä ETF: t kartoittavat litium -arvoketjuun osallistuvien yritysten markkina -arvon. Vuodesta 2010 on varastossa Performance Index of Solactive , joka seuraa markkina-arvo suurimpien pörssiyhtiöiden mukana malminetsintää ja kaivostoimintaa litiumin ja tuotannon litium-akut. Tämän indeksin kymmenen suurinta arvoa ovat (laskevassa kokojärjestyksessä huhtikuun 2020 jälkeen): Albemarle , SQM , Tesla , BYD , Samsung , Simplo Technology , LG Chem , Panasonic , GS Yuasa ja Enersys . Muutamat litium -ETF: t seuraavat enimmäkseen tätä indeksiä.
ominaisuudet
Fyysiset ominaisuudet
Litium on hopeanvalkoinen, pehmeä kevytmetalli . Se on kevyin kiinteistä aineista huoneenlämmössä ( tiheys 0,534 g / cm³). Vain kiinteä vety −260 ° C: ssa on vielä kevyempää ja tiheys 0,0763 g / cm³.
Kuten muutkin alkalimetallit, litium kiteytyy kehon keskipisteessä olevissa pallomaisissa pakkauksissa avaruusryhmässä Im 3 m (avaruusryhmä nro 229) , hilaparametri a = 351 pm ja kaksi kaavayksikköä solua kohti . Alhaisissa lämpötiloissa 78 K, kiderakenne muuttuu kautta spontaani muuttumista kuusikulmainen rakenne magnesiumin tyyppiä hilan parametrit a = 311 pm ja c = 509 pm tai muodonmuutoksen jälkeen osaksi kuutio rakenne kupari tyyppi (kuutio kasvo- keskellä) hilaparametrilla a = 438 pm at. Rakenteen muodostumisen tarkat syyt ovat tuntemattomia.
Alkalimetalleista litiumilla on korkein sulamis- ja kiehumispiste sekä suurin ominaislämpökapasiteetti . Litiumilla on kaikista alkalimetalleista suurin kovuus , mutta kun Mohsin kovuus on 0,6, sitä voidaan silti leikata veitsellä. Tyypillisenä metallina se on hyvä sähkön (johtavuus: noin 18% kuparia) ja lämmönjohdin.
Litium on suurelta osin samanlainen kuin magnesium , mikä heijastuu myös litiumin ja magnesiumin heterotyyppisten seoskiteiden , ns. Isodimorfismin, esiintymiseen . Vaikka magnesium kiteytyy lähimpään kuusikulmaiseen pakkaukseen, kun taas litium kiteytyy kehon keskipisteeseen, molemmat metallit sekoittuvat suurelta osin heterotyyppisesti . Tämä tapahtuu kuitenkin vain rajoitetulla pitoisuusalueella, ja ylimääräinen läsnä oleva komponentti "pakottaa" kidehilaansa muille.
Litium -ioni on korkein entalpia hydrataation kaikki alkalimetalli-ioneja -520 kJ / mol . Tämän seurauksena se on täysin hydratoitu vedessä ja houkuttelee voimakkaasti vesimolekyylejä. Litium muodostaa kaksi hydraattia, sisäpuolen, jossa on neljä vesimolekyyliä, jotka ovat erittäin vahvasti sitoutuneet happiatomiensa kautta litiumioniin, ja ulkokuoren, yllä olevissa vetysidoksissa enemmän vesimolekyylejä Li [H 2 O] 4 +: n kanssa ionit on kytketty. Tämän seurauksena hydratoidun ionin säde on erittäin suuri, jopa suurempi kuin raskaiden alkalimetallien rubidium ja cesium , joilla ei ole niin voimakkaasti sitoutuneita nesteytyskuoria vesiliuoksessa.
Koska kaasu , litium esiintyy ei ainoastaan yksittäisiä atomeja, mutta myös molekyyli- muodossa Dilithium Li 2 . Yksisidos litium saavuttaa täyden atomin kiertoradan ja siten energisesti suotuisan tilanteen. Dilitiumin sidoksen pituus on 267,3 pm ja sidoksen energia 101 kJ / mol. Kaasumaisessa tilassa noin 1% (massa) litiumia on läsnä dilitiumina.
Kemiallisia ominaisuuksia
Kuten kaikki alkalimetallit, litium on erittäin reaktiivinen ja reagoi helposti useiden alkuaineiden ja yhdisteiden (kuten veden ) kanssa ja luovuttaa lämpöä . Se on kuitenkin vähiten reaktiivinen alkalimetalleista. Erityinen ominaisuus, joka erotetaan litium muista alkalimetalleista on sen reaktio molekulaarisen typen , jolloin muodostuu litium nitridin , joka tapahtuu hitaasti jopa huoneenlämpötilassa:
- .
Tämä on mahdollista, että suuri varaustiheys Li + ioni ja siten korkean hilan energia litium nitridi. −3,04 V: n litiumilla on jaksollisen taulukon pienin normaalipotentiaali , ja siksi se on kaikista aineista vähiten jalo.
Kuten kaikki alkalimetallit, litium varastoidaan maaöljyn tai parafiiniöljyn alla , muuten se reagoi ilman sisältämän hapen ja typen kanssa.
Koska Li + - ja Mg 2+ -ionien ionisäteet ovat verrattain suuria, on myös yhtäläisyyksiä litium- tai litiumyhdisteiden ja magnesium- tai magnesiumyhdisteiden ominaisuuksissa. Tätä samankaltaisuutta kahden jaksollisen taulukon naapuriryhmien elementtien ominaisuuksissa tunnetaan jaksollisen taulukon vinona suhteena . Toisin kuin natrium, litium muodostaa monia organometalliyhdisteitä ( organolitiumyhdisteitä ), kuten butyylilitiumia tai metyylilitiumia . Samanlaisia suhteita on berylliumin ja alumiinin sekä boorin ja piin välillä .
Isotoopit
Kaksi pysyvää isotooppia 6 Li (7,6%) ja 7 Li (92,4%) esiintyvät luonnossa . Lisäksi tunnetaan epävakaita isotooppeja alkaen 4 Li - 8 Li - 12 Li, joita voidaan valmistaa vain keinotekoisesti. Niiden puoliintumisajat ovat kaikki millisekunnin alueella .
6 Li: llä on tärkeä rooli ydinfuusiotekniikassa. Se toimii sekä ydinfuusioreaktorissa että vetypommissa lähtöaineena tritiumin tuotannossa , jota tarvitaan energiaa tuottavassa fuusiossa deuteriumin kanssa . Fuusioreaktorin huopaan tai heliumin vieressä olevaan vetypommiin syntyy tritiumia pommittamalla 6 litraa neutroneilla, jotka syntyvät fuusion aikana ydinreaktion jälkeen
- .
Reaktio, joka on myös mahdollinen
on vähemmän sopiva (katso viltti ) . Erottaminen voi tapahtua, esimerkiksi, kautta isotooppi vaihto litiumin amalgaamin ja liuennutta litium-yhdiste (esimerkiksi litiumkloridin etanolissa) (niin kutsuttu Colex prosessi ). Saanto on noin 50%.
Jos on kolmivaiheisessa pommi on myös 7 Li lisäksi 6 Li (kuten tapauksessa, esimerkiksi, jossa Castle Bravo ), tämä reagoi joitakin nopeita neutroneja aikana syntyneen fuusio. Tämä luo jälleen neutroneja sekä heliumia ja lisää tritiumia. Vaikka 7 Li-neutronireaktio kuluttaa aluksi energiaa, lopputuloksena on lisääntynyt energian vapautuminen lisäfuusioiden ja enemmän ydinfissioa uraanipommin kuoressa . Räjähdysteho on siis suurempi kuin jos vain 6 litran osa isotooppiseosta olisi muutettu pommissa. Koska ennen Castle Bravo -testiä oletettiin, että 7 Li ei reagoi neutronien kanssa, pommi oli noin 2,5 kertaa tehokkaampi kuin odotettiin.
Litium isotooppi 7 Li tuotetaan pieniä määriä ydinvoimaloiden läpi ydin- reaktion borisotope 10 B (käytetään neutroniabsorboija) neutronien.
Isotooppeja 6 Li, 7 Li käytetään molemmissa kokeissa kylmillä kvanttikaasuilla . Näin syntyi ensimmäinen Bose-Einstein-kondensaatti ( bosoni ) isotoopilla 7 Li. 6 Li on sen sijaan fermioni , ja vuonna 2003 oli mahdollista muuttaa tämän isotoopin molekyylit superfluidiksi .
käyttää
Tärkein ja nopeimmin kasvava litiumin sovellus nykyään on sen käyttö litiumioniakkuissa (usein kutsutaan myös ladattaviksi paristoiksi ). B. älypuhelimet , kannettavat tietokoneet , sähkölaitteissa tai sähkökäyttöisiä ajoneuvoja, kuten hybridiautojen , sähköautojen tai E-pyörät (katso kuva oikealla). Suurin osa tuotetuista litiumisuoloista ei pelkisty metalliksi, vaan niitä käytetään joko suoraan litiumkarbonaattina, litiumhydroksidina, litiumkloridina, litiumbromidina tai muutetaan muiksi yhdisteiksi. Metallia tarvitaan vain joissakin sovelluksissa. Litiumyhdisteiden tärkeimmät käyttötavat löytyvät osiosta " Liitännät ".
metalli-
Osa tuotetusta litiummetallista käytetään sellaisten litiumyhdisteiden uuttamiseen, joita ei voida valmistaa suoraan litiumkarbonaatista. Nämä ovat pääasiassa orgaanisia litiumyhdisteitä, kuten butyylilitium , litium-vetyyhdisteet, kuten litiumhydridi (LiH) tai litiumalumiinihydridi ja litiumamidi .
Litiumia käytetään typen poistamiseen kaasuista, koska se kykenee reagoimaan suoraan typen kanssa .
Metallinen litium on erittäin tehokas pelkistin ; se vähentää monia aineita, jotka eivät reagoi muiden pelkistävien aineiden kanssa. Sitä käytetään aromaattisten aineiden osittaiseen hydraukseen ( koivun pelkistys ). In metallurgia sitä käytetään rikin poistamiseksi , hapenpoiston ja hiilenpoistoa metalli sulaa.
Koska litium on hyvin alhainen normaali mahdollisia , sitä voidaan käyttää kuin anodi on akkuja . Näillä litiumparistoilla on suuri energiatiheys ja ne voivat tuottaa erityisen korkean jännitteen . Ei-ladattava litium-akkuja ei pidä sekoittaa litium-ioni-akkujen, jossa litium metallioksidit, kuten litiumkobolttioksidi on kytketty , kun katodi ja grafiitti tai muita yhdisteitä, jotka tallentaa litium-ioneja anodina.
Ydinfuusio
Ydinfuusioreaktorien toimintaan tarvittava tritium on tuotettava litium-6-reaktorin peitossa .
Metalliseoskomponentti
Litium seostetaan joidenkin metallien kanssa niiden ominaisuuksien parantamiseksi. Pienet määrät litiumia riittävät usein tähän. Lisäaineena se parantaa monien materiaalien vetolujuutta , kovuutta ja elastisuutta . Esimerkki litiumseoksesta on kiskometalli , lyijyseos, jossa on noin 0,04% litiumia ja jota käytetään rautateiden kantavana materiaalina . Mekaaniset ominaisuudet magnesium-litiumin seokset ja alumiini-litium-seokset ovat myös parantaa lisäämällä litium. Samalla litiumlejeeringit ovat erittäin kevyitä ja siksi niitä käytetään paljon ilma- ja avaruusteknologiassa .
Tutkimus (atomifysiikka)
In atomifysiikan , litium käytetään usein, koska kanssa 6 Li se on vain alkalimetalli vakaa fermionic isotooppi , minkä vuoksi se on sopiva tutkimiseen vaikutuksia ultra-kylmä fermionic kvantti kaasuja (ks BCS-teoria ). Samaan aikaan sillä on erittäin laaja Feshbach -resonanssi , mikä mahdollistaa atomien välisen sirontapituuden säätämisen halutulla tavalla, jolloin magneettikenttien ei tarvitse olla erityisen tarkkoja resonanssin leveyden vuoksi .
lääke
Litiumia käytettiin ensimmäisen kerran länsimaisessa lääketieteessä kihdin lääkkeenä jo vuonna 1859 . Se osoittautui kuitenkin tehottomaksi. Vasta vuonna 1949 australialainen psykiatri John Cade (1912–1980) kuvaili litiumisuolojen mahdollista soveltamisalaa. Hän oli ruiskuttanut marsuja erilaisiin kemiallisiin yhdisteisiin, mukaan lukien litiosuolat, minkä jälkeen ne reagoivat vähemmän voimakkaasti ulkoisiin ärsykkeisiin ja tulivat rauhallisemmiksi, mutta eivät uniseksi. Jälkikäteen osoittautui, että koe -eläimillä havaittu vaikutus johtui myrkytyksestä. Caden itsekokeilun jälkeen litiumkarbonaatin käyttöä lääkkeenä maanis-masennuksen hoitoon tutkittiin kaksoissokkotutkimuksessa Risskovin (Tanska) psykiatrisessa sairaalassa vuosina 1952–1954 . Tämä loi perustan litiumhoidolle .
Tässä suolojen muodossa olevaa litiumia , kuten litiumkarbonaattia , käytetään kaksisuuntaisia mielialahäiriöitä , maniaa ja masennusta vastaan, mutta myös psykiatrian ulkopuolella klusteripäänsärkyjen tai herpes simplex -infektioiden hoidossa . Alhainen terapeuttinen alue on huomattava, että se on välillä 0,6 mmol / l ja 0,8 mmol / l, ja peilivaatimukset ovat tarpeen hoidon aikana. Jopa silloin, kun veren litiumpitoisuus on terapeuttisen alueen ylärajalla, hallittavia, palautuvia sivuvaikutuksia voi esiintyä herkillä ihmisillä. Jos veren litiumpitoisuus on kuitenkin selvästi terapeuttisen alueen yläpuolella - eli yli 2,0 mmol / l -, merkittävien tai vakavien sivuvaikutusten, kuten vapina , kurinalaisuus , pahoinvointi, oksentelu, sydämen rytmihäiriöt ja leukosytoosi, riski kasvaa nopeasti. Yli 3,5 mmol / l on hengenvaara. Syynä on se, että litiumin ja natriumin aineenvaihdunta on samanlainen. Liiallinen litiumpitoisuus voi johtua hikoilusta tai natriumhuuhtelulääkkeistä (natriureettisista diureeteista ), joiden natriumpitoisuus laskee. Keho yrittää kompensoida natriumin menetyksestä poistamalla natriumin ensisijainen virtsan munuaisissa ja sen kuljettamista takaisin vereen (natrium säilyttäminen ). Natriumin lisäksi säilyy myös litiumia, joka tavallisesti erittyy tasaisesti munuaisten kautta. Tuloksena on kohonnut litiumpitoisuus, joka vaatii lääkkeen seurantaa litiumia otettaessa , jolloin litiumpitoisuus määritetään säännöllisesti ja annosta säädetään sen mukaisesti. Jopa oikealla annoksella pitkäaikainen litiumhoito voi johtaa veden ja natriumin häviämiseen ( diabetes insipidus ), veren liialliseen happamoitumiseen ( asidoosi ) ja litiumnefropatiaan, johon liittyy munuaisten vajaatoiminta .
Yhdysvalloissa vuonna 1990 julkaistu tutkimus kuvaa rikollisuuden ja itsemurhien merkittävää vähenemistä alueilla, joilla on kohonnut litiumpitoisuus juomavedessä . Itävaltalaisessa tutkimuksessa tuli samanlaisia tuloksia.
Litiumin vaikutustapaa psykotrooppisena lääkkeenä ei ole vielä tutkittu riittävästi. Mahdollisista mekanismeista keskustellaan parhaillaan erityisesti inositolin metaboliaan vaikuttamisesta estämällä myo-inositoli-1- fosfataasia ( entsyymiluokka 3.1.3.25) ja estämällä glykogeenisyntaasikinaasi-3 (GSK-3) hermosoluissa . Antidepressiivinen vaikutus litiumin todennäköisesti myös perustuu kasvuun serotonergistä neurotransmissiota, ts lisääntynyt vapautuminen serotoniinin on synapseissa , kun manianvas- vaikutus selittyy mukaan eston dopaminergisten reseptorien. Toinen mielenkiintoinen litiumisuolojen vaikutus ihmisiin ja nisäkkäisiin, kuten rottiin, on todennäköisesti liittyvä vuorokausirytmin muutos . Tämä vaikutus on osoitettu jopa kasveissa, kuten Kalanchoe . Muut serotonergiset aineet, kuten LSD , meskaliini ja psilosybiini, osoittavat myös tällaisia vaikutuksia ihmisiin. Litiumia käyttämällä hedelmäkärpäsillä ( Drosophila melanogaster ) tehdyt eläinkokeet ovat onnistuneet torjumaan Alzheimerin taudin oireita - kuten unohtamista. Alueilla, joilla on korkeampi litiumpitoisuus, dementia näyttää olevan vähemmän yleistä. Hermosoluja suojaava vaikutus johtuu mahdollisesti litium-parannettu autophagy .
Vuotiaana tutkija Michael Ristow osoitti vuonna 2011 mahdollisesta yhteydestä sisällön litiumin ympäristössä ja elinajanodote ihmisten: on japanilainen väestötutkimuksessa oli tilastollisesti merkitsevä yhteys korkeampia pitoisuuksia litiumin ja korkeampi elinajanodote; Lisäksi korkeat litiumpitoisuudet pidensivät sukkulamaton ja malliorganismin Caenorhabditis elegansin elinajanodotetta . Lukuisten ihmisten terveyteen kohdistuvien vaikutusten vuoksi keskustellaan siitä, voisiko litium olla hivenaine .
todiste
Litiumyhdisteet osoittavat karmiininpunaista liekin väriä , tunnusomaiset spektriviivat ovat pääviivat 670.776 ja 670.791 nm: ssä; pienemmät linjat ovat aallonpituudella 610,3 nm. Lisäksi litium voidaan havaita liekkifotometrian avulla .
Kvantitatiivinen havaitseminen märillä kemiallisilla menetelmillä on vaikeaa, koska useimmat litiumsuolat liukenevat helposti. Yksi mahdollisuus on heikosti liukoisen litiumfosfaatin saostaminen . Tätä tarkoitusta varten, näytteen tutkittavan tehdään emäksiseksi kanssa natriumhydroksidiliuoksella, esimerkiksi , ja hieman dinatriumvetyfosfaattia Na 2 HPO 4 on lisätty. Kuumennettaessa muodostuu valkoinen sakka Li + : n läsnä ollessa :
Toinen mahdollisuus on käyttää rautaperjodaattireagenssia .
Vaaravaroitukset
Metallipölyn muodossa oleva alkuaine litium syttyy ilmassa jopa normaalissa lämpötilassa. Tästä syystä metallista litiumia on myös säilytettävä ilman poissa, yleensä öljyssä . Yli 190 ° C: n lämpötiloissa muodostuu pääasiassa litiumoksidia välittömästi kosketuksessa ilman kanssa. Puhtaassa hapessa litium syttyy noin 100 ° C: sta. Puhtaassa typpiatmosfäärissä litium reagoi vain nopeammin litiumnitridiin korkeammissa lämpötiloissa. Litium voi reagoida räjähdysmäisesti joutuessaan kosketuksiin happia tai halogeenia sisältävien aineiden kanssa.
Koska litium reagoi voimakkaasti eksotermisesti tavallisten sammutusaineiden, kuten veden , hiilidioksidin , typen tai nyt kielletyn hiilitetrakloridin kanssa , se syttyy inertteillä kaasuilla, kuten z. B. argon tai muut metalliset sammutusaineet, kuten suola (z. B. NaCl), voidaan sammuttaa.
Alkuaine -litium, kuten kaikki alkalimetallit , aiheuttaa vaurioita palovammojen tai emäksisten kemiallisten palovammojen kautta ihokosketuksessa, koska se muodostaa litiumhydroksidin veden kanssa ja lähettää voimakasta lämpöä; ihon kosteus riittää tähän.
linkkejä
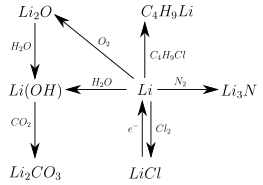
Litium on erittäin reaktiivinen ja muodostaa yhdisteitä useimpien ei-metallien kanssa, joissa se on aina + I- hapetustilassa . Näillä on pääsääntöisesti ioninen rakenne, mutta toisin kuin muiden alkalimetallien yhdisteillä, niillä on korkea kovalenttinen pitoisuus. Tämä näkyy muun muassa siinä, että monet litium- suolat - toisin kuin vastaavat natrium- tai kaliumsuolat - liukenevat helposti orgaanisiin liuottimiin, kuten asetoniin tai etanoliin . Myös kovalenttisia orgaanisia litiumyhdisteitä on olemassa. Monet litiumyhdisteet ovat ominaisuuksiltaan samanlaisia kuin vastaavat magnesiumyhdisteet samanlaisten ionisäteiden vuoksi ( viisto suhde jaksollisessa taulukossa ). Seuraava kuva antaa yleiskatsauksen litiumin tärkeimmistä reaktioista. Stökiometriaa ja tarkkoja reaktio -olosuhteita ei oteta tässä huomioon:
Vetyyhdisteet
Vety muodostaa hydridejä litiumin kanssa . Yksinkertaisin litium- vetyyhdiste litiumhydridi LiH syntyy elementeistä 600-700 ° C: ssa. Sitä käytetään rakettien polttoaineena ja valmistaa nopeasti vety, esimerkiksi paisuttaa elämän liivit . On myös monimutkaisempia hydridejä, kuten litiumboorihydridi LiBH 4 tai litiumalumiinihydridi LiAlH 4 . Viimeksi mainittu on erittäin tärkeää orgaanisen kemian selektiivisenä vedyn luovuttajana, esimerkiksi varten vähentämistä ja karbonyyli- ja nitro yhdisteitä .
Litiumdeuteridillä (LiD) ja litiumtritidillä (LiT) on tärkeä rooli ydinfuusion tutkimuksessa . Koska puhdas litiumdeuteridi vähentää vetypommin energiaa, käytetään tähän LiD: n ja LiT: n seosta. Näitä kiinteitä aineita on helpompi käsitellä kuin tritiumia nopealla effuusionopeudellaan .
Happiyhdisteet
Hapen kanssa litium muodostaa sekä litiumoksidia Li 2 O että litiumperoksidia Li 2 O 2 .
Kun litium reagoi veden kanssa, muodostuu litiumhydroksidi , vahva emäs. Litiumhydroksidista valmistetaan litiumrasvoja, joita käytetään autojen voitelurasvoina. Koska litiumhydroksidi sitoo myös hiilidioksidia, sitä käytetään uudistamaan ilmaa sukellusveneissä.
Lisää litiumyhdisteitä
Litium muodostaa halogeenien kanssa LiX -muodon suoloja. Näitä ovat litiumfluoridi , litiumkloridi , litiumbromidi ja litiumjodidi . Koska litiumkloridi on erittäin hygroskooppinen, sitä käytetään myös kuivausaineena sen lisäksi, että sitä käytetään lähtöaineena litiumin valmistuksessa. Sitä käytetään kaasujen, esimerkiksi maakaasun , kuivaamiseen ennen putkiston kautta syöttämistä tai ilmastointijärjestelmissä kosteuden vähentämiseen (enintään 2% suhteellinen kosteus). Litiumkloridia käytetään myös sulamislämpötilojen alentamiseen hitsaus- ja juotoshauteissa sekä hitsauselektrodin vaipana alumiinin hitsaamiseen. Litiumfluoridia käytetään yksikiteenä infrapunaspektroskopiassa .
Teknisesti tärkein litiumyhdiste on heikosti liukoinen litiumkarbonaatti . Sitä käytetään erottamaan useimmat muut litiumyhdisteitä ja sitä käytetään niin vuon on lasiteollisuudessa ja valmistuksessa emali . Sitä käytetään myös alumiinin valmistuksessa sulan johtavuuden ja viskositeetin parantamiseen.
Litium saippuat ovat litiumsuolat rasvahappojen . Niitä käytetään pääasiassa sakeutusaineena laadukkaan mineraali öljy perustuu voitelurasvoja ja vahat ja tuotantoon kyniä .
Muita litiosuoloja ovat:
- Litiumperkloraatti LiClO 4 ,
- Litiumsulfaatin Li 2 SO 4 ,
- Litiumnitraattia LiNO 3 , käytetään kaliumnitraatin kanssa kumiteollisuudessa vulkanointiin ,
- Litiumnitridi Li 3 N muodostuu, kun litium reagoi typen kanssa,
- Litiumniobaatti LiNbO 3 on läpinäkyvä monilla aallonpituuksilla ja sitä käytetään optiikassa ja lasereissa ,
- Litiumamidi LiNH 2 on vahva emäs ja muodostuu, kun litium reagoi nestemäisen ammoniakin kanssa .
- Litium stearaatti C 18 H 35 LiO 2 , on tärkeä lisäaine öljyihin, jotta käyttää niitä voitelurasvoja. Niitä käytetään autoissa, jyrämyllyissä ja maatalouskoneissa. Litiumstearaatit liukenevat veteen erittäin heikosti, joten voitelukalvo säilyy, kun ne joutuvat kosketuksiin vähäisen veden kanssa. Saaduilla voitelurasvoilla on erinomainen lämmönkestävyys (> 150 ° C) ja ne pysyvät voiteluvina -20 ° C asti.
- Litiumasetaattia C 2 H 3 LiO 2
- Litiumsitraatti C 6 H 5 Li 3 O 7
- Litiumheksafluorifosfaattia LiPF 6 käytetään johtavana suolana litiumioniakkuissa.
- Litiumfosfaattia Li 3 PO 4 käytetään katalyyttinä propyleenioksidin isomeroinnissa.
- Litiummetaboraatti LiBO 2 ja litiumtetraboraatti Li 2 B 4 O 7
- Litiumbromidi LiBr on reagenssi lääkkeiden valmistukseen, mutta sitä käytetään myös absorptiojäähdytysjärjestelmissä .
Orgaaniset litiumyhdisteet
Toisin kuin useimmat muut alkalimetalliorganylit, litiumorganyylit ovat merkittävässä asemassa erityisesti orgaanisessa kemiassa. Erityisen tärkeitä ovat n- butyylilitiumia , tert- butyylilitiumia , metyylilitium ja fenyylilitium , jotka ovat myös kaupallisesti saatavilla muodossa niiden ratkaisujen pentaani, heksaani, sykloheksaani tai, jos tarkoituksenmukaista, dietyylieetterillä. Metallilitiumin suora reaktio alkyyli- / aryylihalogenidien kanssa voidaan suorittaa kohdan mukaisesti
tai transmetalaatiolla, esimerkiksi organyylielohopeasta kohdan mukaisesti
tuottaa.
Kun tetrahydrofuraanissa (THF) on alkuaine litiumia magnesiumin sijasta dietyylieetterissä, Grignard- analogiset alkyylihalogenidien additioreaktiot karbonyyliyhdisteisiin voidaan yleensä suorittaa paremmalla saannolla.
Selvästi kovalenttisen luonteensa vuoksi organyylilitiumin rakennetta voidaan vain harvoin kuvata yksinkertaisella Li -C -sidoksella. On lähinnä monimutkaisia rakenteita, jotka on rakennettu dimeerisistä, tetrameerisistä tai heksameerisistä yksiköistä tai polymeerirakenteista. Litiumorganyelit ovat erittäin reaktiivisia yhdisteitä, joista osa syttyy spontaanisti ilmassa. Ne reagoivat räjähdysmäisesti veden kanssa. Äärimmäisen emäksisyytensä vuoksi ne reagoivat myös liuottimien kanssa, joiden sitoutunut vety on tuskin hapan, kuten THF , mikä rajoittaa vakavasti sopivien liuottimien valintaa. Reaktiot niiden kanssa ovat mahdollisia vain suojakaasun alla ja kuivatuissa liuottimissa. Siksi niiden käsittelyssä tarvitaan jonkin verran kokemusta ja suositellaan suurta varovaisuutta.
Toinen ryhmä orgaanisen litiumin johdannaiset ovat litium amidit LinR 2 tyyppiä , joista litiumdi-isopropyyliamidi (LDA) ja litiumbis (trimetyylisilyyli) amidia ( LiHMDS , katso myös HMDS ) käytetään vahvoja emäksiä ilman nukleofiilinen aktiivisuus.
Litiumorganyleja käytetään monin tavoin, esimerkiksi olefiinien anionisen polymeroinnin initiaattoreina , metalaatio- , deprotonointi- tai alkylointiaineina .
Niin kutsutut R 2 CuLi- tyyppiset Gilman- kuprat ovat erityisen tärkeitä .
kirjallisuus
- AF Holleman , E.Wiberg , N.Wiberg : Epäorgaanisen kemian oppikirja . 102 painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s. 1259-1270.
- NN Greenwood, A.Earnshaw: Elementtien kemia. 1. painos. VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9 , s. 83-129.
- M. Binnewies: Yleinen ja epäorgaaninen kemia. Spektrum Akademischer Verlag, Heidelberg 2004, ISBN 3-8274-0208-5 , s. 334–336.
- Ernst Henglein: Satunnaisten metallien tekniikka. 1991, ISBN 3-8085-5081-3 .
- Harry H. Binder: Kemiallisten elementtien sanakirja - jaksollinen taulukko tosiasioissa, luvuissa ja tiedoissa. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- Richard Bauer: Litium - koska sitä ei ole oppikirjassa. Julkaisussa: Chemistry in our time . 19, nro 5, 1985, s. 167-173, doi: 10.1002 / ciuz.19850190505 .
- NJ Birch: Litiumin epäorgaaninen farmakologia. Julkaisussa: Chem. Rev. 99, nro 9, 1999, s. 2659-2682, PMID 11749496 .
- Jürgen Deberitz, Gernot Boche: Litium ja sen yhdisteet - teollinen, lääketieteellinen ja tieteellinen merkitys. Julkaisussa: Chemistry in our time . 37, nro 4, 2003, s. 258-266, doi: 10.1002 / ciuz.200300264 .
- Michael Bauer, Paul Grof, Bruno Muller-Oerlinghausen (toim.): Lithium in Neuropsychiatry: The Comprehensive Guide. 1. painos. Informa Healthcare, 2006, ISBN 1-84184-515-9 .
nettilinkit
- Yhteenveto alkalimetalleista, Wiley-VCH (PDF; 2,2 MB)
Yksilöllisiä todisteita
- ↑ a b c Harry H. Binder: Kemiallisten alkuaineiden sanakirja . Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Ominaisuuksien arvot (tietoruutu) on otettu osoitteesta www.webelements.com (litium) , ellei toisin mainita .
- ↑ IUPAC: n suosittelema vakioarvo on annettu, koska tämän elementin isotooppikoostumus voi vaihdella paikallisesti, suluissa ilmoitettu massa -alue johtaa keskimääräiseen atomipainoon. Katso: Michael E. Wieser, Tyler B. Coplen: Elementtien atomipainot 2009 (IUPAC Technical Report). Julkaisussa: Pure and Applied Chemistry . 2010, s.1 , doi: 10.1351 / PAC-REP-10-09-14 .
- ^ IUPAC, Standard Atomic Weights Revised 2013 .
- ↑ b c Merkintä litium vuonna Kramida, A., Ralchenko, Yu., Reader, J. ja NIST ASD Team (2019): NIST Atomic Spectra Database (versio. 5.7.1) . Toim.: NIST , Gaithersburg, MD. doi : 10.18434/T4W30F ( https://physics.nist.gov/asd ). Haettu 11. kesäkuuta 2020.
- ↑ b c Merkintä litium on WebElements, https://www.webelements.com , pääsee 11. kesäkuuta, 2020 mennessä.
- ^ NN Greenwood, A. Earnshaw: Alkuaineiden kemia. 1. painos. VCH, Weinheim 1988, ISBN 3-527-26169-9 , s.97 .
- ↑ Robert C.Weast (toim.): CRC Handbook of Chemistry and Physics . CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9 , s. E-129-E-145. Siellä arvot perustuvat g / mol ja ne on annettu cgs -yksiköissä. Tässä määritetty arvo on siitä laskettu SI -arvo ilman mittayksikköä.
- ^ A b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Korjatut arvot kiehumispisteille ja käsikirjojen elementtien höyrystymisen entalpioille. Julkaisussa: Journal of Chemical & Engineering Data . 56, 2011, s. 328-337, doi: 10.1021 / je1011086 .
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Kokeellisen fysiikan oppikirja . Osa 6: Kiinteät aineet. 2. painos. Walter de Gruyter, 2005, ISBN 3-11-017485-5 , s.361 .
- ↑ a b c d e f M. Hesse, H. Meier, B. Zeeh: Spektroskooppiset menetelmät orgaanisessa kemiassa . Thieme, 2002.
- ↑ b c d Merkintä litium on GESTIS aine tietokanta IFA , pääsee 30. huhtikuuta, 2017 mennessä. (JavaScript vaaditaan)
- ↑ Merkintä litium että luokitusten ja merkintöjen luetteloon on Euroopan kemikaaliviraston (ECHA), pääsee 1. elokuuta 2016 Valmistajien ja jälleenmyyjien voi laajentaa yhdenmukaistettuun luokitukseen ja merkintöihin .
- ↑ Wolfgang Pfeiler: kvantit , atomit, ytimet, hiukkaset. Walter de Gruyter GmbH & Co KG, 2017, ISBN 978-3-11-044571-8 , s.238 .
- ↑ Max Mangold: Ääntämissanakirja (= The Duden in 12 volume. Volume 6). 6. painos. 2005, ISBN 3-411-04066-1 , s.514 .
- ↑ Helmut de Boor , Hugo Moser, Christian Winkler (toim.): Siebs: Saksan ääntäminen. Puhdas ja kohtalainen lausunto ääntämissanakirjan kanssa . De Gruyter, Berliini 1969, s. 334 ( rajoitettu esikatselu Googlen teoshaussa).
- ↑ Duden online tarjoaa molemmat ääntämismuunnelmat, katso litium (ääninäytteillä ARD -ääntämistietokannasta).
- ↑ N. Figurowski: Kemiallisten alkuaineiden löytäminen ja niiden nimien alkuperä . Aulis-Verlag Deubner, Köln 1981, ISBN 3-7614-0561-8 , s.135 .
- ^ Christoph Elschenbroich : Organometallchemie. 5. painos. Teubner , Leipzig 2005, s.16 .
- ↑ a b Jessica Elzea Kogel: Teolliset mineraalit ja kivet: hyödykkeet, markkinat ja käyttötavat. 7. painos. SME, 2006, ISBN 0-87335-233-5 , s. 599 ( Teolliset mineraalit ja kivet Googlen teoshaussa ).
- ↑ Yhdysvaltojen geologinen tutkimuslaitos : Minerals Yearbook 2007: Lithium . (PDF; 75 kt), 2007.
- ↑ a b c Hans Breuer : dtv-Atlas Chemie. Nide 1, 9. painos. Deutscher Taschenbuch Verlag (dtv), München 2000, ISBN 3-423-03217-0 .
- ↑ a b Litium - verenkierron kireydenmuodostaja. ( Memento heinäkuusta 17, 2011. Internet Archive ) teoksessa VDI Nachrichten . 7. tammikuuta 2011, s.3.
- ↑ Onmeda Nutrient Lexicon , 10. kesäkuuta 2009.
- ↑ Peter Dolega, Matthias Buchert, Johannes Betz: Ekologiset ja sosioekonomiset haasteet akkujen toimitusketjuissa: grafiitti ja litium . Lyhyt tutkimus, joka on luotu osana BMBF -yhteishanketta Fab4Lib - tutkimus toimenpiteistä, joilla lisätään materiaalien ja prosessien tehokkuutta litiumioniakkujen tuotannossa koko arvoketjussa (FKZ 03XP0142E). Toim.: Oeko-Institut. Freiburg, Darmstadt 29. heinäkuuta 2020.
- ↑ a b c d e USGS [Yhdysvaltojen geologinen tutkimuslaitos] (2020): Mineral Commodity Summaries 2020 - Lithium Data Sheet. URL-osoite: https://pubs.usgs.gov/periodicals/mcs2020/mcs2020-lithium.pdf (PDF; 130 kB) (pääsy = 2020-09-07)
- ↑ Meridian International Research: The Problem with Lithium 2. (PDF; 756 kB) Martainville, toukokuu 2008.
- ^ Litiumin tarjonta Portugalissa (2017).
- ↑ LITHIUM -mahdollisuudet POHJOISPORTUGALISSA (2004).
- ↑ Euroopan litium. Haettu 17. maaliskuuta 2021 .
- ↑ Tulevaisuuden kulta: Kärntenin litiumkaivos on alkamassa. Haettu 16. heinäkuuta 2020 .
- ^ Zinnwaldin litiumhanke. Deutsche Lithium, käytetty 17. maaliskuuta 2021 .
- ↑ Zacharias Zacharakis: Litium: Vuori herää . Julkaisussa: The time . Hamburg 13. marraskuuta 2017 ( zeit.de [käytetty 5. joulukuuta 2017]).
- ↑ Alix Arnold: Suuri maisema ja himoittu raaka -aine. Bolivian Salar de Tunupa / Uyuni on täynnä kauneutta - ja litiumia. Julkaisussa: ila. Latinalaisen Amerikan observatorion lehti . 395, Bonn, toukokuu 2016, s.38–39.
- ^ Stephan Bogner: Prima Diamond Corp. ostaa Green Energy -hankkeen Utahissa, jonka litiumpitoisuudet ovat historiallisesti 1700 mg / l. Rockstone Research, 18. helmikuuta 2015 ( PDF )
- ↑ Valkoinen toivo . Julkaisussa: FAZ . 27. tammikuuta 2011, s.19.
- ^ Sixie Yang et ai.: Litiummetallin uuttaminen merivedestä . Julkaisussa: Joule . 2018, doi : 10.1016 / j.joule.2018.07.006 .
- ↑ Kaivosvesi arvokasta vettä - kaivostoiminta täyttää sähköliikenteen (INM: n lehdistötiedote)
- ↑ Minne kaikki litium meni. On: Wissenschaft.de 15. elokuuta 2006. Kaukaisen tähtijärjestelmän havainnointi tuo ratkaisun kosmologiseen arvoitukseen.
- ↑ Tietoja ruskeista kääpiöistä .
- ↑ Garik Israelian, Elisa Delgado Mena, Nuno C.Santos, Sergio G.Sousa, Michel Mayor, Stephane Udry, Carolina Domínguez Cerdena, Rafael Rebolo, Sofia Randich: Parannettu litiumivaje auringon kaltaisissa tähdissä, jotka kiertävät planeettoja. Julkaisussa: Nature . Nro 462, 2009, s. 189-191, doi: 10.1038 / nature08483 .
- ↑ Ulrich Wietelmann, Richard J. Bauer: litium ja litiumyhdisteet . Julkaisussa: Ullmann's Encyclopedia of Industrial Chemistry . nauha 21 , 2012, s. 344 , doi : 10.1002 / 14356007.a15_393 .
- ^ Terence Bell: Katsaus kaupalliseen litiumtuotantoon. The Balance, 11. toukokuuta 2018, käytetty 16. joulukuuta 2018 .
- ↑ zdf.de, 9. syyskuuta 2018, E-Autos: Yritys, joka näyttää vain puhtaalta, erityisesti osio "Litium ongelmallisena raaka-aineena", avattu 4. toukokuuta 2019.
- ↑ ARD: Voiko sähköauto säästää ympäristöä?
- ^ Litium LME: ssä. lme.com Internet -portaali (London Metal Exchange online), 2020, verkkosivusto avattu 21. maaliskuuta 2020.
- ↑ Clyde Smith: Edistynyt akkutekniikka, litium- ja grafiittikaivos ETF: t: Global X Lithium & Battery Tech ETF (NYSE: LIT), Amplify Advanced Battery Metals (NYSE: BATT). born2invest.com Internet -portaali, 10. huhtikuuta 2019 (englanti)
- ↑ Solactive Global Lithium (SOLLIT). investing.com (UK) Internet -portaali, verkkosivusto avattu 22. maaliskuuta 2020
- ↑ Solactive Global Lithium Index , tietosivu 2.4.2020 alkaen .
- ↑ a b K. Schubert: Malli kemiallisten alkuaineiden kiderakenteille. Julkaisussa: Acta Crystallographica . 30, 1974, s. 193-204, doi: 10.1107 / S0567740874002469 .
- ^ A b A. F. Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 91. - 100. parannettu ja laajennettu painos. Walter de Gruyter, Berliini 1985, ISBN 3-11-007511-3 , s. 928-931.
- ↑ litium osoitteessa webelements.com, fyysiset ominaisuudet .
- ↑ H. Malissa: Litiumin erottaminen magnesiumista litium-magnesiumseoksissa. Julkaisussa: Fresenius 'Journal of Analytical Chemistry . 171, nro 4, 1959, s. 281-282, doi: 10.1007 / BF00555410 .
- ↑ M. Binnewies: Yleinen ja epäorgaaninen kemia. Spektrum Verlag, 2006, s.328.
- ^ Mark J. Winter : Kemiallinen liimaus. Oxford University Press, 1994, ISBN 0-19-855694-2 .
- ↑ M. Binnewies: Yleinen ja epäorgaaninen kemia. Spektrum Verlag, 2006, s.241.
- ↑ G.Audi, FG Kondev, Meng Wang, WJ Huang, S.Naimi : NUBASE2016 -arviointi ydinominaisuuksista. In: Kiinalainen Physics C . 41, 2017, s. 030001, doi: 10.1088 / 1674-1137 / 41/3/030001 ( koko teksti ).
- ↑ Richard Bauer: Litium - koska sitä ei ole sanakirjassa. Julkaisussa: Chemistry in our time . 19, nro 5, 1985, s. 167-173, doi: 10.1002 / ciuz.19850190505 .
- ↑ Raportti vetypommitestistä Bravon linna (englanti)
- ↑ Martin Volkmer: Ydinenergian perustiedot. Inforum, 2006, ISBN 3-926956-44-5 , s. 39 ( PDF ( Memento of 17 kesäkuu 2012 on Internet Archive )).
- ↑ CC Bradley, CA Sackett, JJ Tollett, RG Hulet: Todisteet Bose-Einsteinin tiivistymisestä atomikaasussa houkuttelevilla vuorovaikutuksilla. Julkaisussa: Physical Review Letters . 75, nro 9, 1995, s. 1687-1690, doi: 10.1103 / PhysRevLett.75.1687 .
- ↑ S. Jochim, M. Bartenstein, A. Altmeyer, G. Hendl, S. Riedl, C. Chin, J. Hecker Denschlag, R. Grimm: Bose-Einstein Condensation of Molecules. Julkaisussa: Science . 302, nro 5653, 2003, s. 2101-2103, doi: 10.1126 / science.1093280 .
- ↑ Käsikirjoitus akkuista TU Grazissa ( muistio 24. tammikuuta 2009 Internet -arkistossa ) (PDF; 3,4 Mt).
- ↑ H. Gerdes: Litium ja endokrinium . Springer, Berliini, Heidelberg 1978, ISBN 978-3-642-66830-2 , s. 29-83 , doi : 10.1007 / 978-3-642-66830-2_2 .
- ↑ J. Cade: Litiumisuolat psykoottisen jännityksen hoidossa. Julkaisussa: Med. J. Australia. 36, 1949, s. 349-352. PMID 18142718 .
- ↑ T. Bschor: 66 vuotta nykyaikaista psykofarmaseuttista terapiaa. Julkaisussa: Neurology. 34, 2015, s.710-714.
- ↑ M.Schou: Manian ja masennuksen litiumhoito. Thieme, 2001, ISBN 3-13-593304-0 .
- ↑ Litium kaksisuuntaisessa mielialahäiriössä - annos on tärkeä! Julkaisussa: Doctors sanomalehti . 5. helmikuuta 2007, käytetty 6. syyskuuta 2021 .
- ↑ HD Mühlbauer: Litiumhoidon edut, riskit, vaihtoehdot: johdanto kaikkien erikoisalojen lääkäreille . Springer, Berliini, Heidelberg 1986, ISBN 978-3-642-96935-5 , Die Lithiumintoxikation, s. 329-336 , doi : 10.1007 / 978-3-642-96935-5_31 .
- ^ R. Haussmann, M. Bauer, S. von Bonin, P. Grof, U. Lewitzka: Litiummyrkytyksen hoito: todisteiden tarve . Julkaisussa: International Journal of Bipolar Disorders . nauha 3 , ei. 1 , 2015, ISSN 2194-7511 , s. 23 , doi : 10.1186 / s40345-015-0040-2 , PMID 26493348 .
- ↑ Gerhard N. Schrauzer, Krishna P. Shrestha: Litium juomavedessä ja ilmaantuvuus rikosten, itsemurhien ja pidätykset liittyvät lääkeaineriippuvuuksien. Julkaisussa: Biological Trace Element Research . 25. toukokuuta 1990, s. 105-113 , PMID 1699579 .
- ↑ Nestor D.Kapusta, Nilufar Mossaheb, Elmar Etzersdorfer, Gerald Hlavin, Kenneth Thau, Matthäus Willeit, Nicole Praschak-Rieder, Gernot Sonneck, Katharina Leithner-Dziubas: Litium juomavedessä ja itsemurhakuolleisuus . Julkaisussa: The British Journal of Psychiatry: The Journal of Mental Science . nauha 198 , ei. 5 , 2011, ISSN 1472-1465 , s. 346-350 , doi : 10.1192 / bjp.bp.110.091041 , PMID 21525518 .
- ↑ MJ Berridge: Inositolitrisfosfaatti ja diasyyliglyseroli toisina sanansaattajina. Julkaisussa: Biochemical Journal . 220, nro 2, 1984, s. 345-360, PMC 1153635 (ilmainen koko teksti).
- ↑ DH Carney, DL Scott, EA Gordon, EF LaBelle: Fosfoinositidit mitogeneesissä: neomysiini estää, trombiinin stimuloimaa fosfoinositidien kiertoa ja solujen lisääntymisen aloittamista. Julkaisussa: Cell . 42, nro 2, 1985, s. 479-488 , PMID 2992800 .
- ^ R. Williams, WJ Ryves, EC Dalton, B. Eickholt, G. Shaltiel, G. Agam, AJ Harwood: Litiumin molekyylisolubiologia. Julkaisussa: Biochem. Soc. Trans. 32, 2004, s. 799-802, doi: 10.1042 / BST0320799 .
- ↑ Psykiatrinen lääkehoito .
- ↑ Brigitte Woggon : Hoito psykotrooppisilla lääkkeillä . Huber, Bern 1998, s. 77-84.
- ↑ T.Hafen, F.Wollnik: Litiumkarbonaatin vaikutus aktiivisuustasoon ja vuorokausivaiheeseen eri rotakannoissa . Julkaisussa: Farmakologia Biokemia ja käyttäytyminen . 49, 1994, s. 975-983, PMID 7886116 .
- ^ E. Bünning, I. Moser: Valinomysiinin vaikutus Phaseoluksen vuorokausijärjestelmään . Julkaisussa: Proc. Natl. Acad. Sei. Yhdysvallat . 69, nro 9, 1972, s. 2733, PMC 427027 (ilmainen koko teksti).
- ↑ W. Engelmann: Litium hidastaa kelloa Kalanchoe. In: Journal of Nature Research B . 27, 1972, s.477 ( verkossa ). PMID 4403319 .
- ↑ Hallusinogeenien ymmärtäminen. (Ei enää saatavilla verkossa.) Ruprecht-Karls-Universität Heidelberg, arkistoitu alkuperäisestä 17. tammikuuta 2012 ; luettu 11. kesäkuuta 2016 .
- ↑ Sean MJ McBride et ai.: Iästä riippuvaisten kognitiivisten alijäämien farmakologinen ja geneettinen kääntäminen, joka johtuu heikentyneestä preseniliinitoiminnasta. Julkaisussa: The Journal of Neuroscience . 30, 28, 2010, s. 9510-9522, doi: 10.1523 / JNEUROSCI.1017-10.2010 .
- ↑ Lars Vedel Kessing, Thomas Alexander Gerds, Nikoline Nygård Knudsen, Lisbeth Flindt Jørgensen, Søren Munch Kristiansen Denitza Voutchkova, Vibeke Ernstsen Jörg Schullehner, Birgitte Hansen Per Kragh Andersen, Annette Kjær Ersbøll: Liitto litiumin juominen ilmaantuvuus dementian . Julkaisussa: JAMA Psychiatry . nauha 74 , ei. 10 , 2017, ISSN 2168-622X , s. 1005 , doi : 10.1001 / jamapsychiatry.2017.2362 .
- ↑ Yumiko Motoi, Kohei Shimada, Koichi Ishiguro, Nobutaka Hattori: Litium ja autofagia . Julkaisussa: ACS Chemical Neuroscience . nauha 5 , ei. 6 , 2014, s. 434-442 , doi : 10.1021 / cn500056q , PMID 24738557 .
- ↑ Kim Zarse, Takeshi Terao, Jing Tian, Noboru Iwata, Nobuyoshi Ishii ja Michael Ristow: Pieni annos litiumia lisää ihmisten ja metatsaanien pitkäikäisyyttä. Julkaisussa: Eur J Nutr . 50 (5), 2011, s. 387-389; doi: 10.1007 / s00394-011-0171-x ; PMID 21301855 ; PMC 3151375 (ilmainen koko teksti).
- ↑ Takeshi Terao: Onko litium mahdollisesti hivenaine? Julkaisussa: World Journal of Psychiatry . nauha 5 , ei. 1 , 2015, s. 1-3 , doi : 10.5498 / wjp.v5.i1.1 .
- ↑ Otto-Albrecht Neumüller (toim.): Römpps Chemie-Lexikon. Osa 3: H-L. 8. tarkistettu ja laajennettu painos. Franckh'sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7 , s. 2386-2387.
- ↑ Jaksotaulukko: litium . Uniterra.de.
- ↑ PJ Pearce, DH Richards, NF Scilly: Yksivaiheinen vaihtoehto Grignardin reaktiolle. Julkaisussa: J. Chem. Soc., Perkin Trans. 1 . 1972, s. 1655-1660, doi: 10.1039 / P19720001655 .








![{\ displaystyle \ mathrm {Li ^ { +} + \ mathrm {e} ^ {-} \ {\ xrightarrow [{Electrolysis}] {(450-500) \, ^ {\ circ} C}} \ Li}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/467e9c877afa1b2a38b28c0a03a93ff0beb790c8)