fosfori
| ominaisuudet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Yleisesti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nimi , symboli , atominumero | Fosfori, P, 15 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementtiluokka | Ei-metallit | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ryhmä , piste , lohko | 15 , 3 , s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ulkomuoto | valkoinen-beige (W) tummanpunainen (R) musta (S) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS -numero |
7723-14-0 (punainen) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EY -numero | 231-115-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA InfoCard | 100,028,286 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massiivinen osa maan verhosta | 0,09% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomimassa | 30,973761998 (5) et ai | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomisäde (laskettu) | 100 (98) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenttinen säde | 107 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsin säde | 180 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronikonfiguraatio | [ Ne ] 3 s 2 3 p 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisointienergia | 10.486 686 (15) eV ≈ 1 011.81 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisointienergia | 19.76949 (4) eV ≈ 1 907.47 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisointienergia | 30.20264 (9) eV ≈ 2 914.11 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisointienergia | 51.44387 (12) eV ≈ 4 963.58 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisointienergia | 65.02511 (12) eV ≈ 6 273.97 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyysisesti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyysinen tila | kiinteä | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Muutokset | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallirakenne | ortorombinen (musta) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| tiheys | valkoinen: 1,83 g / cm 3 punainen: 2,0 ... 2,4 g / cm 3 musta: 2,69 g / cm 3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismi |
diamagneettinen (punainen: Χ m = −1,9 10 −5 musta: = −2,9 10 −5 ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sulamispiste | valkoinen: 317,3 K (44,2 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| kiehumispiste | valkoinen: 553,2 K (280 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molaarinen tilavuus | 17,02 · 10 −6 m 3 · mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Haihtumislämpö | 51,9 kJ / mol (P 4 ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fuusion lämpö | 0,64 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Höyrynpaine | punainen: 3900 Pa valkoinen: 3300 Pa 293 K: ssa |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ominaislämpökapasiteetti | punainen: 685,6 J kg −1 K −1 298 K: ssa. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lämmönjohtokyky | 0,236 W m −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiallisesti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hapettumistilat | ± 3, 4, 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatiivisuus | 2,19 ( Paulingin asteikko ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotoopit | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Katso muut isotoopit isotooppiluettelosta | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR -ominaisuudet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| turvallisuusohjeet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Sveitsi: 0,02 mg m −3 (valkoinen / keltainen fosfori, hengitettävä pöly ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toksikologiset tiedot |
Valkoinen fosfori
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
SI -yksiköitä käytetään mahdollisuuksien mukaan ja tavanomaisesti . Ellei toisin mainita, annetut tiedot koskevat vakio -olosuhteita . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
Fosfori ( muinaisesta kreikasta φωσφόρος phōsphóros , saksaksi 'valoa kantava' , valkoisen fosforin hehkusta reagoidessaan hapen kanssa ) on kemiallinen elementti, jolla on symboli P ja atomiluku 15. Jaksotaulukossa se on viidennessä pääosassa ryhmä tai 15. IUPAC -ryhmä tai typpiryhmä .
Fosforia esiintyy useissa, hyvin erilaisissa muunnelmissa . Valkoista fosforia koostuu P 4 -molekyylien on helpoin tuottaa, mutta termodynaamisesti ei vakain muutos.
Fosforiyhdisteet ovat välttämättömiä kaikille eläville olennoille, ja ne osallistuvat organismien rakenteeseen ja toimintaan keskeisillä alueilla, kuten DNA: ssa ja solun energiansaannissa ( ADP / ATP ). Biogeokemiallinen muuntaminen fosfori tapahtuu puitteissa fosforin syklin .
tarina



Saksalainen apteekkari ja alkemisti Hennig Brand löysi fosforin vuonna 1669 , kun hän haihdutti virtsaa kuivaksi etsiessään ” viisasten kiveä ” . Kun kuiva virtsanjäännös, joka - kuten tiedämme tänään - sisältää myös fosfaatteja (fosforihapon suoloja), hehkui ilman sulkeutuessa - eli ilman hapettavaa ainetta - fosfaattien pelkistyminen sisältämien orgaanisten yhdisteiden kanssa virtsaan saatiin valkoisempaa valkoista pelkistävänä aineena fosforia, joka hehkui pimeässä sen kemiluminesenssin vuoksi .
Vaikka fosforia ei käytetty tuolloin vain yölamppuna, se punnittiin kultaa vasten . Hennig Brand ei rikastunut tästä löydöstä ja myi reseptin alkemistille Johann Daniel Kraftille , joka puolestaan teki siitä omaisuuden. Hän osoitti fosforin tuotannon vuonna 1677 ennen Robert Boylea . On huomionarvoista, että Hennig Brand esitteli fosforinsa myös Hannoverissa tiedemiehelle ja filosofille Gottfried Wilhelm Leibnizille , joka kirjoitti innostuneena runon salaperäisestä valonkantajasta "Phosphorus Mirabilis".
Valkoista fosforia alun perin käytetty kuin korjata , koska sen kemiluminesenssin . Vuoden 1830 jälkeen siitä tuli erittäin tärkeä tulitikkujen valmistuksessa . Koska valkoinen fosfori on kuitenkin erittäin myrkyllistä, sen kanssa kosketuksiin joutuneet työntekijät myrkytettiin usein vakavasti. Fosforihöyryt tunkeutuivat pääasiassa kehoon vaurioituneiden hampaiden kautta ja johtivat erityisesti leuan fosforinekroosiin . Fosforileuka, englanninkielinen leuka , oli yksi ensimmäisistä ammattitaudeista , jotka diagnosoitiin sellaisina.
Valkoinen fosfori oli aseena sotahistoriassa . Sitä käytettiin sytytyspommien , niin kutsuttujen fosforipommien, täyttömateriaalina . Britannian ilmavoimat käyttivät valkoisen fosforin ja kumin seosta toisen maailmansodan aikana . Kumin ansiosta viskoosi massa tarttuu ja on siksi vaikea irrottaa. Se sai haavat parantumaan huonosti iholla.
Kemistit havaitsivat varhain, että valkoinen fosfori muuttui punaiseksi altistuessaan valolle jopa tyhjiössä. Jöns Jakob Berzelius epäili, että tämä oli valkoisen fosforin muunnos, jonka todisti vasta vuonna 1847 Wienissä sijaitseva Anton Schrötter von Kristelli (Anton Schrötter), joka eristi ja analysoi aineen. Violetin fosforin löysi Johann Wilhelm Hittorf vuonna 1865 . ja kohopaino variantti musta fosfori Percy Williams Bridgman 1914.
Esiintyminen
Maapallolla, erityisesti maankuorella, fosforia esiintyy yksinomaan sitoutuneessa muodossa, toisin sanoen ei ole alkuperäistä, enimmäkseen fosfaattien muodossa (maankuoren pitoisuus: ~ 0,09%, noin 1,2 kiloa tonnilta). Tyypillisiä mineraaleja ovat apatiitit Ca 5 (PO 4 ) 3 (F, Cl, OH). Erityisesti fluorapatiitti ja fosforiitti , johon on sekoitettu kalsiumkarbonaattia, ovat taloudellisesti tärkeimpiä fosfaatteja. On myös muita fosforipitoisia mineraaleja, kuten wavelliitti Al 3 (PO 4 ) (F, OH) · 5 H 2 O, Vivianite fe 3 (PO 4 ) 2 · 8 H 2 O ja turkoosi CuAl 6 [(PO 4 ) (OH 2 )] 4 · 4 H 2 : lla
Suurimmat fosfaattimineraaliesiintymät löytyvät Afrikasta, Kiinasta ja Yhdysvalloista ( Florida ). Neljässä maassa on noin 80% maailman fosfaattikivivarannoista, jotka voidaan taloudellisesti louhia nykytekniikan avulla : Marokko (yhdessä Länsi -Saharan kanssa 36,5%), Kiina (23,7%), Jordania ja Etelä -Afrikka (kumpikin 9,6%). Manner -talletukset ovat riittäviä vain muutaman vuosikymmenen ajan; Arviot 2000 -luvulta vaihtelevat 50 (2008) ja 130 vuoden (2006) välillä. Kuitenkin juuri Pohjois -Afrikassa ja Irakissa äskettäin löydettyjen tallettusten seurauksena Saksan hallituksen vuonna 2012 tekemässä arviossa oletetaan, että pulaa ei ole välitön ja että tähän mennessä tunnetut varastot kestävät noin vuoteen 2400. Veden alla on myös suuria saostumia, mutta niitä ei tällä hetkellä voida louhia taloudellisesti.
Lisäksi mineraalien, fosfori on myös todettu talletukset lintujen jätökset päässä merilintuja , ns guano (sisältää 7-8%, poikkeustapauksissa jopa 60% Chile nitraatti ja enintään noin 40% fosfaatteja). Tätä esiintyy pääasiassa joillakin Tyynenmeren saarilla, kuten Naurussa tai Kiribatissa ja Etelä -Amerikassa ( Peru / Chile ). Naurun fosforivarastot ovat vähentyneet jatkuvasti 1970-luvun puolivälistä lähtien ja ovat nyt lähes kokonaan loppuneet.
Jätevesiliete sisältää myös suuria määriä fosfaatteja. Fosforihappoa voidaan ottaa talteen puhdistamolietteen kautta kaupunkien kaivostoiminnan .
Maailmassa vuosittain uutettavasta noin 180 miljoonasta tonnista kivifosfaatteja (vuodesta 2010) noin 90 prosenttia käytetään lannoitteiden valmistukseen . Fosforia ei voida korvata millään muulla lannoitteiden aineella.
Fosforilla on myös tärkeä merkitys orgaanisessa maailmassa (sitoutuneena tai hiukkasiin sitoutuneena orgaanisena fosfaattina organismeissa ja detriitissä ), ja sitä esiintyy eläimistön ja kasviston eri alueilla : esimerkiksi hydroksyyliapatiittina Ca 5 (PO 4 ) 3 OH, joka on yksi luista ja hampaista löytyvän rakenneaineen pääkomponenteista. Lisäksi fosforiyhdisteillä on tärkeä rooli elävissä organismeissa nukleiinihappojen komponenttina ja ATP -energian kantaja -aineena, ja ne ovat välttämättömiä kaikille tunnetuille eläville olennoille.
Fosfori on muodostettu massiivisia tähtiä, kun palava hapen välillä happi lämpötiloissa yli 1,5 · 10 9 Kelvin ja tiheydet vähintään 10 10 kg / m 3 .
Oletetaan, että varhaisille eläville olennoille käyttökelpoista fosforia oli saatavana vain meteoriittien kautta, jotka tulivat maahan Hadaicin aikakaudella . Vuonna 2020 tähtitieteilijät käyttivät ALMA- ja ROSINA -tietoja näyttääkseen polun fosforin muodostumiselle: tähtien muodostumisen aikana kaasupilvissä, kuten ”AFGL 5142”. Ne osoittavat myös, että tämä olisi voinut päästä maapallolle komeettojen - kuten Churyumov -Gerasimenko - kautta fosforimonoksidin muodossa. Fosfaatti, joka esiintyy jo maan päällä, on inertti ja vaikeasti liukeneva, ja siksi siitä olisi ollut vain vähän hyötyä ensimmäisille eläville olennoille. Sitä vastoin meteoriittien tuomat kirjanoppineet reagoivat veden kanssa muodostaen pelkistyneitä fosfideja . Nämä olisivat uskottavia lähtöaineita fosforyloitujen biomolekyylien (kuten ribonukleiinihapon ) prebioottiselle synteesille .
Poiminta ja esittely
Fosforia saadaan fosfaattimineraaleista, kuten fosforiitista tai apatiitista , jossa ne kuumennetaan 1500 ° C: seen sähköisessä sulatusvähennysuunissa yhdessä kvartsilasteen kanssa ja muutetaan siten valkoiseksi fosforiksi. Uuni on suunniteltu suljetuksi matala-akseliseksi uuniksi, lämpö syötetään Söderbergin elektrodien kautta .
Hiili massa sisältämä elektrodi toimii pelkistimen ja piidioksidin kvartsi toimii kuonanmuodostajia. Prosessin aikana kaasumaisessa muodossa syntyvä fosfori tiivistyy ja kerätään veden alle.
Valmistaja
Viimeisen eurooppalaisen valmistajan Thermphosin konkurssin jälkeen valkoisen fosforin toimitus perustuu lähes yksinomaan Tsfimkentissä sijaitsevaa laitosta käyttävään Kazphosphate -yhtiöön . Muita valmistajia ovat Monsanto, jolla on tehdas Soda Springsissä ( Idaho ), ja useita kiinalaisia yrityksiä.
Muutokset ja ominaisuudet
Fosforia esiintyy neljässä allotrooppisessa muunnoksessa, kuten valkoinen, punainen, musta ja violetti fosfori. Jokainen näistä perustyypeistä muodostaa erilaisia kiderakenteita . Tämä johtaa erittäin suuriin eroihin fysikaalisissa ominaisuuksissa ja reaktiivisuudessa.
Koska muita modifikaatioita on vaikea saada suoraan, aina ensin tuotetaan valkoista fosforia ja tämä muutetaan sitten muiksi muunnoksiksi. Ne voidaan muuttaa toisiksi korkealla paineella ja korkealla lämpötilalla. Musta fosfori on itse asiassa vakain muutos huoneenlämmössä, mutta muut ovat metastabiileja hitaan muuntokurssin vuoksi . Valkoista fosforia voidaan tuottaa laboratoriossa kuumentamalla punaista fosforia ilman happea. Päinvastoin, punaista fosforia voidaan tuottaa myös lämmittämällä valkoista fosforia noin 180-350 ° C: seen useita tunteja.
Kaasumainen tila
Fosforin höyry, CP 4 tetrahedra enemmistönä kuin pienin molekyyli- yksikköä alle 1200 ° .
PP etäisyys tetraedrisen P 4 -molekyylit on r g = 2,1994 (3) Ä, PPP kulma on 60 °. Rakenne määritettiin kaasuelektronidiffraktiolla .
Aste dissosiaatio on ~ 1% 800 ° C: ssa Välillä 1200 ja 2000 ° C: ssa, P 2 molekyylejä, joilla on typpeä analoginen valenssielektroni rakenne vallitseva , yli 2000 ° C: ssa nämä lopulta erottaa hitaasti atomi fosfori lämpötilan noustessa.
Valkoinen fosfori
Valkoinen fosfori on haihtuvin ja reaktiivisin fosforin muunnos. Sen tiheys on 1,82 g / cm 3 , sulamispiste 44,25 ° C ja kiehumispiste 280 ° C, ja se on läpikuultava ja vahamainen. Saastuneena valkoinen fosfori tunnetaan myös keltaisena fosforina . Kuutiometriä valkoista fosforia on erittäin helposti liukeneva in fosforitrikloridia ja hiili rikkihiilen CS 2 ; 100 g hiilidisulfidia liuottaa yli 1 kg fosforia. Fosfori on niukkaliukoinen sisään hiilitetrakloridissa , bentseenissä tai eetterissä . Se on käytännössä liukenematon veteen.
On -76,9 ° C kuutiometriä muoto (α-muoto) muuttuu kuusikulmainen muoto (β-muoto) (kierto vapaa ulompi elektronit "jäädytetty"). Missä tahansa muodossa (α-, β-, liuoksessa) valkoista fosforia muotoja P 4 tetrahedra sidoksella 60 °.
Hienojakoisessa tilassa valkoinen fosfori syttyy itsestään ilmassa; noin 50 ° C: sta jopa pienet palat syttyvät ja palavat muodostaen fosfori (V) oksidia . Siksi valkoista fosforia on pidettävä veden alla. Palavaa fosforia ei saa sammuttaa vedellä, koska on olemassa vaara, että fosforipöly pestään pieniksi halkeamiksi ja syttyy uudelleen veden haihtumisen jälkeen. Palava fosfori on parasta sammuttaa hiekalla.
Valkoinen fosfori voi osoittaa sinertävää kemiluminesenssia ilmassa . Tämä johtuu ympäristössä olevasta kaasumaisesta P 4 : stä johtuen valkoisen fosforin korkeasta höyrynpaineesta , joka reagoi P 4 O 10: een kaasufaasipaperoitumisen kautta P 4 O 6: n kautta . Yleensä voimakkaassa eksotermisessä reaktiossa fosfori yhdistyy halogeenien, metallien tai rikin kanssa. Tuloksena olevat yhdisteet ovat fosforisulfideja , fosfori (III) - tai fosfori (V) -yhdisteitä ja fosfideja . Voimakkaiden emästen vaikutuksesta korkeissa lämpötiloissa fosfori on suhteeton fosfiiniin ja hypofosfiittiin. Fosforilla on suuri affiniteetti happea kohtaan , joten sillä on voimakas pelkistävä vaikutus . Joten z. B. Rikkihappo pelkistyy rikkidioksidiksi kuumennettaessa valkoisella fosforilla .
Fosforipentoksidi, joka muodostuu palaessaan fosforia, on erittäin hygroskooppinen ja muodostaa yhdessä ilman kosteuden kanssa paksun fosforihapon sumun. Siksi savukranaateissa käytetään valkoista fosforia.
Valkoinen fosfori on erittäin myrkyllistä; jo 50 mg voi olla kohtalokas aikuiselle ihmiselle. Kuolema tapahtuu vasta viiden tai kymmenen päivän kuluttua. Valkoinen fosfori erittyy myös vain hitaasti. Hidas myrkyllisyys tekee (e) fosforista sopivan rotamyrkkyksi . Tätä tarkoitusta varten käytettiin niin kutsuttuja "Phosphorlatwergen". Yleisten vaarojen ja sopivampien aineiden vuoksi valkoinen fosfori on vanhentunut rotamyrkkynä.
Valkoisen fosforin myrkyllisyys johtuu pääasiassa sen suuresta pelkistävästä voimasta , joka häiritsee solunsisäisiä oksidatiivisia aineenvaihduntaprosesseja, kuten proteiinien ja hiilihydraattien synteesiä. Tämä koskee pääasiassa entsymaattisesti kontrolloituja metabolisia prosesseja maksassa. Vaaran muodostavat erittäin myrkylliset fosfiinit, jotka muodostuvat reaktiossa veden kanssa , jotka ovat voimakkaita aineenvaihduntamyrkkyjä ja joilla on erityinen affiniteetti keskushermostoon . Valkoinen fosfori voidaan tehdä vaarattomaksi kupari (II) sulfaattiliuoksella. Prosessissa muodostuu heikosti liukoista kupari (I) fosfidia .
Koska 1845 oli työntekijöiden keskuudessa, pääasiassa teollisessa tuotannossa matchsticks raskas valkoinen fosfori, leuka - nekroosia havaittiin ( englanti phossy leuka ). 1800 -luvulla työntekijät, jotka käsittelivät fosforikylpyjä täysin suojaamattomina (usein myös lapset ja nuoret, jotka olivat kiireisiä tulitikkujen pakkaamiseen), eivät pystyneet nopeasti työskentelemään. Tehokasta hoitoa ei ollut. Potilaat olivat vakavasti epämuodostuneita, usein työttömiä, kuolleisuus oli 20%. Ammattitaudiksi lääketieteellinen ongelma fosforin kuolion , varsinkin massiivinen mänty kuolion, johti ensimmäiseen työlääketieteellisen seurauksia historian moderni lääketiede. Vuonna 1906 Bernin yleissopimus johti valkoisen fosforin kieltämiseen tulitikkujen valmistuksessa. Samanlainen leuan nekroosi voidaan nähdä nykyään bisfosfonaattihoidolla ( bisfosfonaattiin liittyvä luun nekroosi ).
Musta fosfori
Vakain muutos huoneenlämmössä on yhdessä amorfisessa ja kolmessa kiteisessä muodossa. Polymeerimuodostaan johtuen musta fosfori on liukenematon, huomattavasti vähemmän syttyvä, erittäin inertti ja sen tiheys on 2,69 g / cm 3 . Siksi musta fosfori on myrkytön, kuten punainen fosfori. Kidehila, johon musta fosfori perustuu, koostuu aallotetuista kaksoiskerroksista, joissa fosforiatomit ovat pyramidimaisesti yhteydessä kolmeen muuhun läheiseen fosforiatomiin 100 °: n sidoskulmassa. Tässä kokoonpanossa fosforilla on puolijohtavia ominaisuuksia . Kosteassa ilmassa musta fosfori hapettuu hieman nopeammin kuin punainen fosfori, mutta se on peitetty värittömällä, viskoosisella nesteellä, joka on valmistettu fosforihapoista, jolloin hapen pääsy estyy ja tulehdus vaikeutuu. Normaali musta fosfori kiteytyy ortorombisesti ; 80 000 baarissa tämä muuttuu palautuvasti romboedriseksi ja 110 000 baaria kuutiometalliseksi .
Musta fosfori muodostuu valkoisesta fosforista korkeassa paineessa (12 000 bar) ja korotetussa lämpötilassa (200 ° C) ja on väriltään hyvin erilainen kuin edellä mainittu muutos. Se näyttää harmaamustalta, kiiltävältä ja kuitumaiselta kuin puu. Matalapaineinen muutos on myös tehty äskettäin.
Punainen fosfori
Monet amorfiset ja kiteiset muodot, joiden tiheysvaihtelut ovat 2,0 - 2,4 g / cm 3 ja sulamispisteet välillä 585 ° C - 610 ° C, on ryhmitelty yhteen nimellä punainen fosfori . Punainen fosfori on yleensä amorfista, mutta se voidaan muuttaa monokliiniseksi Hittorfian (violetiksi) fosforiksi uudelleenkiteyttämällä sulasta lyijystä , joka muodostaa kolmiulotteisen silloitetun polymeerimuodon.
Punaista fosforia saadaan kuumentamalla valkoista fosforia useita tunteja noin 260 ° C: een ilman poissa ollessa. Hidas muuntuminen tapahtuu myös valolle altistettuna. Jodi katalysoi valkoisen fosforin muuttumista punaiseksi.
Punaisen fosforin kiteisten osien väliset erot määräävät sen eri muodot. Raekoko , tyyppi ristikko , epäpuhtauksien ja eri tyydyttymättömyyttä ja reunan ryhmien halogeenit , hapen ja hydroksyyliryhmiä vaikuttaa tässä .
Vaikka punainen fosfori ei ole itsesyttyvää, se voi johtua äkillisestä syttymisestä tai jopa räjähtämisestä voimakkaiden hapettimien kanssa alhaisen energiankulutuksen (kitka, isku) kautta. Esimerkki tästä on Armstrongin seos , jota käytetään turvaväleihin . Reaktiivisuuden suhteen violetti fosfori muistuttaa enemmän mustaa fosforia, kun taas Schenckin fosfori on paljon reaktiivisempaa kuin ”normaali” punainen fosfori.
Toisin kuin valkoinen fosfori, punainen fosfori ei ole myrkyllistä. Hänen ensimmäinen kuvauksensa on Anton Schrötter von Kristelli .
Kirkas punainen fosfori
Vaaleanpunainen tai Schenckin fosfori ( Rudolf Schenck , 1902) saadaan keittämällä valkoista fosforia fosforitribromidissa (PBr 3 ). Tuote on fosforiyhdiste, jossa on 10 - 30% bromia, jonka tiheys on 1,88 g / cm 3 .
Violetti / Hittorfin fosfori
Violetti fosfori muodostuu, kun valkoista fosforia kuumennetaan noin 550 ° C: seen 1-2 viikon ajan.
Johann Wilhelm Hittorf löysi hänet . Se on johtamaton polymeeri, joka ei liukene CS 2: een . Rakenne selvittäminen onnistui 1960-luvun lopulla on Stuttgartin yliopistossa vuoteen Herbert Thurn . Violetti fosfori on myös myrkytön.
Fosforin nanorodit
Elokuussa 2004 saksalaiset tutkijat onnistuivat eristämään ja rakenteellisesti luonnehtimaan kaksi muuta monitahoisen elementin modifikaatiota: fosforin nanododit . Näissä kahdessa muunnelmassa fosforiatomit ovat ketjumolekyylejä (polymeerejä). Discoverers Uuden muutokset ovat Arno Pfitzner päässä Regensburgin yliopistosta ja Hellmut Eckert päässä Westfalenin Wilhelms Universität Münster . Punaruskeat kuidut, jotka eroavat merkittävästi punaisesta fosforimuunnoksesta, ovat stabiileja kuivassa tilassa viikkoja ilmassa. Elektronimikroskopia osoitti tämän punaruskean fosforimuodon pitkiksi, yhdensuuntaisiksi nanopaloiksi, joiden halkaisijat olivat noin 0,34 nm (nanometriä)-0,47 nm.
Isotoopit
Fosforilla on vain yksi vakaa isotooppi , 31 P; tämä on ainoa luonnossa esiintyvä fosforin isotooppi. Siksi se on puhdas alkuaine (anisotooppi).
Fosforilla on useita muita isotooppeja, jotka kaikki ovat radioaktiivisia. Fosforin isotoopilla 33 P on pisin puoliintumisaika , 25,3 päivää . 32 P: n puoliintumisaika on 14,3 päivää ja sitä käytetään lääketieteessä. Sitä käytetään myös merkkiaineena molekyylibiologiassa . Sitä voidaan käyttää, esimerkiksi radioaktiivisesti merkki geenikoettimia ja havaita ne avulla autoradiografialla .
käyttää
Suurin osa (80%) tuotetusta valkoisesta fosforista poltetaan fosfori (V) oksidiksi (P 2 O 5 ), jota käytetään lähtöaineena fosforihapon tuotannossa ja erilaisten fosfaattien valmistuksessa . Suurin osa fosfaateista sitä vastoin käytetään lannoitteina . Fosforioksidi on myös tärkeä yhtenä tehokkaimmista kuivatusaineista ( kuivausaineista ).
Toinen osa on fosforitrikloridi (PCl 3 ) ja fosfori (V) sulfidi (P 4 S 10 käsitelty), vuorostaan perusaineina palonestoaineiden , lisäaineiden , pehmittimien ja torjunta -aineiden valmistuksessa.
Punaista fosforia käytetään tulitikkujen valmistukseen . Paradoksaalisesti hienojakoista punaista fosforia lisätään myös muoveihin (esim. Polyamidi ) palonestoaineena: fosforin, ilmakehän hapen ja veden (kosteus, muovijäännöskosteus) reaktiotuotteet muodostavat hiiltyneen suojakerroksen liekkejä vastaan. Lisäksi muodostuneet fosforisuboksidit toimivat esim. B. PO, radikaalienpoistajana ja keskeyttää palaminen kaasufaasissa tällä tavalla.
Lisäksi lannoitteina tärkeät fosfaatit saadaan suoraan kalsiumfosfaatista hajottamalla se rikkihapolla . Tuotetaan ns. Superfosfaattia . Tähän tarvitaan noin 60% maailman rikkihapon tuotannosta.
Punaista ja valkoista fosforia käytetään myös sotilaallisiin tarkoituksiin. Hyvin myrkyllistä ja itsesyttyvää valkoista fosforia käytetään sytytystarvikkeissa , kuten fosforipommeissa, ja sitä käytettiin aiemmin myös savuammussa. Nykyaikaisissa savuammoissa myrkytöntä punaista fosforia käytetään kuitenkin seoksissa hapettimien ja metallipolttoaineiden kanssa. Jos sumu on tavoite, yritetään saada mahdollisimman hieno pöly P 2 O 5: sta , jonka jokainen hiukkanen toimii hygroskooppisesti ilmankosteuden tiivistymisytimenä. Sumu koostuu pienistä pisaroista laimeaa fosforihappoa, melko heikkoa happoa.
Kouluihin tehtiin 1980 -luvulle asti myös kokeita valkoisella fosforilla, mikä oli kiellettyä terveydellisistä syistä. Nyt vain punaista fosforia voidaan käyttää kokeissa.
Radioaktiivista fosfori -isotooppia 32 P käytetään lääketieteessä ja tutkimuksessa merkkiaineena aineenvaihduntaprosessien tarkkailuun (esimerkiksi 32P -merkinnän jälkeen ) tai sairauksien hoitoon, kuten polycythemia veran ydinlääketieteelliseen hoitoon . Vanhentunut menetelmä suonikalvon melanooman diagnosoimiseksi oli radiofosforitesti .
Maassa
Fosfori pääsee maaperään luonnollisesti apatiittisään tai hajoavan orgaanisen aineksen kautta. Ilmakehän kerrostumisella on fosforin kanssa vain aliarvostettu rooli. Fosfori on tärkeä ydinravinne . Kanssa keinolannoitteita , ihmiset lisäävät fosforipitoisuus maaperässä. Eroosiota voidaan pitää tappioiden tärkeimpänä tekijänä. Suora huuhtelu pohjaveteen on hyvin vähäistä, ja lukuun ottamatta vähäisiä määriä fosfiinikaasua maaperästä ei tule kaasuja. Fosfaatin liukoisuus on erittäin huono . Esimerkiksi, adsorptio on Fe ja Al hydroksidit happamassa maaperässä johtaa fosfaatti kiinnittäminen. Perusmaissa esiintyy kalsiumia .
Yleensä maaperän fosfaattijakeet voidaan luokitella eri tavoin. Kaksi usein käytettyä luokitusta ovat luokitus liukoisuuden mukaan ja luokitus fosfaattityyppien mukaan.
Kolmen eri fosfaattijakeen luokittelu maaperässä liukoisuuden mukaan:
- Maaperäliuoksessa oleva fosfaatti on suoraan kasvien saatavilla. Tämä on kuitenkin pienin osuus 1–2 kg / ha.
- Epävakaa fosfaatti sitoutuu löyhästi rauta- ja alumiinioksideihin tai savimineraaleihin spesifisen sorption kautta. Maaperässä voi siis olla 450–900 kg / ha. Tästä fraktiosta voidaan muodostaa absorboimalla kasveista saatavia fosfaatteja.
- Stabiililla fosfaatilla ei ole käytännössä merkitystä kasvien ravitsemukselle, vaikka se on 3000–6000 kg / ha suurin kolmesta jakeesta. Tärkeimmät edustajat ovat apatiitit ja kalsiumfosfaatit.
Nämä jakeet ovat dynaamisessa tasapainossa keskenään ja voivat joskus sulautua toisiinsa hyvin pitkän ajan kuluessa.
Kolmen eri maaperän fosfaattijakeen luokittelu fosfaattityyppien mukaan:
- Epäorgaaninen fosfaatti on osa, joka on läsnä primaarinen fosforia mineraaleja (esim. Apatiitti ), toisen asteen fosforia mineraaleja ( Fe , AI tai Ca mineraalit ) tai adsorboitu on Fe ja Al hydroksidit .
- Liuennut fosfaatti on osuus, joka on liuenneessa muodossa maaperäliuoksessa H 2 PO 4 - tai HPO 4 2− . Liuennut fosfaatti on suoraan kasvien saatavilla.
- Orgaaninen fosfaatti on yhteinen termi kaikille muille maaperässä oleville orgaanisille yhdisteille. Tämä sisältää fosforia humuksessa, fosforia adsorboituneena orgaanisiin molekyyleihin, mikrobifosforia ja fosforia kasvijäännöksissä.
Se ajankohta, jolloin maailman suurin fosfaattituotanto saavutetaan, tunnetaan huippufosforina .
Biologinen merkitys
fysiologia
Fosfori on välttämätöntä kaikille biologisille organismeille. Fosforiyhdisteet ovat osa DNA- ja RNA -molekyylejä, kantaja -ainetta kaikkien elävien olentojen geneettiselle tiedolle. Korkean fosforipitoisuuden omaavalla adenosiinitrifosfaatilla on ratkaiseva rooli solujen energia -aineenvaihdunnassa (aktivoitu sokeri). Fosforia on myös sokerifosfaateissa, fosfolipideissä ja koentsyymeissä . Fosforylaatio on keskeinen säätelymekanismien organismeissa. Fosfaatit ovat olennainen osa pH-puskurisysteemiä , että veressä .
Maanpääisten kasvien kuiva -aine sisältää 0,15-0,50% fosforia ja nisäkkäiden, kuten ihmisten, noin 4%. Luiden ja hampaiden runko koostuu pääasiassa hydroksiapatiitista (Ca 5 (PO 4 ) 3 OH). 70 kg painavan ihmisen keho sisältää noin 700 grammaa fosforia, josta 600 g on lujasti sitoutunut.
Aikuisen päivittäinen tarve on noin 0,75 grammaa fosforia; Sitä on erityisen paljon maitotuotteissa, lihassa, kalassa ja leivässä. Fosfaatin saatavuus vaikuttaa usein kasveja rajoittavaan kasvutekijään, minkä vuoksi maataloudessa on käytettävä suuria määriä fosfaattia sisältävää lannoitetta.
Valkoinen fosfori ja fosforiyhdisteet, kuten fosfiini ja lukuisat fosforihappoesterit, ovat erittäin myrkyllisiä.
kasveja
Fosfori hoitaa kasveissa monia tärkeitä tehtäviä. Se on osa lipidejä ja siksi rakenteellinen elementti. DNA: ssa ja RNA: ssa se on silta kahden riboosin välillä . Kovalenttisesti sitoutunut adenosiiniin , se toimii yleisenä energiansiirtomuotona soluissa. Lisäksi fosfori vaikuttaa kasvien hiilihydraattitasapainoon, fotosynteesiin ja vesitasapainoon.
Jotta maaperässä oleva fosfori saataisiin aineenvaihduntaan, kasvien on vapautettava orgaanisesti tai epäorgaanisesti sitoutunut fosfori, jonka ne voivat absorboida H 2 PO 4 - . Sama koskee maaperässä eläviä mikro -organismeja ja sieniä. Monet mikro -organismit, sienet ja kasvit vapauttavat entsyymejä maaperään, jotka hydrolysoivat orgaaniset fosforihappoesterit ja vapauttavat siten epäorgaanista fosfaattia, jonka organismit voivat imeä ja metaboloida. Näitä entsyymejä kutsutaan fosfataaseiksi . Fosfataasin optimaalisesta pH -alueesta riippuen erotetaan happamat (pH 4–5) ja emäksiset fosfataasit. Jos kasvi absorboi enemmän fosfaattia kuin se voi käyttää lipideissä, nukleiinihapoissa ja sitoutuu adenosiiniin, se varastoi ylimäärän orgaanisesti sitoutuneena muodossa tyhjiöihin . Fosfataasit auttavat myös tässä vaiheessa muuttamaan fosfaatin takaisin epäorgaaniseksi vapaamuotoon.
Jos kasvit kärsivät fosfaatin puutteesta, niillä on erilaisia oireita. Lehtialueet pienenevät ja habitus vähenee kokonaisuudessaan; antosyaanien värjäytyminen voi ilmetä ja nekroosi voi kehittyä. Tärkkelyksen kertymisen vuoksi kloroplasteihin lehdet muuttuvat "jäykiksi". Kukkien, siementen ja hedelmien kehitys vähenee tai viivästyy. Koska fosfaatin puute ei vähennä klorofyllisynteesiä niin paljon kuin lehtien pinta -alan osuus pienenee, lehdissä tapahtuu hyperklorofylaatiota, joka ilmaistaan syvän vihreänä.
Koska fosfaattikonsentraatio on pienentynyt huomattavasti risosfäärissä , erityisesti 1-2 mm: n alueella juurien ympärillä, jotkut kasvit reagoivat fosfaatin puutteeseen lisääntyneellä juurikasvulla.
ekologia
Fosforisykli tai fosforisykli on bioelementin fosforin jatkuva kulkeutuminen ja biogeokemiallinen konversio vedessä, maaperässä ja biomassassa.
Koska fosfaatilla on keskeinen ekologinen merkitys, kvantitatiivisella fosforianalyysillä on tärkeä rooli myös veden ja maaperän kemiallisen seurannan käytännössä, esimerkiksi fosfaattikontaminaation (kohonnut fosfaattipitoisuus) määrittämisessä liiallisesti lannoitettujen maatalousalueiden vedessä alueella.
todiste
Spektroskooppisesti
Menetelmän valinta havaitsemiseksi fosforiyhdisteitä on 31 P- NMR- spektroskopialla. 31 P on ainoa luonnossa esiintyvä fosfori -isotooppi, ja sen ydin -spin -kvanttiluku on 1/2. Veteen verrattuna suhteellinen herkkyys on vain 6,6%. Resonanssi on n. 700 ppm (P 4 , esimerkiksi, on siirtymä -520 ppm). 85% fosforihappoa voidaan käyttää vakiona. Koska fosfori on spin 1/2 -ydin, spektrit voidaan arvioida erittäin hyvin. Jos myös vety irrotetaan, tuloksena on yleensä terävä signaali. Fosforin siirtyminen on vahvasti riippuvainen sen sitoutumiskumppanista, joten se soveltuu erittäin hyvin tunnettujen yhdisteiden tunnistamiseen. Tuntemattomien yhdisteiden osalta informatiivinen arvo on usein rajoitettu, koska yksi yhdisteluokka voidaan vain harvoin osoittaa yksinomaan spektrialalle.
| Johdannaiset kanssa | Kemiallinen muutos (δ ppm) |
|---|---|
| 3-merkkinen P | −180 - +200 |
| 4-merkkinen P | −120 - +130 |
| 5-merkkinen P | −100 - −20 |
| 6-merkkinen P | −220 - −130 |
Märkä kemikaali
Fosforin määrällinen ja laadullinen määritys tapahtuu fosfaatin ( tarkemmin sanottuna ortofosfaatti PO 4 3− ) kautta. Tätä tarkoitusta varten sitoutunut fosfori muutetaan tarvittaessa fosfaatiksi hapettamalla hajotus .
Laadullinen näyttö
Vuonna detektion kanssa natriummolybdaattia , keltainen liuos, jossa oli natrium molybdophosphate saadaan hapan liuos , väri reagenssi on valmistettu liuotettiin askorbiinihappoa on lisätty liuokseen ja kuumennettiin vesihauteessa. Tuloksena on molybdeenisininen , joka voidaan määrittää kvantitatiivisesti ja fotometrisesti.
Vuonna detektion kanssa ammoniumheptamolybdaattia , keltainen sakka on ammonium- molybdophosphate saadaan hapan liuos . Ottaen huomioon, että heptamolybdaatti saavuttaa tasapainon vesiliuoksessa:
seuraavat reaktioyhtälön tulokset:
Alkalisessa ammoniakin fosfaatin kuuluu läsnä ollessa magnesiumia - ionien kuten magnesiumammoniumfosfaattia alkaen:
Todiste voidaan suorittaa myös zirkoniumvetyfosfaatin muodossa :
Kuten monissa oppikirjoissa todetaan, muoto Zr 3 (PO 4 ) 4 on väärä; tämä yhdiste ei muodostu vesiliuoksissa!
Historiallisesti Mitscherlich -näyte on mielenkiintoinen valkoisen fosforin havaitsemiseksi, jota käytettiin pääasiassa epäillyssä fosforimyrkytyksessä. Mahan sisältö kuumennetaan vedellä, ja valkoinen fosfori, joka haihtuu vesihöyryn kanssa, tiivistyy ja palaessaan ilmakehän hapen kanssa syttyy ( kemiluminesenssi ).
Ja rakenteellisiin tutkimuksiin yhdisteitä, jotka sisältävät fosforia, 31 P- ydinmagneettista resonanssi-spektroskopia on sopiva .
Määrällinen näyttö
Gravimetria
Varten gravimetrinen määritys, keltainen molybdophosphate ioni voidaan muodostaa fosfaatti- ja molybdaatti-ioneja vahva kloorivetyhapon liuosta:
Jossa 8-hydroksikinoliinin ( kutsutaan HOX tai oksiinikupari ja lyhyt ), niukkaliukoisen sakan oksiinia-12-molybdo-1-fosfaatti on muodostettu, joka sitten kuivataan 160 ° C: ssa ja punnitaan vedettömässä muodossa.
- Sademuoto:
- Punnitusmuoto:
- (Väri: tummanoranssi)
Karkeasti kiteinen sakka sisältää vain 1,37% fosforia. Tämä tarkoittaa, että erityisesti pienemmät fosfaattimäärät voidaan helposti määrittää (katso mikromoolimenetelmä ).
Tilavuus
Volumetrinen fosfaatti määritykset ovat saostamalla La 3+ tai Bi 3+ - standardiliuokset ja sen jälkeen takaisin titraus kanssa EDTA suoritetaan.
Kolorimetria / fotometria
Pienten fosfaattipitoisuuksien määrittämiseksi makean veden näytteistä muodostuu syvän sininen antimoni-fosfori-molybdaattikompleksi, jonka voimakkaan värin saa vain pelkistävä aine, yleensä askorbiinihappo . Tämä mahdollistaa arkaluonteiset vedot n. 0,6 mg PO 4 / l (noin 0,2 mg P / l).
Menettely on standardoitu standardissa EN ISO 6878 (aiemmin EN 1189 tai DIN 38405 D11).
turvallisuusohjeet
Valkoinen fosfori
Valkoinen fosfori voi syttyä ilmassa, jos se on hienojakoista. Itsesyttymislämpötila on noin 34 ° C, mikä on suhteellisen lähellä huoneenlämpötilaa. Reaktio fosforipentoksidille on voimakkaasti eksoterminen . Myrkyllisiä fosfiineja voi muodostua veden ja alkalihydroksidien kanssa . Vahvat hapettimet reagoivat yleensä räjähdysmäisesti.
Fosforia sisältävien ammusten hävittäminen toisen maailmansodan jälkeen Itämeren matalille osille johtaa toistuvasti vakaviin vammoihin ja kuolemaan. Meripihkanväriset fosforipatukat huuhtoutuvat ja vaarantavat siten erityisesti kalastajat ja turistit. Tilastojen mukaan Itämerellä toisen maailmansodan jälkeen kuoli 168 ihmistä ampumatöihin ja 250 loukkaantui, osa vakavasti. Asiantuntijat olettavat nyt jopa, että luvut ovat huomattavasti suurempia.
Akuutti myrkytys valkoisella fosforilla ( fosforimyrkytys ) ilmenee ruoansulatuskanavan häiriöissä, maksavaurioissa, joilla on vakavia aineenvaihduntahäiriöitä, sekä sydämen ja munuaisten vaurioissa. Krooninen myrkytys, jopa pieninä määrinä, voi johtaa yleisiin hyvinvointihäiriöihin ja veren ja luiden vaurioitumiseen ( osteoporoosi ), erityisesti leukaan.
Valkoisen fosforin vähintään 15 mg: n annokset voivat aiheuttaa vakavia toksisia vaikutuksia. 50 mg: n (~ 1 mg / kg) määrät voivat olla tappavia .
Koulunkokeet valkoisella fosforilla, kuten fosforikellokokeet , eivät ole sallittuja uudempien määräysten mukaan; valkoista fosforia ei saa varastoida kouluissa sen vaarallisuuden vuoksi.
Muut muutokset
Muut tunnetut fosforin modifikaatiot ovat puhtaassa muodossaan myrkyttömiä, koska ne eivät liukene veteen ja heikkenevät. Ne syttyvät myös vain korkeammassa lämpötilassa (punainen fosfori vain 260 ° C: ssa).
linkkejä
Fosfori on erittäin reaktiivinen ja muodostaa kovalenttisia sidoksia suuren määrän muiden kuin metallien kanssa . Sitä esiintyy kaikissa hapettumistiloissa välillä -3 ja +5 ja koordinaatioluvuista 1-6, useimmiten 3-4. Hapetusluvut −3 ja +5 ovat edullisia.
Vetyyhdisteet
Fosfaanit (vanha nimi fosfiini ei ole enää IUPAC- yhteensopiva, mutta sitä käytetään lähes yksinomaan kemiallisessa kirjallisuudessa, erityisesti anglosaksisessa kirjallisuudessa) tarkoittavat kolmenarvoisen fosforin yhdisteitä vedyllä tai yhden tai useamman vetyatomin korvaamista orgaanisilla ryhmillä sitovina kumppaneina. Orgaaninen ryhmä on liitettävä suoraan fosforiatomiin rungon hiiliatomien kautta. Jos orgaaninen ryhmä on sitoutunut fosforiatomiin happiatomilla (eli yksikkö POC, esim. P (OPh) 3 ), puhutaan fosforihappoestereistä tai fosfiiteista .
Oksidit
Jossa happi , fosfori muodot erilaisia yhdisteitä, joilla on yleinen kaava P 4 O n (n = 6-10, 18), koska fosfori voi olla läsnä useissa hapetustiloissa. Sekä fosfori-happi-yksittäissidokset että kaksoissidokset sekä silta-fosfori-happi-fosforisidokset ovat mahdollisia.
Fosforioksidit muodostavat adamantaanin kaltaisia rakenteita:
- Fosforitrioksidi P 4 O 6 on valkoinen, pehmeä yhdiste, joka on erittäin myrkyllinen ja reaktiivinen ja reagoi nopeasti muodostaen fosforipentoksidia.
- Fosforitetraoksidi P 2 O 4 on oksidiseos. Se voidaan saada hapettamalla fosforitrioksidi hiilitetrakloridiksi .
- Fosforipentoksidi P 4 O 10 on tärkein fosforioksidi. Se on erittäin hygroskooppinen ja sitä käytetään kuivausaineena .
On myös muita fosforioksideja, joita ei voida eristää normaaleissa olosuhteissa. Näistä fosforimonoksidi PO on luultavasti yleisin fosforipitoinen molekyyli tähtienvälisissä pilvissä .
Oksihapot ja suolat
Näistä oksideista voidaan saada suuri määrä fosfori- happihappoja ja niitä vastaavia suoloja, joissa on yksi tai useampi fosforiatomi:
Fosforin hapetustaso |
Rakenteellinen kaava | Hapon nimi | Suolan nimi | |
|---|---|---|---|---|
| Monofosforihapot | ||||
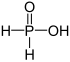
| + Minä | Fosfiinihappo | Fosfinaatit | ||
| + III | Fosfonihappo | Fosfonaatit | ||
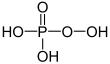
| + V | fosforihappo | Fosfaatit | ||
| + V | Peroksomonofosforihappo | Peroksomonofosfaatit | ||
| Difosforihapot | ||||
| + II | Hypodifosfonihappo | Hypodifosfonaatit | ||
| + III | Difosfonihappo | Difosfonaatit | ||
| + IV | Hypodifosforihappo | Hypodifosfaatit | ||
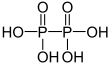
| + V | Difosforihappo | Difosfaatit | ||
| + V | Peroksodifosforihappo | Peroksodifosfaatit | ||
Näistä hapoista on myös rikkiä sisältäviä johdannaisia, esim. B. tiofosforihappo , jonka suoloja kutsutaan tiofosfaateiksi .
On myös useita fosforia mineraaleja , joista tärkeimpiä ovat hydroksiapatiitti ja fluoriapatiitin . Muita fosforimineraaleja löytyy kategoriasta: fosforimineraali .
Halogeeniyhdisteet
Fosfori muodostaa suuren määrän yhdisteitä fluorin , kloorin , bromin ja jodin halogenidien kanssa . Tärkeimmät liitäntätyypit ovat PX 3 , P 2 X 4 ja PX 5 . Fluoriyhdisteet ovat kaasumaisia, klooriyhdisteet ovat enimmäkseen nestemäisiä, bromi- ja jodiyhdisteet ovat kiinteitä. Monet fosforihalogeeniyhdisteet ovat myrkyllisiä. Kaikki yhdisteet ovat herkkiä hydrolyysille ja ne on suojattava kosteudelta varastoinnin aikana.
Esimerkkejä tämän luokan yhdisteistä ovat fosforitrikloridi , fosforipentakloridi , difosforitetrafluoridi ja fosforitriiodidi . Tunnetaan myös tyypin POX 3 happi- ja rikkihalogeeniyhdisteitä (esim. Fosforioksikloridi ) ja PSX 3 sekä polymeerioksidihalogenideja (POX) n . Fosforin halogenidit ovat ensimmäisiä ei-metallisia halogenideja, joita tutkijat, kuten Joseph Louis Gay-Lussac , Humphry Davy ja Pierre Louis Dulong , ovat tutkineet 1800-luvun alussa .
Muut epäorgaaniset yhdisteet
Fosfori ja rikki muodostavat useita fosforisulfideja, jotka rakenteeltaan z. T. muistuttavat fosfori- happiyhdisteitä . Rakenne on perustuu P 4 tetraedri, reunat ja kärjet tetraedrin ovat käytössä eri tavoin rikkiatomeja. Niillä on yleinen kaava P 4 S x (x = 3–10). Ne valmistetaan kuumentamalla punaista fosforia ja rikkiä sopivissa suhteissa. Näistä tärkein on fosforipentasulfidi (P 4 S 10 ). Tetrafosforitrisulfidia (P 4 S 3 ) käytetään edelleen osittain tulitikkujen sytytysmateriaalina . Myös seleeniyhdisteitä tunnetaan.
Typpi ja fosfori muodostavat nitridit, joiden koostumus on PN ja P 3 N 5 . Fosforinitriiliklorideja (fosforinitriilidikloridit) ei tunneta monomeerisessä tilassa. Niiden yleinen kaava (PNCl 2 ) x on rengas- tai ketjurakenne . Ne syntyvät reaktiosta ammoniumkloridin kanssa fosforipentakloridia ja kuuluvat ryhmään fosfatseenien, joilla on yleinen kaava (PNH 2 ) x . Polydikloorifosfatseenilla on ominaisuuksia, kuten synteettistä kumia , mutta se on epävakaa. Korvaamalla klooriatomit alkoksiryhmillä tai perfluoroalkoksiryhmillä saadaan kuitenkin kemiallisesti ja termisesti stabiileja polymeerejä, joilla on elastomeerisiä ominaisuuksia.
Orgaaniset yhdisteet

Orgaanisten fosforiyhdisteiden joukosta voidaan tehdä ero niiden välillä, joissa on fosfori-hiilisidos, ja niiden, joissa ei ole fosfori-hiilisidosta. Ensimmäisten joukossa on fosfiinijohdannaisia , joissa vetyatomit on korvattu yhdellä tai useammalla orgaanisella radikaalilla. Tähän ryhmään kuuluvat myös fosfiinioksidit (R 3 PO), alkyylifosfiinihapot (R 2 PO (OH)) ja alkyylifosfonihapot (R-PO (OH) 2 ) tai niiden suolat. Esimerkkejä toisen ryhmän esterit ja fosfiinihappoa , fosfonihappoa tai fosforihappo , jotka kutsutaan fosfiitit , fosfonaatit tai fosfaatteja . Orgaanisilla fosforiyhdisteillä - esimerkiksi trifenyylifosfiinilla , fenyylidikloorifosfiinilla tai fosforylideillä - on rooli monissa orgaanisissa reaktioissa, esim. B. Wittigin reaktiolla on tärkeä rooli.
Biokemiassa fosforihappoesterit ovat erityisen merkityksellisiä. Ne ovat tärkeä osa monia aineenvaihduntaprosesseja ja osa DNA: ta . Tärkeitä molekyylejä ovat:
kirjallisuus
- John Emsley: Fosfori - elämän ja kuoleman elementti . Weinheim 2001, ISBN 3-527-30421-5 .
- Harry H. Binder: Kemiallisten elementtien sanakirja - jaksollinen taulukko tosiasioissa, luvuissa ja tiedoissa . Hirzel, Stuttgart 1999, ISBN 3-7776-0736-3 .
- F. Krafft: Fosfori. Kevyestä aineesta kemialliseen elementtiin. Julkaisussa: Angewandte Chemie . 81 (17/18), 1969, s. 634-645; doi: 10.1002 / anie.19690811703 .
- Ludwig Maier: Fosforiyhdisteet ja niiden tekninen merkitys. Julkaisussa: Chemistry in our time . 9. vuosi, nro 4, 1975, s. 109-116; doi: 10.1002 / ciuz.19750090403 .
- Jochen Metzger: Fosforin aikapommi. Jos tämä raaka -aine loppuu, maailmanloppu uhkaa. Julkaisussa: PM of knowledge world. Nro 8, 2010, ISSN 1863-9313 , s.58-64 .
nettilinkit
- German Phosphorus Platform DPP eV - Verkosto fosforin talteenoton ja talteenotettujen tuotteiden kestävän käytön edistämiseksi
- CEEP-fosfaattisivusto TU-Darmstadtissa ja CEEP fosforin talteenottoa varten
- Fosforikriisi - ihmiskunnan loppu? Arten TV -dokumentti , toukokuu 2013, ohjaajat Christiane Schwarz ja Marcel Weingärtner
- Fosfaattivarannot Luento globaaleista varannoista, kaivostoiminnasta, kulutuksesta ja hintakehityksestä (PDF; 3,3 Mt)
Yksilöllisiä todisteita
- ↑ a b Harry H. Binder: Kemiallisten alkuaineiden sanakirja. Hirzel Verlag 1999, ISBN 3-7776-0736-3 .
- ↑ Ominaisuuksien arvot (tietoruutu) on otettu osoitteesta www.webelements.com (fosfori) , ellei toisin mainita .
- ^ IUPAC, Standard Atomic Weights Revised 2013 .
- ↑ a b c d e Entry on phosphorus in Kramida, A., Ralchenko, Yu., Reader, J. and NIST ASD Team (2019): NIST Atomic Spectra Database (versio 5.7.1) . Toim.: NIST , Gaithersburg, MD. doi : 10.18434/T4W30F ( https://physics.nist.gov/asd ). Haettu 11. kesäkuuta 2020.
- ↑ b c d e Merkintä fosfori on WebElements, https://www.webelements.com , pääsee 11. kesäkuuta, 2020 mennessä.
- ↑ b c d e f Merkintä tetraphosphorus (valkoinen fosfori) on GESTIS aine tietokanta IFA , näytetty 9. elokuuta, 2016. (JavaScript vaaditaan)
- ↑ b c d Merkintä fosfori, punainen että GESTIS aine tietokanta IFA , näytetty 9. elokuuta, 2016. (JavaScript vaaditaan)
- ^ AF Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 102 painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s.747.
- ↑ a b David R. Lide (toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, s. 4-142-4-147. Siellä olevat arvot perustuvat g / mol ja ne on annettu cgs -yksiköissä. Tässä määritetty arvo on siitä laskettu SI -arvo ilman mittayksikköä.
- ↑ a b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Korjatut arvot kiehumispisteille ja käsikirjojen elementtien höyrystymisen entalpioille. Julkaisussa: Journal of Chemical & Engineering Data. 56, 2011, s. 328-337, doi: 10.1021 / je1011086 .
- ↑ Merkintä puna / valkoinen fosfori on luokitusten ja merkintöjen luetteloon on Euroopan kemikaaliviraston (ECHA), pääsee 14. joulukuuta 2016. Valmistajien ja jälleenmyyjien voi laajentaa yhdenmukaistettuun luokitukseen ja merkintöihin .
- ↑ Sveitsin tapaturmavakuutusrahasto (Suva): Raja-arvot-nykyiset MAK- ja BAT-arvot (haku 12185-10-3 tai fosforivalkoinen / keltainen ), saatavana 2. marraskuuta 2015.
- ^ A b Kansallinen tekninen tietopalvelu. Vuosikerta AD-B011-150.
- ↑ b c d Merkintä Fosfori on ChemIDplus tietokantaan Yhdysvaltain National Library of Medicine (NLM)
- ^ Torjunta -aineiden kemikaalien virallinen kokoelma. Association of the American Pesticide Control Officials, Inc., 1966, s.901.
- ↑ American Heart Journal . Vuosikerta 84, 1972, s. 139.
- ^ Sisätautien arkistot . Vuosikerta 83, 1949, s.164.
- ^ Alphons Oppenheim: Tuotemerkki, Hennig . Julkaisussa: Allgemeine Deutsche Biographie (ADB). Osa 3, Duncker & Humblot, Leipzig 1876, s.236.
- ↑ Alexander P.Hardt: Pyrotekniikka. Pyrotechnica Publications, Post Falls, Idaho, 2001, ISBN 0-929388-06-2 , s. 74 ja sitä seuraavat sivut.
- ^ Mary Weeks, Discovery of the elements, Journal of Chemical Education 1956, s.135.
- ^ Schrötter, New Modification of Phosphorus , Liebigs Annalen der Chemie, osa 68, 1848, s.247-253
- ↑ Anton Schrötter: Tietoja uudesta allotrooppisesta fosforin tilasta . Julkaisussa: JC Poggendorff (Toim.): Annals of Physics and Chemistry, kolmas sarja . 157 (Pogg. Ann. 81), nro. 10 . Johann Ambrosius Barth, 1850, ISSN 1521-3889 , s. 276–298 , doi : 10.1002 / andp.18501571009 ( verkossa osoitteessa Gallica Bibliothèque nationale de France ).
- ↑ W.Hittorf, Fosforin tuntemuksesta , Annalen der Physik, osa 202, 1865, s.
- ↑ Bridgman, Kaksi uutta muunnosta fosforista , Journal of the American Chemical Society, nide 36, 1914, s. 1344-1363.
- ^ A b A. F. Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 91. - 100. parannettu ja laajennettu painos. Walter de Gruyter, Berliini 1985, ISBN 3-11-007511-3 , s. 928-931.
- ↑ "Fosforin ehtyminen: bakteerihapon generaattorit - hallitsijat elämän ja kuoleman yli?" (Schattenblick, 15. huhtikuuta 2008).
- ↑ ” Maapallon fosfaattivarat, jotka ovat lannoitteiden ensisijainen ainesosa, voivat loppua seuraavien 50–130 vuoden aikana ”, julkaisussa: Kukkiva jäte, Website University of Technology, Sydney , 6. marraskuuta 2006; Vaihtoehtoisesti: ” Nykyisten taloudellisesti hyödynnettävien varantojen ehtymisen arvioidaan olevan 60–130 vuotta. Keskimääräisten varantojen arvioiden ja kohtuullisten ennusteiden perusteella näyttää siltä, että fosfaattivarat kestävät vähintään 100+ vuotta ”. Arne Haarr, EUREAU (European Union of National Association of Water Suppliers and Waste Water Services): The Reuse of Phosphorus .
- ↑ Liittovaltion hallituksen vastaus parlamentin jäsenten Cornelia Behmin, Friedrich Ostendorffin, Dorothea Steinerin, muiden kansanedustajien ja liittoutuman 90 / The Greensin parlamentaarisen ryhmän, Saksan liittopäivä, 15. joulukuuta 2012, vähäiseen kysymykseen, luettu 27. elokuuta 2019.
- ↑ Fosfaatti USGS Mineral Resourcesissa .
- ↑ M. Okrusch, S. Matthes: Mineralogie: Johdatus erityiseen mineralogiaan, petrologiaan ja talletustieteeseen. 7. painos. Springer, 2005, ISBN 3-540-23812-3 .
- ↑ Tiedote Zürichin kantonin rakennusosastolta: Jätevesilietteen muuttaminen raaka -aineeksi: Uusi prosessi soveltuu teolliseen tuotantoon. 3. kesäkuuta 2019, käytetty 14. lokakuuta 2019 .
- ↑ Odenwaldin maailmankaikkeus: Tarkoittaako fosforin puute ihmiskunnan loppua? on: focus.de , 9. toukokuuta 2008.
- ↑ Dietmar Kunath: fosfori. Teoksessa: Claus Schaefer, Torsten Schröer (Hrsg.): Aquaristicsin suuri sanasto. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9 , s.772 .
- ^ A. Matthew et ai.: Todisteita reaktiivisista vähentyneistä fosforilajeista Arkean valtameren alussa. Julkaisussa: PNAS. 110 (25), 2013, s. 10089-10094. PMID 23733935 ; pdf (ilmainen koko tekstin käyttö)
- ↑ Tähtitieteilijät paljastavat tähtienvälisen säikeen yhdestä elämän rakennuspalikosta (en) . Lähde : phys.org . Haettu 28. syyskuuta 2020.
- ↑ Komeetat toivat fosforin - elämän rakennuspalikan - maahan (de) . 20. tammikuuta 2020. Käytetty 28. syyskuuta 2020.
- ↑ VM Rivilla, MN Drozdovskaya, K.Altwegg, P.Caselli, MT Beltrán, F.Fontani, FFS van der Tak, R.Cesaroni, A.Vasyunin, M.Rubin, F.Lique, S.Marinakis, L.Testi , ROSINA-tiimi: ALMA- ja ROSINA-fosforipitoisten molekyylien havainnot: tähtienvälinen säie tähtien muodostavien alueiden ja komeettojen välillä . Julkaisussa: Monthly Notices of the Royal Astronomical Society . 11. helmikuuta 2020, s. 1180–1198. arxiv : 1911.11647 . doi : 10.1093 / mnras / stz3336 .
- ↑ Pääsy fosforiin. Julkaisussa: Römpp Online . Georg Thieme Verlag, käytetty 13. tammikuuta 2015.
- ^ Soda Springs. ( Muisto 24. heinäkuuta 2016 Internet -arkistossa ) osoitteessa: monsanto.com
- ↑ Liittovaltion sopimussivusto paljastaa Yhdysvaltojen luottavan Monsantoon ja israelilaiseen yritykseen valkoisen fosforin saannissa , 7. helmikuuta 2013.
- ↑ Horst Briehl: Materiaalien kemia . Springer-Verlag, 2014, ISBN 978-3-658-06225-5 , s. 24 ( rajoitettu esikatselu Google -teoshaussa).
- ↑ Ralf Steudel : Ei-metallien kemia rakenteesta ja sidoksesta sovellukseen . Walter de Gruyter, 2008, ISBN 978-3-11-021128-3 , s. 360 ( rajoitettu esikatselu Google -teoshaussa).
- ↑ Brandi M.Cossairt, Christopher C.Cummins, Ashley R.Head, Dennis L.Lichtenberger, Raphael JF Berger, SA Hayes, NW Mitzel, G.Wu,: AsP 3: n ja P 4 : n molekyyli- ja elektronirakenteista . Julkaisussa: Journal of the American Chemical Society . nauha 132 , ei. 24 , 23. kesäkuuta 2010, ISSN 0002-7863 , s. 8459-8465 , doi : 10.1021 / ja102580d ( acs.org [käytetty 3. heinäkuuta 2020]).
- ↑ Alfons Klemenc: Epäorgaaninen kemia fysikaalis-kemiallisella perusteella . Springer-Verlag, 2013, ISBN 978-3-7091-7793-8 , s. 202 ( rajoitettu esikatselu Google -teoshaussa).
- ↑ Stefanie Ortanderl, Ulf Ritgen: Kemia nukkeille . Oppikirja . John Wiley & Sons, 2014, ISBN 978-3-527-70924-3 , s. 541 ( rajoitettu esikatselu Google -teoshaussa).
- ^ Dietrich Wertz: Luminesenssi . dipl.de, 2004, ISBN 3-8324-8284-9 , s. 29 ( rajoitettu esikatselu Google -teoshaussa).
- ↑ retro; ruokalappu - Sivu apteekkikirjan käsikirjasta : tuhoeläinlääkkeet.
- ↑ J. Sedlmeyer: Tietoja fosforimyrkytyksestä. Julkaisussa: Saksan aikakauslehti kaikista oikeuslääketieteistä. Nide 19, nro 1, joulukuu 1932, s. 365-383; ( doi: 10.1007 / BF01750213 ).
- ↑ Esite BK nro 1109: Fosforin tai sen epäorgaanisten yhdisteiden aiheuttamat sairaudet , BMA -ilmoitus 25. helmikuuta 1981, BArbBl Heft 4/1981.
- ↑ Kuinka kuparisulfaattiliuos toimii puhdistaessaan valkoista fosforia. osoitteessa: www.chemieunterricht.de .
- ↑ Stefan Lange, Peer Schmidt, Tom Nilges: Au 3 SnP 7 @Black Phosphorus: An Easy Access to Black Phosphorus. Julkaisussa: Inorg. Chem. 46 (10), 2007, s. 4028-4035; doi: 10.1021 / ic062192q .
- ↑ G. Brauer (toim.): Handbook of Preparative Inorganic Chemistry. 2. painos. Voi. 1, Academic Press 1963, s. 518-525.
- ↑ Perusteet ja pääryhmän osat Osa 1: Perusteet ja pääryhmän elementit . Walter de Gruyter GmbH & Co KG, 2016, ISBN 3-11-049585-6 , s. 852 ( rajoitettu esikatselu Google -teoshaussa).
- ↑ H. Thurn, H. Krebs: Tietoja puolimetallien rakenteesta ja ominaisuuksista. XXII. Hittorfin fosforin kiderakenne. Julkaisussa: Acta Cryst. B25, 1969, s. 125-135.
- ↑ H. Thurn: Hittorfin fosforin kiderakenne. Väitöskirja . Stuttgartin teknillinen yliopisto, 1967.
- ↑ Arno Pfitzner, Michael F. Bräu, Josef Zweck, Gunther Brunklaus, Hellmut Eckert: Phosphorus Nanorods - Two Allotropic Modifications of a long -known Element. Julkaisussa: Angew. Chem. Int. Ed. 43, 2004, s. 4228-4231; doi: 10.1002 / anie.200460244 .
- ↑ E.-C. Koch: Pyrotekniikan erikoismateriaalit: IV. Fosforin ja sen yhdisteiden kemia. Julkaisussa: J. Pyrotech. 21, 2005, s.39; Tiivistelmä .
- ↑ E.-C. Koch: Pyrotekniikan erikoismateriaalit: V. Fosforin ja sen yhdisteiden sotilaalliset sovellukset. Julkaisussa: Propellants Explos. Pyrotech. 33, 2008, s. 165; doi: 10.1002 / prep.200700212 .
- ↑ Dietmar Kunath: Fosfori. Teoksessa: Claus Schaefer, Torsten Schröer (Hrsg.): Aquaristicsin suuri sanasto. 2 osaa. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9 , 772.
- ↑ Emanuel Epstein: Piin anomalia kasvibiologiassa. Julkaisussa: Proc. Natl. Acad. Sei. USA 91, 1994, s. 11; doi: 10.1073 / pnas.91.1.11 .
- ↑ Lincoln Taiz, Eduardo Zeiger: Kasvien fysiologia. Spectrum, Akad. Verlag, Heidelberg / Berliini 1998, ISBN 3-8274-0537-8 .
- ↑ K. Mengel: Kasvin ravitsemus ja aineenvaihdunta. Gustav Fischer Verlag, Jena 1991, s. 324–334.
- ↑ Ammusten jäänteet : kranaatit Itämerellä. ( Memento of Maaliskuu 14, 2008 Internet Archive ) on: sueddeutsche.de tammikuuta 9, 2008.
- ↑ Ammusten jäännökset Itämerellä. "Viranomaiset eivät osoita kiinnostusta". on: sueddeutsche.de , 8. tammikuuta 2008.
- ↑ Stefan Nehring: Ammusonnettomuudet - eikä loppua. osoitteessa: travemuende-aktuell.de , 2015.
- ↑ DGUV.de: BGR / GUV-SR 2003 Opetus kouluissa, joissa on vaarallisia aineita (online-versio; PDF-tiedosto; 9,52 MB), s. 24, katsottu 25. huhtikuuta 2011.
- ^ A b Nils Wiberg, Egon Wiberg, Arnold Frederik Hollemann: Inorganische Chemie . Osa 1: Perusteet ja pääryhmän elementit. 103. painos. De Gruyter, Berliini, Boston 2017, ISBN 978-3-11-051854-2 , s. 783 ff . (pääsee De Gruyter Online -palvelun kautta)
























![{\ displaystyle {\ ce {PO4 ^ 3- + 12MoO4 ^ 2- + 24H3O + + 3NH4 + <=> (NH4) 3 [P (Mo3O10) 4] + 36 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb26219c3cab9f7c0612f33ef53af1422e1214ff)


![{\ displaystyle {\ ce {H2PO4- + 12 [MoO2Cl3 (H2O)] + 26 H2O-> [P (Mo3O10) 4] ^ 3- + 26 H3O + + 36Cl-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6363079e9a055be6d511005c74fb931ca9f8abd5)
![{\ displaystyle {\ ce {[P (Mo3O10) 4] ^ 3- + 3HOx + 3H3O + -> (H2Ox) 3 [P (Mo3O10) 4] + 3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3f23c5ca64a72c9d6438fce291f757851636270c)
![\ mathrm {(H_2Ox) _3 [P (Mo_3O_ {10}) _ 4] \ cdot x \ H_2O}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b4a4ac6f7c69607fc6cb08462cc8acb0da733f77)
![\ mathrm {(H_2Ox) _3 [P (Mo_3O_ {10}) _ 4]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4015e1b4d1a83dc0b2c857e26fa6cdef99a7a9da)