seleeni
| ominaisuudet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Yleisesti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nimi , symboli , atominumero | Seleeni, Se, 34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementtiluokka | Puolimetallit | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ryhmä , piste , lohko | 16 , 4 , s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ulkomuoto | harmaa, kiiltävä | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS -numero | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EY -numero | 231-957-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA InfoCard | 100,029,052 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massiivinen osa maan verhosta | 0,8 ppm taajuus # 59 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomimassa | 78 971 (8) et ai | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomisäde (laskettu) | 115 (103) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenttinen säde | 120 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsin säde | 190 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronikonfiguraatio | [ Ar ] 3 d 10 4 s 2 4 p 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisointienergia | 9.752 392 (15) eV ≈ 940.96 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisointienergia | 21.196 (10) eV ≈ 2 045.1 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisointienergia | 31.697 (19) eV ≈ 3 058.3 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisointienergia | 42.947 (3) eV ≈ 4 143.8 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisointienergia | 68.30 (10) eV ≈ 6 589.9 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. Ionisointienergia | 81.83 (3) eV ≈ 7 895 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyysisesti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyysinen tila | kiinteä | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| tiheys | musta 60 ° C: 4,28 g / cm 3 harmaa 25 ° C: 4,819 g / cm 3 punainen 25 ° C: 4,48 g / cm 3 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohsin kovuus | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismi | diamagneettinen ( Χ m = −1,9 10 −5 ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sulamispiste | 494 K (221 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| kiehumispiste | 958,2 K (685 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molaarinen tilavuus | 16.42 · 10 −6 m 3 · mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Haihtumislämpö | 95,5 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fuusion lämpö | 5,4 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Äänen nopeus | 3350 m s −1 293,15 K. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Työtoiminto | 5,9 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lämmönjohtokyky | 0,52 W m −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiallisesti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hapettumistilat | ± 2, 4 , 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normaali potentiaali | −0,67 V (Se + 2 e - → Se 2− ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatiivisuus | 2,55 ( Paulingin asteikko ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotoopit | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Katso muut isotoopit isotooppiluettelosta | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR -ominaisuudet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| turvallisuusohjeet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
SI -yksiköitä käytetään mahdollisuuksien mukaan ja tavanomaisesti . Ellei toisin mainita, annetut tiedot koskevat vakio -olosuhteita . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Seleeni ( zeˈleːn , kreikan σελήνη [selḗnē], " kuu ") on kemiallinen alkuaine , jonka alkuaine on Se ja atomiluku 34. Jaksollisessa taulukossa se kuuluu neljännelle jaksolle ja kuudennelle pääryhmälle tai 16. IUPAC -ryhmälle. ja on yksi kalkogeeneista .
Seleeni on epämetalli, sen ominaisuudet ovat samanlaiset kuin rikin ja telluurin ominaisuudet. Se muodostaa useita polymorfisia ja allotrooppisia modifikaatioita, joista harmaa, metallimainen muoto on vakain. Sitä esiintyy enimmäkseen metallisulfidimalmeissa, joissa se korvaa osittain rikin, harvoin alkuaineessa tai puhtaana malmiyhdisteenä. Ruotsalainen lääkäri ja kemisti Jöns Jacob Berzelius löysi seleenin vuonna 1817. Seleeniä hankitaan kaupallisesti metallimalmien käsittelyssä. Teknisesti sitä käytetään lasin valmistuksessa , pigmenttien ja valokennojen valmistuksessa . Sitä käytettiin elektronisten komponenttien valmistukseen.
Seleeni on ihmiselle välttämätön hivenaine ja muun muassa osa antioksidanttista glutationiperoksidaasientsyymiä . Raja aliravitsemuksen ja myrkyllisten seleenien välillä on hyvin pieni, mikä edellyttää saannin huolellista hallintaa. Sekä alkuaine seleeni että seleenisuolat voivat olla myrkyllisiä jopa pieninä annoksina ja aiheuttaa selenoosia .
tarina

Seleeni löydettiin vuonna 1817 Jöns Jakob Berzelius on johtaa kammion lietteessä hänen rikkihapon tehtaan lähellä Gripsholmissa . Falunin kaivoksesta siellä käytetty pyriitti muodosti punaisen sakan lyijykammioihin, joiden Berzelius oletti aluksi olevan arseeniyhdiste . Poltettaessa sakasta muodostui kuitenkin voimakas retiisin tuoksu , joka ei ole tyypillistä arseenille, mutta ominaista telluurille , joka on nimetty latinalaisen telluksen 'maan' mukaan , johon seleenillä on joitain yhtäläisyyksiä.
Kirjeessä Alexander Marcetille Berzelius mainitsi löytäneensä telluuriyhdisteen. Mutta telluuriyhdisteiden puute Falunin kaivoksen mineraaleissa sai Berzeliusin analysoimaan punaisen sakan uudelleen. Vuonna 1818 Berzelius päätti osana kokeitaan, että se oli uusi elementti. Hän kirjoitti Marcetille toisen kirjeen, jossa hän kuvaili äskettäin löydettyä elementtiä, joka muistutti rikkiä ja telluuria. Osoittaakseen samankaltaisuuden telluurin kanssa hän nimesi sen seleeniksi kreikkalaisen kuujumalattaren Selenen mukaan .
Vuonna 1873 Willoughby Smith havaitsi, että harmaan seleenin sähköinen vastus liittyi altistumiseen. Tämä mahdollistaa seleenin käytön valokennoissa . Werner von Siemens kehitti ensimmäiset kaupalliset seleeniä sisältävät valokennot 1870-luvun puolivälissä , joiden johtavuus auringonvalossa oli 14,8 kertaa suurempi kuin ilman valaistusta. Alexander Graham Bell kehitti ns. Valopuhelimen vuonna 1878 . Valo kohdistettiin peiliin, jota megafoni värähti . Megafonin värähtelyt välitettiin peilin kautta, valo lähetettiin vastaanottojärjestelmään, joka koostui valokuvaelementistä, akusta ja puhelimesta. Vaikka se oli ensimmäinen langaton puhelinjärjestelmä, järjestelmä ei saanut mitään merkitystä.
Vuodesta 1910, August von Wassermann tutkittu kemoterapia hiiren karsinoomien ja sarkoomat . Eosin Y: n ja seleenin tarkkaan määrittelemättömän komponentin injektio verenkiertoon johti aluksi kasvainsolujen nekroosiin ja lopulta sairaiden elinten paranemiseen. Toisaalta yritykset tuumorihoidolle ihmisillä natriumselenaatilla johtivat yliannostukseen liittyviin kuolemiin. Tutkimus seleenin tehokkuudesta kasvainhoidossa kärsi jälleen takaiskuista, kun Great Plainsilla tapahtui lampaiden ja lehmien massamyrkytys syömällä tragakanttilajeja 1930 -luvulla , jolloin noin 15 000 lammasta myrkytettiin seleenillä.
Vuonna 1954, Jane Pinsent havaitsivat, että sen lisäksi jälkiä molybdaatit , seleeni on myös olennaista muodostumista formiaattidehydrogenaasia on kolibakteereja . Seleeniä koskeva tutkimus sai uuden sysäyksen, kun Klaus Schwarzin johtama tutkimusryhmä havaitsi vuonna 1957, että seleeni estää maksan nekroottista rappeutumista ja on välttämätön hivenaine.
Esiintyminen
Maalliset tapahtumat
Maaperän seleenipitoisuus on välillä 0,01 - 2,0 milligrammaa kilogrammaa kohden ja keskimäärin noin 0,4 milligrammaa kilogrammaa kohden. Paikallisesti esiintyy paljon korkeampia pitoisuuksia, jopa 1200 milligrammaa kilogrammaa kohden. Alkuperäisen geologian lisäksi luonnolliset lähteet, kuten tulivuorenpurkaukset tai ihmisen aiheuttamat lähteet, kuten hiilen polttaminen, voivat johtaa seleenin kertymiseen.
Kivihiilen seleenipitoisuus on keskimäärin noin 1,6 ppm ja ruskohiilen noin 1 ppm. Pitoisuus on tuhka on kasvanut kertoimella 6-8. Seleeniä esiintyy hiileissä sekä orgaanisesti sitoutuneina että epäorgaanisina, esimerkiksi seleenidinä klaustaliitin muodossa. Osa siitä on liuotettavaa selenaattimuotoa ja osa isomorfista korvaamalla rikkiä pyriitissä.
Troposfäärin seleenipitoisuuden arvioidaan olevan noin 13-19 000 tonnia. Noin 60% näistä on peräisin luonnollisista lähteistä, kuten meribiosfääristä; suurin ihmisen aiheuttama lähde on hiilen polttaminen . Päästöt näyttävät olevan pääasiassa kaasumaisia.
Koska olennainen hivenaine, seleeni on osa 21. biogeenisen aminohapon selenokysteiini . Selenokysteiini on seleeniriippuvaisten entsyymien spesifinen katalyyttinen komponentti . Hiivassa ja kasveissa seleeniä esiintyy pääasiassa selenometioniinina . Selenometioniini metioniinin sijasta sisällytetty epäspesifisesti moniin proteiineihin ilman mitään toimintoa; sitä pidetään seleenin säilytysmuodona. Muita luonnossa esiintyviä organoseleniumyhdisteitä ovat dimetyyliselenidi ja metyyliselenokysteiini .
Ruoan seleenimäärä riippuu suuresti maaperän seleenipitoisuudesta. Euroopassa seleenipitoista maaperää esiintyy erityisesti Saksassa, Skotlannissa, Tanskassa, Suomessa, osassa Balkanin maita ja Sveitsissä. Joillakin seleeniä köyhillä alueilla maaperään lisätään selenaattia sisältäviä lannoitteita, esimerkiksi Suomessa vuodesta 1984. Seleenipitoisissa maaperissä traganttilajit , kaalit tai valkosipuli keräävät seleeniä metyyliselenokysteiininä . Astragalus Bisulcatuksen kuiva -aine sisältää seleeniä jopa 0,65%. Tunnettu seleenin lähde elintarvikkeiden joukossa on Brasilian pähkinä . Yhden brasilialaisen pähkinän seleenipitoisuus on noin 50 mikrogrammaa seleeniä.
Maan ulkopuoliset tapahtumat
Kuun basalttien seleenipitoisuus vastaa suunnilleen maanpäällisiä arvoja, mutta isotooppikoostumus siirtyy kohti raskaampia seleeni -isotooppeja. Seleeni muiden elementtien lisäksi löydettiin lähellä UV -spektri vähämetallisista tähdet HD 108317 ja HD 128279 käyttäen Goddard High Resolution Spectro- on Hubble-avaruusteleskoopin . Seleeni, useimmiten liittyy rikki, on havaittu in meteoriittejä .
Seleeni mineraalina
Alkuaineena olevan seleenin esiintyminen luonnossa oli tiedossa jo ennen IMA: n ( International Mineralogical Association ) perustamista. Näin ollen seleeni on tunnustettu suojattu , niin sanottu aiemmin saavutettuihin mineraali , itsenäisenä mineraali tyyppi. Charles Palache löysi ja kuvaili alkuperäisen seleenin ensimmäisen kerran vuonna 1934 . Tyyppi paikkakunnalla on Yhdistyneessä Verden Mine lähellä Jerome Yhdysvalloissa Arizonan osavaltiossa.
Mukaan systematiikkaa mineraaleja mukaan Strunz (9. painos) , seleeni on alle järjestelmän numero 1.CC.10 (elementtejä - puolimetallien (metalloidit) ja ei-metallit - rikki-seleeni-jodi - seleeni ryhmä) tai vanhentunut 8. painos , I / B.03 (rikki- seleeniryhmä ). Mineraalien järjestelmällisyys Danan mukaan , jota käytetään pääasiassa englanninkielisissä maissa , luettelee mineraalialkuaineen järjestelmän nro. 01.03.04.01 (elementit-puolimetallit ja ei-metallit).
Seleeni muodostaa mineraalina harvoin hyviä kiteitä , joiden koko voi olla jopa kaksi senttimetriä. Niiden habitus on yleensä neulamainen tai putkimainen ja toisinaan ontto. Usein kiteet muodostavat myös lehtiryhmiä tai mattoja. Koska metallin seleeni on normaalisti läpinäkymätön ( läpinäkymätön ), mutta se voi olla läpinäkyvää hyvin ohuissa lohkoissa. Siistiä seleeniä löytyy harvoin. Vuonna 2021 maailmanlaajuisesti dokumentoitiin vain noin 160 esiintymistä natiivista seleenistä.
Myös seleenimineraalit, kuten klaustaliitti ( seleenijohde , PbSe) ja naumanniitti ( seleenihopea , Ag 2 Se) ovat harvinaisia. Kaksi rautaselenidimuunnosta, dzharkeniitti ja ferroseliitti (FeSe 2 ), sisältävät eniten seleeniä, kumpikin lähes 74 painoprosenttia Se . Vuonna 2021 tiedettiin yhteensä 127 ja 270 seleeniä sisältävää mineraalia lähteestä riippuen.
Maaperä sisältää usein seleeniä liukoisissa muodoissa, kuten selenaatteja , jotka pestään helposti pois. Merivesi sisältää merkittäviä määriä seleeniä.
Seleeni hiekkakivessä uraanikaivoksesta lähellä Grantsia , New Mexico
Tummanharmaat kiiltävät seleenikiteet matriisissa Lichtenbergin rikastusjätteestä, Ronneburg (Thüringen) , näkökenttä 5 mm
Klaustaliitti Brummerjanin kaivoksesta, Zorge (Walkenried) , Ala -Saksi , Saksa (näkökenttä 1,5 cm)
Ferroseliitti El Quemadosta, General Lamadrid Department , La Rioja , Argentiina
Poiminta ja esittely
Alkuaine seleeni
Seleeni löytyy useimmiten muodossa metallin selenidit , kuten kumppani rikkiä sisältävien malmien metallien kuparin , lyijyn , sinkin , kulta ja rauta . Teollisuudessa seleeniä saadaan sivutuotteena elektrolyyttisessä kuparin ja nikkelin valmistuksessa anodilietteestä paahtamalla. Kun paahtamalla malmi , yritys kerääntyy seleenidioksidia loppupään märkäpesurissa. Myös absorboitu rikkidioksidi muuttuu pelkistyneeksi metalliseksi seleeniksi ja muodostuu rikkihappoa.
Saostunut seleeni suodatetaan pois ja puhdistetaan sitten tyhjötislauksella noin 280 ° C: ssa tyhjössä.
Laboratoriomittakaavassa seleeniä voidaan valmistaa seleenisen hapon ja vetyjodidin välisellä reaktiolla .
Tunnettujen tuottajamaiden kokonaistuotanto oli 2900 tonnia vuonna 2020, hinta samana vuonna oli noin 44 Yhdysvaltain dollaria kilolta. Varantojen arvioidaan olevan noin 100 000 tonnia. Seleenin uuttaminen hiilen lentotuhkasta on teknisesti mahdollista, mutta sitä ei suoriteta korkeiden kustannusten vuoksi. Pieni osa seleenistä saadaan elektronisten ja kopiokoneiden osien kierrätyksestä .
Selenometioniini
In food ravintolisät ja rehuissa (hyväksytty eläinten ruokinnassa EU: ssa vuodesta toukokuu 2005), orgaaninen seleeni lähde on käytetty joitakin vuosia, joka saadaan jalostukseen tiettyjä panimo hiivat Saccharomyces cerevisiae tyyppi ( Sel-Plex , Lalmin TM ) tuotetaan ravintoaineella, joka sisältää runsaasti seleeniä ( melassia ja natriumseleniittiä ). Hiivat syntetisoimiseksi korkea selenometioniinin kuin aminohappo ja siten sitoa 2000 ppm seleeniä orgaanisessa tavalla. Suurin tällaisten luonnon seleenihiivojen tuotantolaitos rakennettiin vuonna 2004 São Pedroon Brasilian Paranán osavaltioon .
ominaisuudet
Fyysiset ominaisuudet
Seleeni esiintyy kiteisessä muodossa yhdessä harmaassa, kolmessa punaisessa ja yhdessä mustassa allotrooppisessa muunnoksessa; kolme punaista kiteistä modifikaatiota ovat polymorfisia . Lisäksi se esiintyy mustana seleeninä amorfisessa faasissa, joka lämpötilan noustessa noin 80 ° C: seen muuttuu mustaksi lasimaiseksi faasiksi, joka muodostuu myös, kun seleeni sammutetaan huoneenlämpötilaan. Musta seleeni on hauras, kiiltävä kiinteä aine, joka liukenee heikosti hiilidisulfidiin. Tämä vaihe muuttuu muoviseksi yli 50 ° C: n lämpötiloissa. Vaiheet, joissa on kuuden ja seitsemän jäsenen renkaat, voidaan syntetisoida. Nämä eivät kuitenkaan ole kestäviä ja muuttuvat nopeasti muiksi muodoiksi.
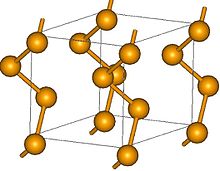
Normaaleissa olosuhteissa vain harmaa muutos on vakaa, muut ovat metastabiileja ja muuttuvat ajan mittaan harmaaksi seleeniksi. Siinä on kuusikulmainen kidehila ja se toimii kuin puolimetalli , jolla on puolijohdeominaisuuksia . Se koostuu kierteisesti järjestetyistä ketjuista, joissa on kolminkertainen ruuviakseli ja Se-Se-kulmat 103 °. Kristallin sisällä ketjuilla on tasainen ruuvaussuunta. Harmaan seleenin yksittäiset kiteet ovat siksi optisesti aktiivisia ja muodostavat enantiomeerejä . Toisin kuin muut allotroopit, se ei liukene hiilidisulfidiin . Harmaa seleeni on huono sähköjohdin, ja halogenidien saastuminen tai valolle altistuminen lisää johtavuutta .
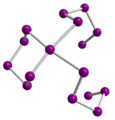
Kaksi punaisesta modifikaatiosta kiteytyy monokliinisesti . Niitä kutsutaan α- ja β-seleeniksi ja ne eroavat akselipituuksiltaan. Ne on valmistettu mustasta seleenistä uuttamalla hiilidisulfidilla. Vaihtamalla liuottimen haihtumisnopeutta kaksi faasia voidaan tuottaa kohdennetulla tavalla. Y-seleeniksi kutsuttu muoto, joka saadaan kiteyttämällä Dipiperidinotetraselan- liuoksesta hiilidisulfidissa, kiteytyy myös monokliinisesti, avaruuden ryhmässä P 2 1 / c . Punainen seleeni, joka on liukoinen on rikkihiili, koostuu noin 30% taitettu Se 8 renkaat ja 70% Se 8 + n , joka muuntaa harmaa seleeni paineessa, lämpötiloissa yli 120 ° C: ssa tai, kun läsnä on katalyytti . Se 8 -renkaissa Se-Se-etäisyys on 233,5 pikometriä ja Se-Se-Se-kulma 105,7 °. Amorfinen punainen muunnos luodaan sammuttamalla sula seleeni. Alkuaine punainen seleeni on eriste.
220 ° C: n sulamispisteen yläpuolella seleeni muodostaa mustan nesteen. Lämpötilan noustessa edelleen syntyvä seleenihöyry on keltaista. Kun se kerrostetaan höyryfaasista viileämmälle pinnalle, se kerrostetaan kuusikulmaisten, metallinharmaiden kideneulojen muodossa.
Valolle altistuminen muuttaa sen sähkönjohtavuutta. Kaistaero seleeni on noin 1,74 elektroni volttia , rajalla näkyvän valon ja infrapuna. Lisäksi se näyttää aurinkosähköisen vaikutuksen . Johtavuus ei ole aiheuttanut elektronien johtuminen bändi , vaan johtuminen reikiä (ks sähkönjohtavuus ja vika elektroni ), eli positiivisesti varautunut elektroni vikoja, mikä muun muassa tekee merkki Hall negatiivinen. Tämän reiän johtamisen mekanismiksi ehdotetaan niin sanottua " hyppyjohtavuutta " (reikistä kideviasta toiseen).
Kemiallisia ominaisuuksia
Seleeni on kemiallisilta ominaisuuksiltaan ja käytökseltään hyvin samanlainen kuin rikki. Tämä voidaan selittää samanlaisilla kovalenttisilla säteillä ja näiden kahden elementin samanlaisella elektronegatiivisuudella . Rikin kovalenttinen säde on 103 pikometriä ja seleenin 117 pikometriä. Rikin elektronegatiivisuus Allred-Rochow'n asteikolla on 2,4 ja seleenin 2,5.
Seleenillä on valenssielektronikonfiguraatio 3 d 10 4 s 2 4 p x 2 p y 1 p z 1 . Se saavuttaa jalokaasukonfiguraation kahden kovalenttisen sidoksen tai kahden elektronin hyväksymisen kautta . Seleeni muodostaa vety -seleenidin (H 2 Se) vedyn ollessa yli 400 ° C. Se muodostaa selenidejä metallien kanssa , esimerkiksi natrium- selenide (Na 2 Se), joka voidaan pitää suoloja seleenivety.
Kuumennettaessa ilmassa seleeni palaa sinisellä liekillä, jolloin muodostuu seleenidioksidia SeO 2 .
Kemiallinen käyttäytyminen on samanlainen kuin rikki, mutta seleeniä on vaikeampi hapettaa. Reaktiossa typpihapon kanssa muodostuu seleenihappoa , seleeni (IV) -yhdistettä.
Reaktio Grignard-yhdisteiden , R-Mg-Hal, kanssa johtaa organoseleniumyhdisteisiin, R-Se-Mg-Hal, joista selenoleja , R-Se-H voidaan tuottaa hydrolyysillä .
Isotoopit
Seleenillä on lukuisia isotooppeja . Seitsemästä luonnossa esiintyvästä isotoopista viisi on stabiileja. Stabiilien isotooppien prosentuaalinen taajuus jakautuu seuraavasti: 74 Se (0,9%), 76 Se (9,0%), 77 Se (7,6%), 78 Se (23,6%) ja 80 Se (49, 7%). 79 Se, jonka puoliintumisaika on 327 000 vuotta, on pieni määrä uraanimalmeja. Sitä tuotetaan halkaisemalla uraania 0,04%: n taajuudella, ja sitä esiintyy myös käytetyssä ydinpolttoaineessa. 82 Se radioaktiivisena isotoopina on yksi pisimmistä tunnetuista puoliintumisajoista noin 10-20 vuoden ajan ja hajoaa kaksinkertaisen beetahajoamisen kautta 82 Kr: ksi. Sitä voidaan pitää käytännössä vakaana, sen esiintymistiheys on 9,2%.
Lisäksi tunnetaan vielä 21 radioaktiivista isotooppia, joista 75 Se, jonka puoliintumisaika on 120 päivää, on erityisen tärkeä. 75 Se: tä käytetään erityisten gammasäteilylähteiden rakentamiseen hitsisaumojen rikkomattomaan testaukseen. 75 Se: tä käytetään ydinlääketieteessä yhdessä metioniinin kanssa merkkiaineena haiman toiminnan arvioimiseksi ja homotaurokolihapon (SeHCAT) kanssa sappihappojen resorption arvioimiseksi .
käyttää
Seleeni on välttämätöntä kaikille elämänmuodoille. Siksi seleeniyhdisteitä tarjotaan ravintolisinä ja käsitellään rehun ja lannoitteiden lisäaineiksi. Lasiteollisuudessa sitä käytetään vihreiden lasien värinpoistoon ja punaisten lasien valmistukseen.
Tekniset sovellukset
| vuosi | Lasin valmistus |
Kemikaalit ja pigmentit |
Elektroniset sovellukset |
Metallurgiset sovellukset |
muut sovellukset |
|---|---|---|---|---|---|
| 1970 | 30% | 14% | 37% | 0% | 19% |
| 1980 | 30% | 25% | 35% | 0% | 10% |
| 1990 | 25% | 20% | 35% | 0% | 20% |
| 2000 | 25% | 22% | 10% | 24% | 19% |
- Kuvarumput kopiokoneille ja lasertulostimille
- Puolijohteiden valmistus
- Lisää lateksia lisäämään kulutuksenkestävyyttä
- Väriaine mustavalkoisille valokuville kontrastin lisäämiseksi (vaaleat sävyt pysyvät muuttumattomina, tummemmat mustat saavutetaan, tummat osat näyttävät kolmiulotteisilta), kestävyyden lisääminen (ei selvästi osoitettu) ja tumman kuvan vaaleat värit osat munakoisovärisiksi (myös plastisuuden lisäämiseksi)
- kadmiumselenidiin (CdSe) perustuvien punaisten pigmenttien ja kvanttipisteiden valmistukseen
- Seoslisäaine parantamaan vapaasti leikkaavien terästen ja kupariseosten mekaanista työstettävyyttä
- Käytetään seleeni -tasasuuntaajassa ja seleenikennossa , mutta nykyään se korvataan suurelta osin piillä ( puolijohteilla ).
- ja ruskistus alumiini, messinki, jne. (Seleenidioksidi)
- kuparilla ja indiumilla CIGS -aurinkokennojen fotoaktiivisesta kerroksesta
- analogisissa valomittareissa valokuvausta varten
- Kuten sinkkiselenidi , sitä käytetään tuottamaan optisesti erittäin heijastavia pintoja, mutta se on läpinäkyvä infrapuna-alueella, ja sitä käytetään tästä tuottaa ikkunoita ja keskittyä linssit CO 2 laserit, esimerkiksi
- Suurempia määriä seleenidioksidia kuluu mangaanin elektrolyysissä. Seleenidioksidin lisäys vähentää energiankulutusta elektrolyysin aikana. Mangaanitonnia kohti käytetään enintään 2 kg seleenidioksidia.
Lääketieteellinen käyttö
Jos seleenin puutetta ei voida korvata ruokavaliolla, esimerkiksi ruoansulatus- ja ruoansulatushäiriöiden tai aliravitsemuksen tai aliravitsemuksen tapauksessa, seleeniä annetaan natriumseleniittinä .
Hilseä estävissä hiusshampoissa seleenidisulfidia käytetään jopa 1%: n pitoisuuksina ja lääketieteellisesti esimerkiksi 2,5%: n pitoisuuksina pityriasis versicolorin , hiivasienen aiheuttaman ihosairauden, ehkäisyyn ja hoitoon . Seleeniä sisältävät hilseenvastaiset shampoot soveltuvat myös hevosen kutinaan .
Biologinen merkitys

Seleeni on välttämätön hivenaine ihmisille ja eläimille. Se sisältyy selenokysteiini , aminohappo on aktiivinen keskus entsyymin glutationiperoksidaasi ja monia muita selenoproteins . Selenokysteiini tunnetaan myös nimellä 21. aminohappo ja se sisällytetään oman siirto -RNA : n kautta proteiinisynteesin aikana . Seleeniä sisältävällä glutationiperoksidaasientsyymillä (GSHPx), jota esiintyy kaikissa eläinsoluissa, on ratkaiseva rooli kalvoa vahingoittavien hapettimien ja radikaalituotteiden hajoamisessa. Se suojaa solukalvoja hapettavalta tuhoutumiselta peroksideilta , jotka muodostuvat normaalin lipidimetabolian aikana . Näitä ovat solun tai klassinen glutationiperoksidaasi 1 (GSHPx-1), joka toimii sytosolissa ja mitokondrioiden matriisissa, ja maha-suolikanavan GSHPx-2, joka toimii suolen limakalvossa. Solunulkoinen plasman glutationiperoksidaasi (GSHPx-3) ja GSHPx-4 vaikuttavat lipidikalvojen fosfolipideihin tai siittiöiden hännän rakenneproteiiniin. Useita seleenipuutosoireita voidaan selittää glutationiperoksidaasiaktiivisuuden vähenemisellä. Ihmisen proteomissa tunnetaan noin 25 selenoproteiinia. Seleenillä on tärkeä rooli kilpirauhashormonien tuotannossa, tarkemmin sanoen tyroksiinin (T4) "aktivoitumisessa" trijodityroniiniksi (T3). Se on osa tyroksiini- 5'-deiodinaasi- entsyymiä , joka on vastuussa jodiatomin poistamisesta T4: stä. Tämä dejodaatio luo T3: n. Seleenin puute johtaa tyroksiini-5'-deiodaasin puutteeseen, mikä tarkoittaa, että vain osa käytettävissä olevasta T4: stä voidaan dejodoida. Koska T3 on paljon tehokkaampi aineenvaihdunnassa, T3 -puutos johtaa kilpirauhasen vajaatoimintaan ( kilpirauhasen vajaatoiminta ).
Tioredoksiinireduktaasi (TrxR), joka vähentää solujen kasvulle tärkeää tioredoksiinia , mutta myös lukuisia muita matala- ja suurimolekyylisiä substraatteja. Jodotyroniini-5'-deiodinaasit (kilpirauhashormonijodinaasit; ID-I, ID-II, ID-III) katalysoivat kilpirauhashormonien synteesiä .
Selenoproteiinit, joiden keskellä on modifioitu aminohappo selenokysteiini, mukaan lukien seleeniproteiini H, I, K, M, N, O ja P, toimivat seleenin kuljetusproteiinina kehon solujen välillä; R, metioniinisulfoksidireduktaasi ja S, T, V ja W esiintyvät lihaksissa. Selenofosfaattisyntetaasi 2 katalysoi monoselenofosfaatin synteesiä, joka on selenokysteiinin edeltäjä.
Seleenillä on erittäin myrkyllinen vaikutus korkeammilla pitoisuuksilla, ja puuteoireita aiheuttavien pitoisuuksien ja myrkyllisten pitoisuuksien vaihteluväli on hyvin pieni. Lisäksi seleenin myrkyllisyys riippuu kemiallisesta sidoksesta.
Seleenin rikastaminen ravintoketjussa
Vesiympäristössä levät ja mikro -organismit voivat imeä seleeniä vedestä ja rikastuttaa sitä miljoonalla vesipitoisuudella. Maapitoisuudesta riippuen kasvit sisällyttävät seleeniä epäspesifisesti aminohappoihin rikin sijaan, erityisesti selenometioniiniin ja vähemmässä määrin selenokysteiiniin tai sen johdannaisiin, kuten metyyliselenokysteiiniin . Ainoastaan niin kutsutut "seleeninkeräjäkasvit" (seleenin varaajakasvit, esimerkiksi paratiisipähkinä ), joita esiintyy seleenipitoisilla alueilla, joilla on kuiva ilmasto , myös varastoivat seleeniä orgaanisesti sitoutuneina, vesiliukoisina seleeni- tai seleenisuoloina. Saannin määrä riippuu seleenin hyötyosuudesta. Suuret orgaaniset osuudet adsorboivat seleeniä ja vähentävät sitä niin, että se on immobilisoitunut eikä kasvit voi imeytyä siihen. Maaperää, jonka pitoisuus on alle 0,1 miljoonasosaa (ppm), pidetään seleenipitoisena, maaperää seleenipitoisena ja seleenipitoisuutena yli 0,5 ppm.
Seleeni saanti
Selenoproteiini P : n kyllästymisen seleenin perusteella Saksassa, Itävallassa ja Sveitsissä suositeltu päiväannos oli 70 mikrogrammaa päivässä miehelle, 60 mikrogrammaa päivässä naiselle ja 75 mikrogrammaa päivässä imettäville naisille. Lasten ja nuorten tarpeen arvioidaan olevan pienempi iän mukaan. Elintarvikealan tiedekomitea Euroopan komissio esitti vuonna 1993 perustettu viitearvon 55 mikrogrammaa seleeniä päivässä aikuisille. Komitean arvion mukaan päivittäinen kokonaisannos ei saisi ylittää 300 mikrogrammaa päivässä. Saksan liittovaltion riskinarviointilaitos (BfR) suosittelee päivittäisen annoksen rajoittamista 45 mikrogrammaan ravintolisille. Yhdysvaltain kansalliset terveysinstituutit suosittelevat 55 mikrogrammaa seleeniä päivässä normaalina annoksena aikuisille ja 400 mikrogrammaa päivässä ylemmänä toleranssirajana, jolla ei odoteta olevan kielteisiä vaikutuksia terveyteen. Seleeniä lisätään lypsykarjan rehuun, koska rehun luonnollinen seleenipitoisuus ei usein riitä karjan ruokintaan.
Lääketieteelliset näkökohdat
Euroopan elintarviketurvallisuusviranomainen Safety Authority (EFSA) löydetty riittävästi tieteellistä näyttöä siitä, että seleeni lisäisivät normaalia siittiöiden ylläpito hiukset ja kynnet, normaalia toimintaa immuunijärjestelmää ja suojelee soluja oksidatiivisen stressin ja normaali kilpirauhasen toiminta .
Pharmaceutical Information -lehdessä kesäkuussa 2005 julkaistussa julkaisussa keskusteltiin lisä seleenilahjasta, josta ei ole näkökulmaa oletettuun hyödyllisyyteen eri sairauksissa: Mikään saatavilla olevista tutkimuksista ei osoittanut seleenin hyötyä missään yhteydessä. Vaikka positiivinen vaikutus erilaisiin syöpätyyppeihin vaikuttaa mahdolliselta, toisaalta muiden syöpien suosiminen ei ole epätodennäköistä. Tällaisesta yhteydestä keskustellaan sydän- ja verisuonitaudeissa. Kokeellista verenpainetautia rotilla voidaan vähentää merkittävästi seleenin ennaltaehkäisevällä antamisella. Mielenkiintoista tässä yhteydessä on suojaava seleenivaikutus sydänlihasten fragmenttien kylmäsäilytyksessä .
The ( "tutkia suojaava vaikutus seleenin ja E-vitamiinia syövän" SELECT "tutkimus aloitettiin Sel enium ja vitamiini E- C- Ancer ehkäisy T rial") peruttiin vuonna 2008 ennen suunniteltua loppua, hyötynä jo jätetty tuolloin voisi . Erilaiset satunnaistettuja kontrolloituja tutkimuksia voisi näy positiivinen vaikutus hallinnon seleenin valmisteiden vähentämään syöpäriskiä korkea todisteita . Useiden vuosien ajan toistuvat tutkimukset osoittivat osittain käänteisen, osittain olemattoman ja osittain suoran suhteen seleenialtistuksen ja syöpäriskin välillä, mutta missään tutkimuksessa ei ollut viitteitä annos-vaikutus-suhteesta . On epäselvää, voiko seleeni muuttaa syöpäriskiä ihmisillä, joilla on tietty geneettinen tausta tai ravitsemuksellinen asema, sekä seleenin eri muotojen mahdollisista vaikutuksista. Tutkimukset seleenin vaikutuksesta kemoterapian ja sädehoidon sivuvaikutusten lievittämiseen eivät myöskään antaneet perusteita suosituksille seleenilisän saamiseksi tai sitä vastaan. Näissä tutkimuksissa seleenipitoisuus mitattiin joko veriplasmasta , veriseerumista tai varpaankynsistä . Varpaankynsien seleenipitoisuuden määrittäminen vaihtelee vähemmän kuin seerumin tai plasman, joten nämä arvot ovat yleensä mielekkäämpiä.
Tutkimukset seleeniä sisältävien ravintolisien vaikutuksesta sydän- ja verisuonitautien kehittymiseen terveillä aikuisilla, joilla oli jo riittävästi seleeniä normaalista ruokavaliosta, toimivat samalla tavalla . Etua tai haittaa ei voitu havaita, sydän- ja verisuonitauteja ei voitu estää seleenin antamisella. Seleeni -korvausryhmässä esiintyi lisää diabeteksen 2 tapauksia, mutta ero ei ollut merkittävä. Kuitenkin hiustenlähtö ja ihottuma lisääntyivät . Pysyvä lisä seleenin saanti (täydennys) on yhdistetty haitallisiin vaikutuksiin. Vuoden 2007 seleenilisää koskevassa tutkimuksessa paljastui yllättäen liiallinen tyypin 2 diabeteksen riski, ja siitä tehtiin lukuisia muita tutkimuksia. Vuonna 2018 tehdyssä järjestelmällisessä katsauksessa todettiin, että seleeni voi lisätä tyypin 2 diabeteksen riskiä laajalla altistusalueella, mutta yleisesti ottaen riski on pieni.
Seleniumin puutosairaudet
Tunnettu seleenin puute sairaudet ovat Keshanin tauti (nuorten kardiomyopatia), joka on nimetty Koillis Kiinan kaupunki Keshan vuonna Heilongjiangin alueella vuonna Mantsurian, ja Kashin-Beckin tauti ihmisillä, ravitsemuksellinen rappeutumista nivelruston nimetty Venäjän armeijan lääkäri Nikolai Ivanovitš Kašin (1825–1872) ja Jevgeni Vladimirovitš Beck (1865–1915). Kuubassa tulee ihmisten neuropatia . Seleenin puute aiheuttaa influenssa A / Bangkok / 1/79 -viruksen mutaation, josta tulee virulentti. Seleeniä käytetään lääketieteellisesti ( natriumseleniitti , suun kautta tai parenteraalisesti ) seleenipuutteen sattuessa, jota ei voida korvata ruokavaliolla, esimerkiksi ruoansulatus- ja ruoansulatushäiriöiden tai aliravitsemuksen tai aliravitsemuksen tapauksessa .
Eläinlääkinnässä, on valkoinen lihassairaus (ravitsemukselliset Myodegeneration (NMD), ravitsemukselliset lihasdystrofia , tarttuvasta myodystrophy, ravintoaine rabdomyolyysi , ravintoaine Rhabdomyopathie , myopaattiset - dyspnoisches oireyhtymä, Kälberrheumatismus, Hühnerfleischigkeit, Fischfleischigkeit) tunnetaan märehtijöille tapahtuu, siat ja kalkkunat ja jossa seleenin puutetta pidetään (samanaikaisena) syynä. Paralyyttistä myoglobinuriaa , harjoituksen rabdomyolyysiä, esiintyy märehtijöivillä naudoilla maailman seleenipuutteisilla alueilla , erityisesti kahdeksan kuukauden ikäisillä ja sitä vanhemmilla nautaeläimillä.
todiste
Selenaatin jäämien (0,003%) kvantitatiivinen määritys voidaan suorittaa sähkökemiallisesti polarografian avulla . 0,1 -molaarisessa ammoniumkloridiliuoksessa on vaihe -1,50 V (verrattuna SCE: hen ). Ultra-jäljitysalueella voidaan käyttää atomispektrometriaa, jossa liekki AAS 100 μg / l ( ppb ), grafiittiuuni AAS 0,5 ja hydriditekniikka pystyvät havaitsemaan 0,01 µg / l seleeniä.
turvallisuusohjeet
Seleeni ja seleeniyhdisteet ovat myrkyllisiä. Suora kosketus vahingoittaa ihoa (rakkuloita) ja limakalvoja. Hengitetty seleeni voi johtaa pitkittyneisiin keuhko -ongelmiin.
Myrkytys seleenin liiallisesta kulutuksesta tunnetaan selenoosina . Ensimmäinen kuvaus seleenimyrkytyksestä, tietämättä sen luonnetta, tulee Marco Pololta , joka Shaanxin maakuntaa ylittäessään havaitsi, että hevoset ja muut pakkauseläimet halkaisivat kavionsa sen jälkeen, kun he olivat syöneet tiettyjä seleeniakkuina tunnettuja kasveja. Yli 3000 mikrog seleeniä päivässä voi johtaa maksakirroosiin , hiustenlähtöön ja sydämen vajaatoimintaan . Elektroniikka-, lasi- ja maaliteollisuuden työntekijöiden katsotaan olevan vaarassa. Muiden lähteiden mukaan myrkytysoireita, kuten pahoinvointia ja oksentelua, hiustenlähtöä, kynsimuutoksia, perifeeristä neuropatiaa ja uupumusta, esiintyy jo 400 µg / vrk .
Seleeniyhdisteet
Yhdisteissä seleeniä esiintyy useimmiten hapetustilassa −II ( vetyseleniidi , selenidit ) ja + IV (tetrahalidit, seleenidioksidi ja selenaatit (IV) , seleniitit vanhentuneet ). Selenidi-ioneissa seleeniä esiintyy ei-kokonaislukuisilla negatiivisilla hapetusluvuilla. Harvinaisempia positiivisia hapetuslukuja ovat + I (halogenidit Se 2 X 2 ) ja + VI ( seleeniheksafluoridi , seleenihappo ). Seleeniyhdisteet, joiden hapetusluku on + VI, ovat voimakkaampia hapettimia kuin vastaavat rikki- ja telluuriyhdisteet. Väkevän seleeni (VI) -hapon ja suolahapon seokset liuottavat metalleja, kuten kultaa ja platinaa.
Vetyyhdisteet
Vetyselenidi (H 2 Se) on väritön, erittäin myrkyllinen kaasu, joka syntyy seleenidien (M x Se y ) reaktiossa vahvojen happojen, esimerkiksi suolahapon (HCl) kanssa. Alkuaineista vety ja seleeni yhdiste voidaan esittää voimakkaasti endotermisenä yhdisteenä yli 350 ° C: n lämpötiloissa. Vetyselenidi hajoaa hitaasti alkuaineiksi huoneenlämpötilassa; hajoaminen kiihtyy valon vaikutuksesta. Vesiliuos ( seleenivetyhappo ) on heikosti hapan; happolujuus K s = 1,88 · 10 −4 on samassa suuruusluokassa kuin typpihappo (HNO 2 ).
Selenides
Useimpien metallien kanssa seleeni muodostaa binaarisia selenidejä, jotka sisältävät selenidianionin Se 2− . Lisäksi tunnetaan Diselenide Se 2 2− ja Polyselenide Se n m− , jotka voidaan saada metallin reaktiolla seleenin ylimäärän kanssa:
Synteesi on mahdollista sulattamalla elementit yhteen tai liuoksessa. Selenidit ovat herkkiä hydrolyysille ja hapettumiselle. Ionisten selenidien lisäksi tunnetaan molekyyliyhdiste hiili -dislenididi , Se = C = Se.
- Esimerkkejä polyselenideistä
Natriumhydridi pienentää seleenin alkuaineeksi natriumdislenididiksi (Na 2 Se 2 ).
Happiyhdisteet ja interkalkogeenit
Seleniumdioksidi ( seleeni (IV) oksidi ) on väritön, kiteinen kiinteä aine, joka saadaan polttamalla seleeniä ilmassa. Se muodostaa vedessä seleenistä happoa , H 2 SeO 3 . Se on suhteellisen voimakas hapetin ja pelkistyy helposti seleeniksi.
Seleenitrioksidi ( seleeni (VI) oksidi ), voidaan saada poistamalla vettä seleenihappo- , H 2 SeO 4 . Se on myös kiteinen kiinteä aine ja vahva hapettava aine.
On myös kiinteitä, kiteisiä, seka-valenttinen seleeni (IV, VI) oksidit Se 2 O 5 ja Se- 3 O 7 .
Seleniummonoksidi, SeO, tunnetaan vain epävakaana välituotteena.
Seleenisulfidi SeS ≈2 (ei-stökiometrinen seleeni-rikkiyhdiste, joka koostuu rikin kaltaisista syklisistä molekyyleistä, joiden koko ja koostumus vaihtelee, jota kutsutaan myös seleenidisulfidiksi likimääräisen suhteen SeS 2 vuoksi ).
Selenaatit ovat seleenihapon suoloja anionien SeO 4 2− kanssa . Ortooselenaatteja, kuten trigonaalinen bipyramidaalinen anioni SeO 5 4− ja oktaedrinen SeO 6 6−, havaitaan harvoin.
Seleenihalogenidit
Seleeni heksafluoridi voidaan esittää reaktiolla seleenin kanssa alkuainefluoria. Vaikka se on reaktiivisempi kuin rikkiheksafluoridi , se ei reagoi veden kanssa normaaliolosuhteissa.
Tärkeimmät seleenihalogenidit ovat tetrahalidit, seleenitetraiodidia ei voitu syntetisoida. Tetrahalidit voidaan esittää elementeistä. Ne voivat reagoida Lewisin emäksinä muodostaen: SeX 3 + sekä Lewis -happoja (SeX 6 2− ). Kaikkien halogeenien kanssa tunnetut di- ja monohalogenidit ovat epävakaita.
Orgaaniset seleeniyhdisteet
Orgaanisia seleeniyhdisteitä esiintyy pääasiassa hapetustilassa <II, II ja IV. Orgaaniset seleeniyhdisteet käsittävät oleellisesti seuraavat aineiden ryhmät;
- Selane (orgaaniset seleenidit) RSeR, kuten dimetyyliselenidi
- Diselane ( Diselenide ) RSeSeR
- Triselane (Triselenide) RSeSeSeR
- Selenols RSeH
- Selenenyle RSeX
- Seleenioksidit R -Se (= O) -R
- Selenone R 2 SeO 2
- Selone R 2 C = Se, ketonien seleenianalogit
Seleeni polykationit
Hapettamalla seleeni huolellisesti, voidaan valmistaa lukuisia seleenipolykationeja Se n x + ja kiteyttää sopivalla vastaionilla. Vastaionin on oltava heikko Lewis -emäs, koska seleenipolykationit ovat suhteellisen vahvoja Lewis -happoja. Sopivia hapettimia ovat usein siirtymämetallien halogenidit, jotka antavat halutun yhdisteen suoraan tyypillisesti 200 ° C: n lämpötiloissa:
Usein kiteytyminen onnistuu kemiallisen kuljetuksen olosuhteissa , mutta joskus on käytettävä vedettömiä liuottimia, kuten tina (IV) kloridia tai piitetrabromidia .
Jos metallihalogenidi ei ole sopiva hapettava aine, kuten usein tapahtuu pääryhmän elementtien halogenidien tapauksessa, vastaavia telluuritetrahalideja voidaan käyttää hapettimina:
Vaihtamalla vastaionia ja reaktioväliainetta voitaisiin tuottaa monenlaisia polykationeja; seleeni-telluuri-sekapolykationit ovat saatavilla sopivalla synteesin reagoivien aineiden valinnalla.
- Esimerkkejä seleenipolykationeista
kirjallisuus
- AF Holleman , N. Wiberg : Epäorgaaninen kemia . 103. painos. Osa 1: Perusteet ja pääryhmän elementit. Walter de Gruyter, Berliini / Boston 2016, ISBN 978-3-11-049585-0 , s. 693–728 (lukunäyte: Osa A-Vedyn kemian perusteet. Google- kirjahaku ).
- W. Marktl: Seleenin fysiologia ja ravitsemusfysiologia. Julkaisussa: Journal for Mineral Metabolism . Osa 8, nro 3, 2001, s.34-36. (PDF)
- PF Surai: Luonnolliset antioksidantit. Nottingham University Press, 2002, ISBN 1-897676-95-6 .
- Dolph L.Hatfield et ai. (Toimittaja): Selenium: Its Molecular Biology and Role in Human Health. 3. Painos. Springer, New York 2012, ISBN 978-1-4614-1024-9 ( rajoitettu esikatselu Google-teoshaussa).
- Gary S. Bañuelos et ai. (Toimittaja): Selenium in the Environment and Human Health. CRC Press / Balkema, Leiden 2014, ISBN 978-1-138-00017-9 . ( rajoitettu esikatselu Google -teoshaussa)
nettilinkit
- Ravintolisien toimiston tietosivu: Selenium
- Seleeni syöpälääketieteessä - dokumentaatio ( Muistio 28. helmikuuta 2013 Internet -arkistossa ) (PDF -tiedosto; 901 kt)
- Seleeni. Julkaisussa: Mineralienatlas Lexikon. Stefan Schorn et ai., Käytetty 10. elokuuta 2021 .
- Selenium -hakutulokset. Lähde : rruff.info. Raman-spektroskopian, röntgendiffraktion ja mineraalien kemian tietokanta (RRUFF), saatavana 10. elokuuta 2021 .
- Amerikkalainen mineralogisti-kristallirakenne-tietokanta-seleeni. Julkaisussa: rruff.geo.arizona.edu. Käytetty 10. elokuuta 2021 .
Yksilöllisiä todisteita
- ↑ Harry H. Binder: Kemiallisten alkuaineiden sanakirja. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Ominaisuuksien arvot (tietoruutu) on otettu osoitteesta www.webelements.com (selenium) , ellei toisin mainita .
- ^ IUPAC, Standard Atomic Weights Revised 2013 .
- ↑ a b c d e f Sisäänpääsy seleeniin Kramidassa, A., Ralchenko, Yu., Reader, J. ja NIST ASD Team (2019): NIST Atomic Spectra Database (versio 5.7.1) . Toim.: NIST , Gaithersburg, MD. doi : 10.18434/T4W30F ( https://physics.nist.gov/asd ). Haettu 11. kesäkuuta 2020.
- ↑ b c d e f Merkintä seleeniä klo WebElements, https://www.webelements.com , pääsee 11. kesäkuuta 2020 mennessä.
- ↑ Robert C.Weast (toim.): CRC Handbook of Chemistry and Physics . CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9 , s. E-129-E-145. Siellä arvot perustuvat g / mol ja ne on annettu cgs -yksiköissä. Tässä määritetty arvo on siitä laskettu SI -arvo ilman mittayksikköä.
- ^ A b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Korjatut arvot kiehumispisteille ja käsikirjojen elementtien höyrystymisen entalpioille. Julkaisussa: Journal of Chemical & Engineering Data . 56, 2011, s. 328-337, doi: 10.1021 / je1011086 .
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Kokeellisen fysiikan oppikirja . Osa 6: Kiinteät aineet. 2. painos. Walter de Gruyter, 2005, ISBN 3-11-017485-5 , s.361 .
- ↑ b Merkintä seleeni on GESTIS aine tietokanta IFA , pääsee 30. huhtikuuta 2017 mennessä. (JavaScript vaaditaan)
- ↑ Merkintä Seleeni on luokitusten ja merkintöjen luetteloon on Euroopan kemikaaliviraston (ECHA), pääsee 1. elokuuta 2016 Valmistajien ja jälleenmyyjien voi laajentaa yhdenmukaistettuun luokitukseen ja merkintöihin .
- ↑ a b c Jan Trofast: Berzelius'n seleenin löytö. Julkaisussa: Chemistry International , 33 toukokuuta 2011.
- ^ William Grylls Adams, Richard Evan Päivä: IX. Valon vaikutus seleeniin. Julkaisussa: Philosophical Transactions of the Royal Society of London . 167, 1877, s. 313-349, doi: 10.1098 / rstl.1877.0009 .
- ^ Engen Obach: Tutkimus seleenistä. Julkaisussa: Journal of the Society of Telegraph Engineers . 6,20, 1877, s. 498-506.
- ↑ ME Levinshtein, GS Simin: Varhaisin puolijohdelaite. Puolijohteisiin tutustuminen World Scientific, Singapore, New Jersey, Lontoo, Hongkong, ISBN 978-981-02-3516-1 , s.77-79.
- ↑ a b Gerhard N. Schrauzer, Peter F. Surai: Seleeni ihmisten ja eläinten ravinnossa: Ratkaistu ja ratkaisematon kysymys. Osittain historiallinen tutkielma seleenin biologisen välttämättömyyden löytämisen 50 -vuotispäivän kunniaksi, omistettu Klaus Schwarzin (1914–1978) muistolle hänen kuolemansa kolmekymmentä vuosipäivää. Julkaisussa: Critical Reviews in Biotechnology . 29, 2009, s. 2-9, doi: 10.1080 / 07388550902728261 .
- ^ A.Wassermann, Franz Keysser, Michael Wassermann: Osuudet ongelmaan: Vaikuttaa kasvaimiin terapeuttisesti verenkierrosta. Julkaisussa: DMW - German Medical Weekly . 37, 1911, s. 2389-2391, doi: 10.1055 / s-0028-1131175 .
- ↑ Arthur Galston: Vihreä viisaus. Sokeat porrastajat. Basic Books, Inc. 1981. ISBN 978-0465027125 , s.57 .
- ↑ Jane Pinsent: Seleniitin ja molybdaatin tarve muurahaisdehydrogenaasin muodostumisessa Coli-aerogenes-bakteeriryhmän jäsenten keskuudessa. Julkaisussa: Biochemical Journal . 57, 1954, s. 10-16, doi: 10.1042 / bj0570010 .
- ↑ Klaus Schwarz, Calvin M.Foltz: Seleeni kiinteänä osana tekijää 3 ruokavalion nekroottista maksan rappeutumista vastaan. Julkaisussa: Journal of the American Chemical Society . 79, 1957, s. 3292-3293, doi: 10.1021 / ja01569a087 .
- ↑ Susan J. Fairweather-Tait: Seleeni ihmisten terveydessä ja sairauksissa. Julkaisussa: Antioxidants & Redox Signaling , 14, 2011, s. 1337-1387, doi: 10.1089 / ars.2010.3275 .
- ↑ Kyllä. E. Yudovich, kansanedustaja Ketris: Seleeni hiilessä: katsaus. Julkaisussa: International Journal of Coal Geology . 67, 2006, s. 112-126, doi: 10.1016 / j.coal.2005.09.003 .
- ^ Byard W. Mosher, Robert A. Duce: Globaali ilmakehän seleenibudjetti. Julkaisussa: Journal of Geophysical Research . 92, 1987, s. 13289-13298, doi: 10.1029 / JD092iD11p13289 .
- ↑ Tarkkaile seleenitasoja. Julkaisussa: schweizerbauer.ch . 22. marraskuuta 2018. Haettu 22. marraskuuta 2018 .
- ^ Seleeni ympäristölääketieteessä. Julkaisussa: Federal Health Gazette - Health Research - Health Protection. 49, 2006, s.88 , doi: 10.1007 / s00103-005-1185-4 .
- ↑ Christine D. Thomson, Alexandra Chisholm, Sarah K. McLachlan, Jennifer M. Campbell: Brasilian pähkinät: tehokas tapa parantaa seleenin tilaa. Julkaisussa: The American Journal of Clinical Nutrition . 87, 2008, s. 379-384, doi: 10.1093 / ajcn / 87.2.379 .
- ↑ Hauke Vollstaedt, Klaus Mezger, Ingo Leya: Kuukivien seleeni -isotooppikoostumus: vaikutukset kuun muodostumiseen ja sen haihtuvaan häviämiseen. Julkaisussa: Earth and Planetary Science Letters . 542, 2020, S 116289, doi: 10.1016 / j.epsl.2020.116289 .
- ^ Ian U.Roederer et ai.: Arseenin, seleenin ja muiden raskaiden elementtien uudet havainnot kahdessa metallin köyhässä tähdessä. Julkaisussa: Astrophysical Journal . 791, 2014, s. 32--44 , doi: 10.1088 / 0004-637X / 791/1/32 .
- ↑ G.Dreibus, H.Palme, B.Spettel, J.Zipfel, H.Wanke: Rikki ja seleeni kondriittisissa meteoriiteissa. Julkaisussa: Meteoritics , 30, 1995, s. 439-445, doi: 10.1111 / j.1945-5100.1995.tb01150.x .
- ↑ Malcolm Back, William D. Birch, Michel Blondieau ja muut: The New IMA Minerals List - A Work in progress - Päivitetty: heinäkuu 2021. (PDF; 3.52 MB) julkaisussa: cnmnc.main.jp. IMA / CNMNC, Marco Pasero, heinäkuu 2021, käytetty 10. elokuuta 2021 .
- ^ Charles Palache : Avustukset crystallography: Claudetite; minasragrite; samsoniitti; natiivi seleeni; indium . Julkaisussa: American Mineralogist . nauha 19 , 1934, s. 194–205 (englanti, rruff.info [PDF; 599 kB ; Käytetty 10. elokuuta 2021]).
- ↑ United Verde Mine. Julkaisussa: Mineralienatlas Lexikon. Stefan Schorn et ai., Käytetty 10. elokuuta 2021 .
- ↑ Ernest H. Nickel , Monte C. Nichols: IMA / CNMNC List of Minerals 2009. (PDF; 1,82 MB) julkaisussa: cnmnc.main.jp. IMA / CNMNC, tammikuu 2009, käytetty 11. elokuuta 2021 .
- ↑ David Barthelmy: New Dana -luokituksen järjestämät mineraalit-01.03 Alkuperäiset elementit, joissa on puolimetallisia ja ei-metallisia elementtejä. Lähde : webmineral.com. Käytetty 11. elokuuta 2021 .
- ↑ seleeni . Julkaisussa: John W.Anthony, Richard A.Bideaux, Kenneth W.Bladh, Monte C.Nichols (Toim.): Handbook of Mineralogy, Mineralogical Society of America . 2001 (englanti, handbookofmineralogy.org [PDF; 60 kB ; Käytetty 11. elokuuta 2021]).
- ↑ Paikat Seleniumille. Lähde : mindat.org. Hudson Institute of Mineralogy, käytetty 11. elokuuta 2021 .
- ^ David Barthelmy: Seleeniä sisältävät mineraalilajit (Se). Lähde : webmineral.com. Käytetty 11. elokuuta 2021 .
- ^ Hae mineraaleja kemian mukaan - Mineraalit, jotka sisältävät Se. Lähde : mindat.org. Hudson Institute of Mineralogy, käytetty 11. elokuuta 2021 .
- ^ S. Ramachandra Rao: Resurssien talteenotto ja kierrätys metallurgisista jätteistä. Elsevier, Oxford, Amsterdam, 2006, ISBN 978-0-08-045131-2 , s.425 .
- ↑ Erwin Riedel , Christoph Janiak : Epäorgaaninen kemia . 8. painos. de Gruyter, 2011, ISBN 3-11-022566-2 , s. 458 .
- ↑ a b W. C. Butterman, RD Brown Jr.: Mineral Commodity Profiles: Selenium. USGS, Avaa tiedostoraportti nro. 2003-18. 2004.
- ↑ GN Schrauzer: Seleenihiiva: koostumus, laatu, analyysi ja turvallisuus. Julkaisussa: Pure and Applied Chemistry . 78, 2006, s. 105-109, doi: 10.1351 / pac200678010105 .
- ↑ Merkintä allotrooppisesta siirtymästä . Julkaisussa: IUPAC Compendium of Chemical Terminology (”Gold Book”) . doi : 10.1351 / goldbook.A00244 Versio: 3.0.1.
- ↑ Merkintä polymorfisesta siirtymästä . Julkaisussa: IUPAC Compendium of Chemical Terminology (”Gold Book”) . doi : 10.1351 / goldbook.P04748 Versio: 3.0.1.
- ↑ a b c A. F. Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 102 painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s. 618-646.
- ↑ Peter Paetzold : Kemia - johdanto. Walter de Gruyter, Berliini 2009, ISBN 978-3-11-020268-7 , s.167 .
- ↑ Olav Foss, Vitalijus Janickis: Y-monokliinisen seleenin kiderakenne. Julkaisussa: J. Chem. Soc., Dalton Trans. 1980, s. 624-627, doi: 10.1039 / DT9800000624 .
- ^ NF Mott: Johtuminen ei-kiteisissä materiaaleissa. Julkaisussa: Philosophical Magazine . 19, 1969, s. 835-852, doi: 10.1080 / 14786436908216338 .
- ↑ Ralf Steudel : Ei-metallien kemia: Rakenteesta ja sidoksesta sovellukseen. Walter de Gruyter, 2008, ISBN 978-3-11-019448-7 , s.432 .
- ↑ webelements.com
- ↑ ptb.de: Se-79 : n puoliintumisaika .
- ↑ G. Jörg, R. Bühnemann, S. Hollas, N. Kivel, K. Kossert, S. Van Winckel, Ch. Lierse v. Gostomski: Radiokemiallisesti puhtaan 79 Se valmistaminen ja sen puoliintumisajan erittäin tarkka määrittäminen. Julkaisussa: Applied Radiation and Isotopes , 68.12, 2010, s. 2339-2351, doi: 10.1016 / j.apradiso.2010.05.006 .
- ↑ Patentti DE60033511T2 : Gammasäteilylähde. Julkaistu 27. huhtikuuta 1999 , Keksijä: Mark Golder, Aston Clinton. Patentti, gammasäteilylähde 75 sisältää Se.
- ↑ Torsten Kuwert, Frank Grünwald , Uwe Haberkorn , Thomas Krause (toim.): Ydinlääketiede. Stuttgart 2008, ISBN 978-3-13-118504-4 .
- ↑ Seleeni ja Tellurium . Julkaisussa: 2010 Minerals Yearbook . Käytössä 31. heinäkuuta 2021.
- ↑ Ben Curnow: Kutiavan hevosen diagnoosi ja hoito . Julkaisussa: InPractice , 42.1, 2020, s. 47–55, doi: 10.1136 / inp.l6929 .
- ↑ P. Oehme , W. Krause, E. Göres, N. Michael, O. Gomazkov: Selenium in medicine. Julkaisussa: lääkehoito . 11, 1993, s. 355-357.
- ↑ U. Schweizer, AU Bräuer, J. Köhrle, R. Nitsch, NE Savaskan: Seleeni ja aivotoiminta: huonosti tunnustettu yhteyshenkilö. Julkaisussa: Brain research . Aivotutkimuksen arvostelut. Osa 45, numero 3, heinäkuu 2004, s.164-178, doi: 10.1016 / j.brainresrev.2004.03.004 . PMID 15210302 (arvostelu).
- ↑ D. Behne, A. Kyriakoupoulos, H. Meinhold, J. Köhrle: Tyypin I jodotyroniini-5'- deiodinaasin tunnistaminen selenoentsyyminä . Julkaisussa: Biochem. Biophys. Res. Comm. Ei. 173 , 1990, s. 1143-1149 , PMID 2268318 .
- ^ JR Arthur, F.Nicol, GJ Beckett: Seleenin puutos, kilpirauhashormonien aineenvaihdunta ja kilpirauhashormonideiodinaasit . Julkaisussa: Am. J. Kliininen ravitsemus . Ei. 57 , 1993, s. 236-239 ( tiivistelmä ).
- ↑ C. Ekmekcioglu: Hivenaineita matkalla 2000 -luvulle - raudan, kuparin, seleenin ja sinkin merkitys kasvaa . Julkaisussa: Journal of Nutritional Medicine . Ei. 2 (2) , 2000, s. 18–23 ( Itävallan PDF -painos).
- ↑ a b L. L. Stillings: Selenium . Julkaisussa: KJ Schulz, JH DeYoung Jr., RR Seal II, DC Bradley (toim.): Yhdysvaltojen kriittiset mineraalivarat - taloudellinen ja ympäristögeologia ja tulevaisuuden tarjonnan näkymät. Luku Q, 2017, US Geological Survey Professional Paper 1802, s. Q1-Q55, doi: 10.3133 / pp1802Q , ISSN 2330-7102.
- ↑ a b A. P. Kipp, D. Strohm, R. Brigelius-Flohé, L. Schomburg, A. Bechthold, E. Leschik-Bonnet, H. Heseker: Tarkistetut viitearvot seleenin saannille. Julkaisussa: Journal of micro elements in medicine and biologology : organ of the Society for Minerals and Trace Elements. Vuosikerta 32, lokakuu 2015, s.195-199 , doi: 10.1016 / j.jtemb.2015.07.005 . PMID 26302929 .
- ↑ KS Prabhu, XG Lei: seleeni. Julkaisussa: Ravitsemuksen kehitys . Osa 7, numero 2, maaliskuu 2016, s.415-417 , doi: 10.3945 / an.115.010785 . PMID 26980826 , PMC 4785479 (ilmainen koko teksti).
- ^ Elintarvikealan tiedekomitea: Elintarvikealan tiedekomiteoiden raportit. 31. sarja, 1993 (PDF)
- ↑ Elintarvikealan tiedekomitea, dieettituotteiden, ravitsemuksen ja allergioiden tiedelautakunta: Yksittäisten vitamiinien ja kivennäisaineiden siedettävät ylärajat. 2006 (PDF)
- ↑ Anke Weißenborn et ai.: Vitamiinien ja kivennäisaineiden enimmäismäärät ravintolisissä. Julkaisussa: Journal of Consumer Protection and Food Safety . 13, 2018, s. 25-39, doi: 10.1007 / s00003-017-1140-y .
- ↑ Selenium - Fact Sheet for Health Professionals , osoitteessa nih.gov, luettu 10. elokuuta 2021.
- ↑ Euroopan elintarviketurvallisuusviranomainen: Tieteellinen lausunto. Julkaisussa: EFSA Journal . Nide 7, nro 9, 2009, s. 1220 doi: 10.2903 / j.efsa.2009.1220
- ↑ Euroopan elintarviketurvallisuusviranomainen: Tieteellinen lausunto. Julkaisussa: EFSA Journal . Osa 8, nro 10, 2010, s.1727 doi: 10.2903 / j.efsa.2010.1727
- ↑ Onko seleenin antamiseen viitteitä? Julkaisussa: Pharmainformation . Volume 20, No. 2, June 2005, käytetty 29. toukokuuta 2013.
- ↑ W. Krause, P. Oehme: Seleeniyhdisteiden mahdollisesta merkityksestä lääketieteessä. Osa I: Seleeni olennaisena hivenaineena - toimintamekanismit, seleenin puutteen seuraukset. Julkaisussa: German health-being. Nide 34, 1979, s. 1713-1718.
- ↑ W. Krause, P. Oehme: Seleeniyhdisteiden mahdollisesta merkityksestä lääketieteessä. Osa II: Joitakin lähtökohtia seleeniyhdisteiden terapeuttiselle käytölle. Julkaisussa: Saksalaisia terveysolentoja . Nide 34, 1979, s. 1769-1773.
- ↑ H. Hilse, P. Oehme, W. Krause, K. Hecht : Natriumseleniitin vaikutus kokeelliseen verenpaineeseen rotilla. Julkaisussa: Acta physologica et farmakologica bulgarica . Osa 1, nro 3, 1979, s.47-50.
- ↑ G.Mathes, HA Hackensellner, KD Wagenbreth, H.Wendtlandt, P.Oehme, KD Jentzsch: Seleenivaikutuksen pitoisuusriippuvuus sydänlihasten fragmenttien kylmäsäilytyksen yhteydessä. Julkaisussa: Probl. Häm. Transf. Transpl. Volume 7, 1980, s. 174-231.
- ↑ Scott M.Lippman, Eric A.Klein et ai.: Seleenin ja E -vitamiinin vaikutus eturauhassyövän ja muiden syöpien riskiin. Julkaisussa: JAMA . 301, 2009, s.39 , doi: 10.1001 / jama.2008.864 .
- ↑ Marco Vinceti et ai.: Seleeni syövän ehkäisyyn. Julkaisussa: Cochrane Database of Systematic Reviews . , doi: 10.1002 / 14651858.CD005195.pub4 .
- ↑ Gabriele Dennert, Markus Horneber: Seleeni kemoterapian, sädehoidon ja leikkauksen sivuvaikutusten lievittämiseen syöpäpotilailla. Julkaisussa: Cochrane Database of Systematic Reviews. 2017, doi: 10.1002 / 14651858.CD005037.pub2 .
- ↑ Reinhard Saller et ai.: Seleenin kliinisestä merkityksestä: järjestelmällinen katsaus. Julkaisussa: Swiss Journal for Holistic Medicine , 19. kesäkuuta 2007, s. 333–340.
- ↑ Karen Rees, Louise Hartley, Camilla Day, Nadine Flowers, Aileen Clarke, Saverio Stranges: seleenilisä sydän- ja verisuonitautien ensisijaiseen ehkäisyyn. Julkaisussa: Cochrane Database of Systematic Reviews. 2013, doi: 10.1002 / 14651858.CD009671.pub2 .
- ^ S.Stranges, JR Marshall, R.Natarajan, RP Donahue, M.Trevisan, GF Combs, FP Cappuccio, A.Ceriello, ME Reid: Pitkäaikaisen seleenilisän vaikutukset tyypin 2 diabetekseen . Julkaisussa: Annals of Internal Medicine . nauha 147 , ei. 4 , 2007, s. 217 .
- ↑ Seleeni-altistus ja tyypin 2 diabeteksen riski: järjestelmällinen katsaus ja meta-analyysi . Julkaisussa: European Journal of Epidemiology . nauha 33 , ei. 9 , 2018, s. 789-810 . doi: 10.1007 / s10654-018-0422-8
- ↑ G.Schwedt: Analyyttinen kemia . Thieme Verlag, Stuttgart 1995, s. 197 .
- ^ JE Oldfield: Selenium: Historiallinen näkökulma. Julkaisussa: DL Hatfield, MJ Berry, VN Gladyshev (toim.): Selenium. 2006, Springer, Boston, MA., ISBN 978-0-387-33826-2 , s.1-6.
- ↑ Cornelia A.Schlieper: Seleeni. Julkaisussa: Cornelia A.Schlieper: Ravitsemuksen peruskysymyksiä. Kustantaja Dr. Felix Büchner, 2000, ISBN 3-582-04475-0 .
- ^ Robert M. Russell (saksankielinen painos: Hans -Joachim F. Zunft): Vitamiinit ja hivenaineet - puute ja ylimäärä. Julkaisussa: Manfred Dietel, Joachim Dudenhausen, Norbert Suttorp (toim.): Harrisonin sisäinen lääketiede . Berliini 2003, ISBN 3-936072-10-8 .
- ↑ Alain Krief, Michel Derock: Dislelenidien ja selenidien synteesi alkuaine seleenistä. Julkaisussa: Tetrahedron Letters . 43, 2002, s. 3083-3086, doi: 10.1016 / S0040-4039 (02) 00277-0 .
- ^ J. Beck: Sormukset, häkit ja ketjut - Kalkogeenien polykationien rikas rakenteellinen kemia. Julkaisussa: Coordination Chemistry Reviews . 163, 1997, s. 55-70, doi: 10.1016 / S0010-8545 (97) 00009-X .
















![{\ displaystyle \ mathrm {17 \ Se \ + \ 2 \, WCl_ {6} \ longrightarrow \ Se_ {17} [WCl_ {6}] _ {2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d84d24044480db3d71f417b3215a28035951a6e)
![{\ displaystyle \ mathrm {7 \ Se \ + \ SeCl_ {4} \ + \ 8 \ BiCl_ {3} \ longrightarrow \ Se_ {8} [Bi_ {4} Cl_ {14}] _ {2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3cb0faa868c47614d949e63102c492234888d14b)

