Berkelium
| ominaisuudet | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Yleisesti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nimi , symboli , atominumero | Berkelium, Bk, 97 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementtiluokka | Aktinidit | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ryhmä , jakso , lohko | Ac , 7 , f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Katso | hopeanhohtoinen valkoinen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-numero | 7440-40-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomi | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomimassa | 247 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomisäde | 170 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronikonfiguraatio | [ Rn ] 5 f 9 7 s 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisointienergia | 6..19785 (25) eV ≈ 598 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisointienergia | 11.9 (4) eV ≈ 1 150 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisointienergia | 21.6 (4) eV ≈ 2 080 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisointienergia | 36.0 (4) eV ≈ 3 470 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisointienergia | 56.0 (1,9) eV ≈ 5 400 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyysisesti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyysinen tila | tiukasti | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallirakenne | kuusikulmainen | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| tiheys | 14,78 g cm -3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sulamispiste | 1259 K (986 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molaarinen tilavuus | 16,84 · 10 −6 m 3 · mol −1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiallisesti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hapetustilat | +3 , +4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normaali potentiaali | −2,00 V (Bk 3+ + 3 e - → Bk) −1,08 V |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegatiivisuus | 1.30 ( Pauling-asteikko ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotoopit | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Katso muut isotoopit isotooppiluettelosta | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vaara- ja turvallisuustiedot | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Radioaktiivinen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Mahdollisuuksien mukaan ja tapana käytetään SI-yksiköitä . Ellei toisin mainita, annetut tiedot koskevat vakio-olosuhteita . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Berkelium on keinotekoisesti tuotettu kemiallinen alkuaine kanssa elementti symboli Bk ja atomiluku 97. jaksollisen se on ryhmä aktinidien ( 7 aikana , f-lohko ) ja on myös yksi transuraanien . Berkelium nimettiin kaupungin Berkeley , Kalifornia , jossa se havaittiin. Berkelium on radioaktiivinen metalli, jolla on hopeanvalkoinen ulkonäkö. Se luotiin ensimmäisen kerran joulukuussa 1949 kevyemmästä elementistä americium . Sitä tuotetaan pieninä määrinä ydinreaktoreissa . Sitä käytetään pääasiassa korkeampien transuraanisten alkuaineiden ja transaktinidien tuottamiseen .
historia
Aivan kuten americium (atominumero 95) ja kurium (96) löydettiin melkein samanaikaisesti vuosina 1944 ja 1945, alkuaineet berkelium (97) ja californium (98) löydettiin samalla tavalla vuosina 1949 ja 1950 .
Kokeen Glenn T. Seaborg , Albert Ghiorso ja Stanley G. Thompson tuottanut ensimmäisen hylsyjen 60 tuuman syklotroni on University of California at Berkeleyn 19. joulukuuta 1949 . Se oli viides löydetty Transuran. Löytö julkaistiin samaan aikaan kuin Californium.
Nimen valinta seurasi ilmeisesti yleistä alkuperää: Berkelium nimettiin paikasta, josta se löydettiin, Berkeleyn kaupungista Kaliforniassa . Nimitys seuraa siis kuten monien aktinidien ja lantanoidien kohdalla : Terbium , joka on jaksollisessa taulukossa täsmälleen Berkeliumin yläpuolella, nimettiin Ruotsin Ytterbyn kaupungin mukaan , josta se löydettiin ensimmäisen kerran: Elementille 97 ehdotetaan annettavan nimi berkelium (symboli Bk) Berkeleyn kaupungin mukaan samalla tavalla kuin käytettiin nimettäessä sen kemiallinen homologi terbium (atominumero 65), jonka nimi on peräisin Ruotsin Ytterbyn kaupungista, josta harvinaisten maametallien mineraalit löydettiin ensimmäisen kerran. Elementti 98 nimettiin Californiumiksi yliopiston ja Kalifornian osavaltion kunniaksi.
Vaikeimmat vaiheet alkuaineen valmistuksen valmistelussa osoittautuivat asianmukaisten kemiallisten erotusmenetelmien kehittämiseksi ja riittävän määrän amerikin tuottamiseksi kohdemateriaalille.
Näyte valmistettiin ensin levittämällä amerikkinitraattiliuosta ( isotoopin 241 Am kanssa) platinakalvoon; liuos haihdutettiin ja jäännös sitten kalsinoidaan oksidi (AMO 2 ).
Tätä näytettä pommitettiin sitten kiihdytetyillä a-hiukkasilla , joiden energia oli 35 MeV , noin 6 tunnin ajan 60 tuuman syklotronissa . Niin sanotussa (α, 2n) reaktiossa syntyy 243 Bk ja kaksi vapaata neutronia :
Pommituksen jälkeen syklotronissa päällyste liuotettiin ja kuumennettiin typpihapolla , saostettiin sitten jälleen hydroksidina väkevällä ammoniakin vesiliuoksella ja sentrifugoitiin; jäännös liuotettiin jälleen typpihappoon.
Amerikan laajamittaisen erottamisen aikaansaamiseksi ammoniumperoksodisulfaatin ja ammoniumsulfaatin seos lisättiin tähän liuokseen ja kuumennettiin liuenneen amerikin saattamiseksi +6- hapettumistasolle . Hapettumattomat jäljellä amerikiumia on saostettiin kuten amerikiumia (III) fluoridi lisäämällä fluorivetyhappoa . Tällä tavoin mukana oleva kurium saostuu myös kurium (III) fluoridina ja odotettu alkuaine 97 (berkelium) berkelium (III) fluoridina . Tämä jäännös muutettiin hydroksidiksi käsittelemällä kaliumhydroksidiliuoksella , joka sitten liuotettiin perkloorihappoon sentrifugoinnin jälkeen .
Lisäerotus tapahtui sitruunahappo / ammoniumsitraattipuskurin läsnä ollessa heikosti happamassa väliaineessa ( pH ≈ 3,5) ioninvaihtimien kanssa korotetussa lämpötilassa.
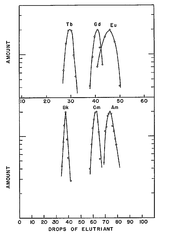
Kromatografinen erottaminen voi vain onnistua perusteella edellisen vertailuja kemiallinen käyttäytyminen vastaavan lantanoidit . Erotuksen yhteydessä terbium ilmestyy kolonnista ennen gadoliniumia ja europiumia . Jos berkeliumin kemiallinen käyttäytyminen on samanlainen kuin Eka-Terbiumin , kyseisen elementin 97 pitäisi siksi esiintyä ensin tässä vastaavassa asemassa vastaavasti ennen Curiumia ja Americiumia.
Kokeilun jatkaminen ei alun perin tuottanut tulosta, koska haettiin a-hiukkasia hajoamisen allekirjoitukseksi. Vain tyypillisten röntgensäteiden ja muunnoselektronien etsiminen elektronien sieppauksen tuloksena toi halutun menestyksen. Ydinreaktion tulokseksi ilmoitettiin 243 Bk, vaikka alun perin ajateltiin 244 Bk olevan mahdollista.
Vuonna 1958, Burris B. Cunningham ja Stanley G. Thompson eristetty ensimmäistä kertaa weighable määriä, jotka oli muodostettu pitkän aikavälin neutronisäteilytyksen 239 Pu testissä reaktorin National Reactor Testing Station in Idaho .
Isotoopit
Berkeliumissa on vain radionuklideja eikä stabiileja isotooppeja . Elementin tunnetaan yhteensä 12 isotooppia ja 5 ydinisomeeriä . Pisin elämä on 247 Bk ( puoliintumisaika 1380 vuotta), 248 Bk (9 vuotta) ja 249 Bk (330 päivää). Jäljellä olevien isotooppien puoliintumisaika vaihtelee millisekunneista tunteihin tai päiviin.
Jos otetaan pois esimerkiksi pisinikäisen isotoopin 247 Bk hajoaminen , niin pitkäikäinen 243 Am muodostuu aluksi α-hajoamisesta , joka puolestaan muuttuu 239 Np : ksi uudistetun α-hajoamisen kautta . Seuraava hajoaminen johtaa sitten 239 Pu: n kautta 235 U: aan, uraani-aktinium-sarjan alkuun (4 n + 3).
- Annetut ajat ovat puoliintumisaikoja.
→ Berkelium-isotooppien luettelo
Esiintyminen
Berkelium-isotooppeja ei esiinny luonnollisesti maapallolla, koska niiden puoliintumisaika on liian lyhyt verrattuna maan ikään.
Ensimmäisen Einsteinium- ja Fermium- löydön lisäksi ensimmäisen amerikkalaisen vetypommin, Ivy Mike -jäännöksistä 1. marraskuuta 1952 Eniwetokin atollilla löydettiin plutoniumin ja americiumin lisäksi kuriumin, berkeliumin ja kaliforniumin isotooppeja, mukaan lukien 249 Bk, muuntaa ja 249 Cf , jonka β-hajoaminen . Sotilasalaisuuden vuoksi tulokset julkaistiin vasta myöhemmin vuonna 1956.
Ydinreaktorissa Berkelium-isotooppi 249 Bk tuotetaan pääasiassa ; se hajoaa melkein kokonaan Californium- isotoopille 249 Cf puoliintumisajalla 351 vuotta välivarastossa (ennen loppusijoitusta) . Tämä lasketaan transuraanijätteeksi, joten se ei ole toivottavaa loppusijoituksessa.
Uuttaminen ja esittely
Berkeliumia tuotetaan pommittamalla kevyempiä aktinideja neutroneilla ydinreaktorissa . Päälähde on 85 MW: n korkea-isotooppireaktori (HFIR) Oak Ridgen kansallisessa laboratoriossa Tennessee, USA: ssa, joka on perustettu transkuriumelementtien tuotantoon (Z> 96).
Berkelium-isotooppien uuttaminen
Berkeliumia muodostuu ydinreaktoreissa uraanista ( 238 U) tai plutoniumista ( 239 Pu) lukuisien peräkkäisten neutronien sieppausten ja β-hajoamisen kautta - lukuun ottamatta fissiota tai α-hajoamista.
Tärkeä vaihe tässä on (n, γ) - tai neutronien sieppausreaktio, jossa syntynyt viritetty tytärnuklidi muuttuu perustilaan lähettämällä y-kvantti . Tähän tarvittavat vapaat neutronit syntyvät muiden reaktorin ytimien fissiolla . Tässä ydin- kemiallinen prosessi, 239 Pu muodostetaan ensin (n, γ) reaktio, jota seuraa kaksi β - hajoaa . In hyötöreaktori , tätä menetelmää käytetään inkuboitua uutta hajoavan materiaalin.
- Annetut ajat ovat puoliintumisaikoja.
Tätä tarkoitusta varten jälkimmäinen säteilytetään neutronilähteellä, jolla on korkea neutronivirta . Tällöin mahdolliset neutronivirrat ovat monta kertaa suuremmat kuin ydinreaktorissa. Alkaen 239 Pu, neljä peräkkäistä (n, γ) reaktiot muodostavat 243 Pu, joka hajoaa 243 Am kautta β-hajoaminen, jossa puoli-elämän 4,96 tuntia . Lisäreaktion (n, y) muodostama 244 Am hajoaa vuorostaan 244 Cm : n p-hajoamisella, jonka puoliintumisaika on 10,1 tuntia . Alkaen 244 cm, edelleen (n, γ) reaktioita reaktorissa tuottaa seuraavan raskaammilla isotoopeilla, pienempiä ja pienempiä määriä.
Tällä tavalla 250 cm: n muodostuminen tällä tavalla on kuitenkin hyvin epätodennäköistä, koska 249 cm: llä on vain lyhyt puoliintumisaika, joten neutronien lisäsieppaukset ovat epätodennäköisiä lyhyessä ajassa.
249 Bk on ainoa berkeliumin isotooppi, joka voidaan muodostaa tällä tavalla. Se muodostuu β-hajoamisesta 249 cm: stä - ensimmäinen curium-isotooppi, jolle tapahtuu β-hajoaminen (puoliintumisaika 64,15 min).
Neutronien sieppauksella muodostuu 250 Bk 249 Bk: sta , mutta tämä hajoaa jo puoliintumisajalla 3,212 tuntia β-hajoamisen kautta 250 Cf: iin.
Pitkäikäisintä isotooppia, 247 Bk, ei siksi voida tuottaa ydinreaktoreissa, joten usein on tyydyttävä helpommin käytettävissä olevaan 249 Bk: seen. Berkeliumia on saatavana maailmanlaajuisesti vain hyvin pieninä määrinä, minkä vuoksi sen hinta on erittäin korkea. Tämä on noin 185 Yhdysvaltain dollaria mikrogrammaa kohden 249 Bk.
Isotooppi 248 Bk tuotettiin vuonna 1956 kuriuminuklidien seoksesta pommittamalla 25 MeV a-hiukkasilla. Sen olemassaolo ja sen puoliintumisaika 23 ± 5 tuntia määritettiin β-hajoamistuotteella 248 Vrt.
247 Bk tuotettiin vuonna 1965 244 cm: stä pommittamalla sitä a-hiukkasilla. Mahdollisesti luotua isotooppia 248 Bk ei voitu havaita.
Berkelium-isotooppi 242 Bk luotiin vuonna 1979 pommittamalla 235 U 11 B: llä, 238 U 10 B: llä ja 232 Th 14 N: lla ja 15 N: lla . Se muuntuu 242 cm : ksi sieppaamalla elektroneja puoliintumisajalla 7,0 ± 1,3 minuuttia . Alun perin epäillyn isotoopin 241 Bk etsiminen epäonnistui.
Alkeisberkeliumin kuvaus
Ensimmäinen näytteet berkelium metalli oli valmistettu päässä tantaali vuonna 1969 vähentämällä BKF 3 1000 ° C: ssa litium- reaktiossa laitteet.
Alkuaineanalyysi berkelium voidaan valmistaa myös BKF 4 litiumin tai vähentämällä BKO 2 kanssa lantaanin tai toriumia .
ominaisuudet
Kun jaksollisen , Berkelium atomi numero 97 on sarjassa aktinidien, sen edeltäjä on Curium , seuraava elementti on Californium . Sen analoginen että lantanidi sarjassa on terbium .
Fyysiset ominaisuudet
Berkelium on radioaktiivinen metalli, jolla on hopeanvalkoinen ulkonäkö ja sulamispiste 986 ° C.
Muutos α-Bk esiintyvät alle standardi olosuhteissa kiteytyy kuusiokulmiokiderakenteita järjestelmä on tilaa ryhmä P 6 3 / MMC (space ryhmä ei. 194) kanssa hilaparametrien = 341,6 ± 0,3 pm ja c = 1106,9 ± 12:07 sekä neljä kaava yksikköä kohti yksikköä solu , metallia säde 170 nm, ja jonka tiheys on 14,78 g / cm 3 . Kiderakenne koostuu kahden kuusikulmainen lähellä pakkaus pallojen (ts HCP), jossa kerroksen sekvenssin ABAC ja on siksi isotyyppiset rakenteen α-La .
Korkeammissa lämpötiloissa a-Bk muuttuu β-Bk: ksi. Β-muutos kiteytyy kidekuution järjestelmä tilaryhmässä Fm 3 m (nro 225), jossa hilaparametrin = 499,7 ± 12:04, metallia säde 177 nm, ja jonka tiheys on 13,25 g / cm 3 . Kiteinen rakenne koostuu kuutiomaisesta lähinnä pallojen pakkaamisesta pinontasekvenssillä ABC, joka vastaa kasvokeskeistä kuutiohilaa (fcc).
Entalpia on liuos on berkelium metallin suolahappoa vakio-olosuhteissa on -600,2 ± 5,1 kJ mol -1 . Tämän perusteella arvon, standardi entalpia muodostumisen (Δ f H 0 ) on laskettu ensimmäisen kerran alkaen Bk 3+ (aq) ja -601 ± 5 kJ mol -1 ja standardi mahdollinen Bk 3+ / Bk 0 ja - 2,01 ± 0, 03 V.
70 K ja huoneenlämpötilassa, Berkelium käyttäytyy kuin Curie-Weiss paramagnet tehokas magneettinen momentti 9,69 Bohrin magnetons (μ B ) ja Curie-piste on 101 K. Kun on jäähdytetty noin 34 K, Berkelium kokee siirtymistä anti -ferromagneettinen tila. Tämä magneettinen momentti lähes vastaa teoreettista arvoa 9,72 μ B .
Kemialliset ominaisuudet
Kuten kaikki aktinidit, Berkelium on hyvin reaktiivinen. Se ei kuitenkaan reagoi nopeasti hapen kanssa huoneenlämpötilassa, mahdollisesti johtuen suojaavan oksidikerroksen muodostumisesta. Se kuitenkin reagoi sulojen metallien, vedyn, halogeenien, kalkogeenien ja pentelidien kanssa muodostaen erilaisia binaarisia yhdisteitä.
Kolmiarvoinen hapetustila on stabiilin vesiliuoksessa , mutta tunnetaan myös neliarvoisia ja kaksiarvoisia yhdisteitä. Vesiliuoksilla, joissa on Bk 3+ -ioneja, on keltainen-vihreä väri, Bk 4+ -ionien kanssa ne ovat suolahappoliuoksessa beigenvärisiä ja rikkihappoliuoksessa oranssinkeltaiset. Samanlainen ongelma voi olla havaita sen lantanidi analogisen terbium .
Bk 3+ -ioneilla on kaksi terävää fluoresenssihuippua aallonpituudella 652 nm (punainen valo) ja 742 nm (tummanpunainen - lähellä infrapuna) johtuen f-elektronikuoren sisäisistä siirtymistä.
Pilkkominen
Toisin kuin naapurielementit kurium ja kalifornium, berkelium soveltuu teoriassa vain erittäin huonosti ydinpolttoaineeksi reaktorissa. Hyvin alhaisen saatavuuden ja siihen liittyvän korkean hinnan lisäksi komplikaatio on, että halvemmilla, tasaisella massa- isotoopeilla on vain lyhyt puoliintumisaika. Ainoa mahdollinen parillinen isotooppi, 248 Bk perustilassa, on hyvin vaikea tuottaa, ja sen poikkileikkauksista ei ole riittävästi tietoa .
Periaatteessa 249 Bk pystyy ylläpitämään ketjureaktiota ja soveltuu siksi pikareaktoriin tai atomipommiin. Lyhyt 330 päivän puoliintumisaika yhdessä monimutkaisen uuttamisen ja suuren kysynnän kanssa estävät vastaavat yritykset. Taamalla kriittinen massa on 192 kg, veden kanssa heijastimen vielä 179 kg, moninkertainen maailman vuotuinen tuotanto.
247 Bk voi ylläpitää ketjureaktiota sekä lämpöreaktorissa että nopeassa reaktorissa, ja sillä on 1380 vuotena riittävän pitkä puoliintumisaika toimiakseen sekä ydinpolttoaineena että halkeamiskelpoisena materiaalina atomipommia . Sitä ei kuitenkaan voida inkuboida reaktorissa, ja sen valmistaminen on siksi vielä monimutkaisempaa ja kalliimpaa kuin muiden mainittujen isotooppien. Tähän liittyy vielä alhaisempi käytettävyys, jota vaaditun vähintään 35,2 kg: n massan (kriittinen massa teräsheijastimella) perusteella voidaan pitää poissulkemisperusteena.
käyttää

Berkelium-isotooppien käyttö tapahtuu pääasiassa tieteellisessä perustutkimuksessa. 249 Bk on yleinen nuklidi vielä raskaampien transuraanisten alkuaineiden ja transaktinoidien , kuten lawrenciumin , rutherfordiumin ja boriumin, synteesiin . Se toimii myös lähteenä isotoopille 249 Cf, joka mahdollistaa Kalifornian kemian tutkimisen. Sillä on etusija radioaktiivisempaan 252 Cf: hen nähden, jota muuten tuotetaan neutronipommituksella suurvuoksisotooptireaktorissa (HFIR).
22 milligramman 249 Bk: n näyte tehtiin 250 päivän säteilytyksellä vuonna 2009 ja puhdistettiin sitten 90 päivän prosessilla Oak Ridgessä. Tämä näyte johti ensimmäisen 6 atomia elementin Tenness on Yhdistyneessä Institute for Nuclear Research (JINR), Dubna , Venäjä, altistumisen jälkeen kalsiumionien U400 syklotronin varten 150 päivä. Tämä synteesi oli huipentuma Venäjän ja Amerikan yhteistyölle JINR: n ja Lawrence Livermoren kansallisen laboratorion välillä elementtien 113-118 synteesissä, joka alkoi vuonna 1989.
linkkejä
→ Luokka: Berkeliumyhdiste
Vaikka isotoopilla 247 Bk on pisin puoliintumisaika, isotoopilla 249 Bk on helpommin saavutettavissa ja sitä käytetään pääasiassa kemiallisten ominaisuuksien määrittämiseen.
Oksidit
Berkelium on oksideja ja hapetustiloissa +3 (Bk 2 O 3 ) ja +4 (BKO 2 ).
Berkelium (IV) oksidia (BKO 2 ) on ruskeana kiinteänä aineena ja kiteytyy kidekuution järjestelmä on fluoriittirakennetta on avaruusryhmässä Fm 3 m (tila ryhmä ei. 225) kanssa koordinoinnin numerot Cf [8], O [4 ]. Hilaparametri on 533,4 ± 0,5 pm .
Berkelium (III) oksidi (Bk 2 O 3 ) on valmistettu BKO 2 pelkistämällä vedyllä:
Se on kellanvihreä kiinteä aine, jonka sulamispiste on 1920 ° C. Se muodostaa kehokeskeisen kuutioisen kristallihilan, jonka a = 1088,0 ± 0,5 pm.
Halogenidit
Halideilla tiedetään olevan +3 ja +4 hapettumistilat. Vakain taso +3 tunnetaan kaikille yhdisteille fluorista jodiin ja se on stabiili myös vesiliuoksessa. Neliarvoinen taso voidaan stabiloida vain kiinteässä faasissa.
| Hapettumisnumero | F. | Cl | Br | I. |
| +4 |
Berkelium (IV) fluori BkF 4 kelta-vihreä |
|||
| +3 |
Berkelium (III) fluori BkF 3 kelta-vihreä |
Berkelium (III) kloridi BkCl 3 vihreä |
Berkelium (III) bromidi BkBr 3 kelta-vihreä |
Berkelium (III) jodidi BkI 3 keltainen |
Berkelium (IV) fluoridi (BKF 4 ) on keltainen-vihreä ioni yhdiste ja kiteytyy monokliinisen kiderakenteen järjestelmä ja on isotyypin kanssa uraani (IV) fluoridi .
Berkelium (III) fluoridi (BKF 3 ) on kellanvihreä kiinteä aine, ja on kaksi kiteistä rakenteita, jotka ovat lämpötilasta riippuva (muutos lämpötila: 350-600 ° C). Ortorombinen rakenne ( YF 3 -tyyppi ) löytyy matalista lämpötiloista . Korkeammissa lämpötiloissa se muodostaa trigonaalisen järjestelmän ( LaF 3 -tyyppi ).
Berkelium (III) kloridi (BkCl 3 ) on vihreä kiinteä aine, jonka sulamispiste on 603 ° C ja kiteytyy kuusiokulmiokiderakenteita järjestelmä . Sen kiderakenne on isotyyppiä uraani (III) kloridi (UCL 3 ). Heksahydraattina (BkCl 3 · 6 H 2 O) on monokliininen kiderakenne.
Berkelium (III) bromidi (BkBr 3 ) on kellanvihreä kiinteä aine ja kiteytettiin matalassa lämpötilassa pUBR 3 tyyppi , korkeammissa lämpötiloissa AICI 3 tyyppinen .
Berkelium (III) jodidin (BKI 3 ) on keltaista kiinteää ainetta ja kiteytyy kuusikulmainen järjestelmä ( bii 3 tyyppi ).
Oksyhalideilla BkOCl, BkOBr ja BkOI on tetragonaalinen rakenne, joka on PbFCl-tyyppinen.
Kalkogenidit ja pentelidit
Berkelium (III) sulfidi (Bk 2 S 3 ) valmistettiin joko käsittelemällä berkelium (III) oksidi, jossa on seosta, rikkivetyä ja rikkihiiltä 1130 ° C: ssa, tai suoraan saattamalla metallinen berkelium rikin kanssa. Tämä johti ruskeanmustiin kiteisiin, joiden kuutiosymmetria ja hilavakio a = 844 pm.
Pentelids on Berkelium ( 249 Bk) ja BKX tyyppi on esitetty elementtien typpeä , fosforia , arseenia ja antimonia . Niitä tuotetaan reaktiolla joko berkelium (III) hydridiä (BKH 3 ) tai metallinen berkelium näiden elementtien korotetussa lämpötilassa suurtyhjössä kvartsi ampulleissa. Ne kiteytyvät NaCl-hilassa hilavakioiden kanssa 495,1 pm BkN: lle, 566,9 pm BkP: lle, 582,9 pm BkA: lle ja 619,1 pm BkSb: lle.
Muut epäorgaaniset yhdisteet
Berkelium (III) - ja berkelium (IV) -hydroksidi ovat molemmat stabiileja suspensiona 1 M natriumhydroksidiliuoksessa ja ne tutkittiin spektroskopisesti. Berkelium (III) -fosfaatti (BkPO 4 ) esitettiin kiinteänä aineena, joka osoittaa voimakasta fluoresenssia argonlaserilla (514,5 nm oleva linja) viritettynä.
Muut berkeliumin suolat tunnetaan, esim. B. Bk 2 O 2 S, (BKNO 3 ) 3 · 4 H 2 O, BkCl 3 · 6 H 2 O, Bk 2 (SO 4 ) 3 · 12 H 2 O ja Bk 2 (C 2 O 4 ) 3 · 4 H 2 O. lämpöhajoamisen argonatmosfäärissä n. 600 ° C (hapettumisen välttämiseksi on BKO 2 ) Bk 2 (SO 4 ) 3 12 H 2 O johtaa kehon keskitetty ortorombisen kiteitä Berkelium (III) - oxysulfate (Bk 2 O 2 SO 4 ). Tämä liitäntä on lämpöstabiili vähintään 1000 ° C: seen suojakaasun alla.
Berkeliumhydridit valmistetaan saattamalla metalli reagoimaan vetykaasun kanssa yli 250 ° C: n lämpötilassa. Ne muodostavat ei-stökiömetrisiä koostumuksia nimelliskaavalla BkH2 + x (0 <x <1). Vaikka trihydrideillä on kuusikulmainen symmetria, dihydridi kiteytyy fcc- rakenteeseen hilavakion a = 523 pm kanssa.
Organometalliset yhdisteet
Berkelium muodostaa trigonaalinen (η 5 -C 5 H 5 ) 3 Bk kompleksin kolme syklopentadienyylirengasta , joka voidaan syntetisoida saattamalla berkelium (III) kloridi sulalla Be (C 5 H 5 ) 2 noin 70 ° C: ssa Se on keltainen väri ja ortorombisen symmetrian kanssa hilavakiot = 1411 pm, b = 1755 pm ja c = 963 pm ja laskettu tiheys 2,47 g / cm 3 . Kompleksi on stabiili vähintään 250 ° C: seen asti ja sublimoituu noin 350 ° C: ssa. Korkea radioaktiivisuus aiheuttaa kuitenkin yhteyksien nopean tuhoutumisen muutamassa viikossa. A C 5 H 5 rengas (η 5 -C 5 H 5 ), 3 Bk voidaan korvata kloorilla, dimeerinen [Bk (C 5 H 5 ) 2 : lla] 2 on muodostettu. Optinen absorptiospektri tämä yhdiste on hyvin samankaltainen (η 5 -C 5 H 5 ) 3 Bk.
turvallisuusohjeet
CLP-asetuksen mukaisia luokituksia ei ole saatavilla, koska ne sisältävät vain kemiallisen vaaran ja niillä on täysin toissijainen asema verrattuna radioaktiivisuuteen liittyviin vaaroihin. Jälkimmäistä sovelletaan myös vain, jos kyseessä olevan aineen määrä on merkityksellinen.
kirjallisuus
- David E. Hobart ja Joseph R. Peterson: Berkelium ; julkaisussa: Lester R. Morss, Norman M. Edelstein, Jean Fuger (toim.): Actinide and Transactinide Elements , Chemistry of Spray , Dordrecht 2006; ISBN 1-4020-3555-1 , sivut 1444-1498 ( doi: 10.1007 / 1-4020-3598-5_10 ).
- Gmelinin epäorgaanisen kemian käsikirja , järjestelmä nro 71, transuraani: osa A 1 I, s. 38-40; Osa A 1 II, s. 19, 326-336; Osa B1, s. 72-76.
- Bk 3+: n liuoksen absorptiospektri ja berkeliumdioksidin, seskvioksidin, trikloridin, oksikloridin ja trifluoridin , Ph.D. Opinnäytetyö, Joseph Richard Peterson, lokakuu 1967, USA: n atomienergiakomission asiakirjanumero UCRL-17875 (1967).
- JR Peterson, DE Hobart: Berkeliumin kemia ; julkaisussa: Harry Julius Emeleus (Toim.): Advances in epäorgaaninen kemia ja radiokemia , osa 28, Academic Press, 1984, ISBN 0-12-023628-1 , s.29-64 ( doi: 10.1016 / S0898-8838 (08) 60204-4 , rajoitettu esikatselu Google- teoshaulla ).
- GT Seaborg (Toim.): Elementtien 97 ja 98 löytämisen 25. vuosipäivän kunniaksi järjestetyn symposiumin kokoukset , 20. tammikuuta 1975; Raportti LBL-4366, heinäkuu 1976.
nettilinkit
- Sisäänpääsy Berkeliumiin. Julkaisussa: Römpp Online . Georg Thieme Verlag, käyty 3. tammikuuta 2015.
- Amanda Yarnell: Berkelium , Chemical & Engineering News, 2003.
Yksittäiset todisteet
- ↑ Atomi- ja fysikaalisten ominaisuuksien (tietoruutu) arvot on otettu, ellei toisin mainita: David E. Hobart ja Joseph R. Peterson: Berkelium . Toim.: Lester R.Morss, Norman M.Edelstein, Jean Fuger. Springer, Dordrecht 2006, ISBN 1-4020-3555-1 , s. 1444–1498 , doi : 10.1007 / 1-4020-3598-5_10 ( nevada.edu [PDF; käytetty 30. maaliskuuta 2019]).
- ↑ a b c d e merkintä berkeliumista Kramidassa, A., Ralchenko, Yu., Reader, J. ja NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Toim.: NIST , Gaithersburg, MD. doi : 10.18434 / T4W30F ( https://physics.nist.gov/asd ). Haettu 13. kesäkuuta 2020.
- ↑ a b c d e merkintä berkeliumista osoitteessa WebElements, https://www.webelements.com , käyty 13. kesäkuuta 2020.
- ↑ a b Hobart, Peterson (2006), s.1482.
- ↑ b c d G. Audi, O. Bersillon, J. Blachot, AH Wapstra: NUBASE arviointi ydin- ja vaimenemisominaisuudet ; julkaisussa: Nuclear Physics A , 2003 , 729 (1), s. 3–128. doi: 10.1016 / j.nuclphysa.2003.11.001 . ( PDF ; 1,0 Mt).
- ↑ Radioaktiivisuuden aiheuttamat vaarat eivät kuulu ominaisuuksiin, jotka luokitellaan GHS-merkintöjen mukaan. Muiden vaarojen osalta tätä elementtiä ei ole vielä luokiteltu tai luotettavaa ja mainittavaa lähdettä ei ole vielä löydetty.
- ^ SG Thompson, A. Ghiorso, GT Seaborg: Elementti 97 ; julkaisussa: Physical Review , 1950 , 77 (6), s. 838-839 ( doi: 10.1103 / PhysRev.77.838.2 ).
- B a b c S.G.Thompson, A.Ghiorso, GT Seaborg: Berkeliumin uusi elementti (atominumero 97) ; julkaisussa: Physical Review , 1950 , 80 (5), s. 781-789 ( doi: 10.1103 / PhysRev.80.781 ; Maschinoscript (26. huhtikuuta 1950) (PDF; 1,8 MB)).
- ^ A b Stanley G.Thompson , Glenn T.Seaborg: Berkeliumin kemialliset ominaisuudet ( doi: 10.2172 / 932812 ; tiivistelmä ; konekirjoitus (24. helmikuuta 1950) ).
- B a b S.G.Thompson, BB Cunningham, GT Seaborg: Berkeliumin kemialliset ominaisuudet ; julkaisussa: J. Am. Chem. Soc. , 1950 , 72 (6), s. 2798-2801 ( doi: 10.1021 / ja01162a538 ).
- ^ SG Thompson, BB Cunningham: Ensimmäiset makroskooppiset havainnot berkeliumin ja kaliforniumin kemiallisista ominaisuuksista , lisäys asiakirjaan P / 825, joka esitettiin toisessa kansainvälisessä rauhanomaisen käytön atomienergiakonferenssissa, Geneve, 1958.
- ^ PR Fields, MH Studier, H. Diamond, JF Mech, MG Inghram, GL Pyle, CM Stevens, S. Fried, WM Manning (Argonnen kansallinen laboratorio, Lemont, Illinois) ; A. Ghiorso, SG Thompson, GH Higgins, GT Seaborg (Kalifornian yliopisto, Berkeley, Kalifornia) : Transplutoniumelementit lämpöydinkokeissa ; julkaisussa: Physical Review , 1956 , 102 (1), s. 180-182 ( doi: 10.1103 / PhysRev.102.180 ).
- ^ High Flux -isotooppireaktori , Oak Ridgen kansallinen laboratorio; Haettu 23. syyskuuta 2010.
- ↑ SG Thompson, A. Ghiorso, BG Harvey, GR Choppin: Transcurium-isotoopit, jotka on tuotettu plutoniumin neutronisäteilytyksessä ; julkaisussa: Physical Review , 1954 , 93 (4), s. 908-908 ( doi: 10.1103 / PhysRev.93.908 ).
- ↑ LB Magnusson, MH Studier, PR-kentät, CM Stevens, JF Mech, AM Friedman, H. Diamond, JR Huizenga: Berkelium- ja Californium-isotoopit, jotka on tuotettu plutoniumin neutronisäteilytyksessä ; julkaisussa: Physical Review , 1954 , 96 (6), s. 1576-1582 ( doi: 10.1103 / PhysRev.96.1576 ).
- ^ TA Eastwood, JP Butler, MJ Cabell, HG Jackson (Atomic Energy of Canada Limited, Chalk River, Ontario, Kanada) ; RP Schuman, FM Rourke, TL Collins (Knolls Atomic Power Laboratory, Schenectady, New York) : Berkeliumin ja Californiumin isotoopit, jotka tuottavat neutronisäteilytys Plutonium ; julkaisussa: Physical Review , 1957 , 107 (6), s. 1635-1638 ( doi: 10.1103 / PhysRev.107.1635 ).
- ↑ Tietoa elementistä Berkelium osoitteessa www.speclab.com ( Memento 20. lokakuuta 2007 Internet-arkistossa ) (englanti) ; Haettu 22. syyskuuta 2008.
- ↑ EK Hulet: Berkeliumin uusi isotooppi ; julkaisussa: Physical Review , 1956 , 102 (1), s. 182-182 ( doi: 10.1103 / PhysRev.102.182 ).
- ↑ J. Milsted, AM Friedman, CM Stevens: Berkelium-247 : n alfa-puoliintumisaika; edellisen Berkelium-248: n uusi pitkäikäinen isomeeri ; julkaisussa: Nuclear Physics , 1965 , 71 (2), s. 299-304 ( doi: 10.1016 / 0029-5582 (65) 90719-4 ).
- ↑ Kimberly E. Williams, Glenn T. Seaborg: Uusi isotooppi 242 Bk ; julkaisussa: Physical Review C , 1979 , 19 (5), s. 1794-1800 ( doi: 10.1103 / PhysRevC.19.1794 ).
- B a b c J.R.Peterson, JA Fahey, RD Baybarz: Berkeliummetallin kristallirakenteet ja ristikkoparametrit ; julkaisussa: J. Inorg. Nucl. Chem. , 1971 , 33 (10), s. 3345-3351 ( doi: 10.1016 / 0022-1902 (71) 80656-5 ).
- ↑ JC Spirlet, JR Peterson, LB Asprey; julkaisussa: Advances in Inorganic Chemistry , osa 31 (toim. HJ Emeléus ja AG Sharpe), Academic Press, Orlando FL 1987, s. 1-41.
- ↑ J. Fuger, RG Haire, JR Peterson: Uusi määritys berkeliummetalliliuoksen entalpialle ja Bk 3+: n muodostumisen standardientalpialle (vesiliuos) ; julkaisussa: J. Inorg. Nucl. Chem. , 1981 , 43 (12), s. 3209-3212 ( doi: 10.1016 / 0022-1902 (81) 80090-5 ).
- ↑ SE Nave, PG Huray, RG Haire, julkaisussa: JE Crow, RP Guertin, TW Mihalisin (toim.): Crystalline Electric Field and Structural Effects in f-Electron Systems , Plenum, New York 1980, ISBN 0-306-40443- 5 , s. 269-274.
- B a b Peterson, Hobart (1984), s.45.
- ↑ a b Hobart, Peterson (2006), s.1460.
- ↑ Jim C.Sullivan, KH Schmidt, LR Morss, CG Pippin, C. Williams: Berkeliumin (III) pulssiradiolyysitutkimukset: Berkeliumin (II) valmistus ja tunnistaminen vesipitoisessa perkloraattiväliaineessa ; julkaisussa: Inorg. Chem. , 1988 , 27 (4), s. 597 - 598 ( doi: 10,1021 / ic00277a005 ).
- ^ AF Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 102. painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s.1956 .
- ↑ Peterson, Hobart (1984), s.55.
- ^ Hobart, Peterson (2006), s. 1472.
- ↑ Z. Assefa, RG Haire, NA Stump: Bk (III) : n emissioprofiili silikaattimatriisissa: poikkeava riippuvuus viritysvoimasta ; julkaisussa: Journal of Alloys and Compounds , 1998 , 271 - 273 , s. 854 - 858 ( doi: 10.1016 / S0925-8388 (98) 00233-3 ).
- ^ Rita Cornelis, Joe Caruso, Helen Crews, Klaus Heumann: Handbook of Elemental Speciation II: Species in Environment, Food, Medicine & Occupational Health , John Wiley and Sons, 2005, ISBN 0-470-85598-3 , s.552 ( rajoitettu esikatselu Google-teoshaulla).
- ↑ G.Pfennig, H.Klewe-Nebenius, W.Seelmann-Eggebert (toim.): Karlsruher Nuklidkarte , 7. painos, 2006.
- ↑ MB Chadwick, P. Oblozinsky, M. Herman al.: ENDF / B-VII.0: Next Generation Evaluated Nuclear Data Library for Nuclear Science and Technology ; julkaisussa: Nuclear Data Sheets , 2006 , 107 (12), s. 2931-3060 ( doi: 10.1016 / j.nds.2006.11.001 ).
- ^ AJ Koning et ai .: JEFF: n arvioima dataprojekti , Proceedings of the International Conference on Nuclear Data for Science and Technology, Nizza, 2007 ( doi: 10.1051 / ndata: 07476 ).
- ↑ a b Institut de Radioprotection et de Sûreté Nucléaire : Arvio ydinkriittisyysturvallisuustiedoista ja rajoituksista liikenteen aktinideille , s. 16 ( PDF ( Memento , 18. marraskuuta 2014, Internet-arkistossa )).
- ^ Lopuksi kohta 117 on täällä! , Tiede nyt , Haettu 7. huhtikuuta 2010.
- ↑ Hobart, Peterson (2006), s. 1445-1448.
- ^ Richard G. Haire: Californium ; julkaisussa: Lester R. Morss, Norman M. Edelstein, Jean Fuger (toim.): Actinide and Transactinide Elements , Chemistry of Spray , Dordrecht 2006; ISBN 1-4020-3555-1 , s. 1499-1576 ( doi: 10.1007 / 1-4020-3598-5_11 ).
- ↑ Yhteistyö laajentaa jaksollista taulukkoa, yksi elementti kerrallaan ( Memento , 18. heinäkuuta 2011 Internet-arkistossa ), Science and Technology Review, Lawrence Livermoren kansallinen laboratorio, lokakuu / marraskuu 2010.
- ↑ Nuclear Missing Link Created at Last: Superheavy Element 117 , Science daily , katsottu 7. huhtikuuta 2010.
- ↑ Joseph R. Peterson, Burris B.Cunningham: Elementin 97 joitain kemiallisia ominaisuuksia (UCRL-17337) ; julkaisussa: Trans. Amer. Nucl. Soc. , 1967 , 10 , s. 92-93 ( [1] ).
- ↑ JR Peterson, BB Cunningham: Berkelium I. -yhdisteiden kristallirakenteet ja ristikkoparametrit. Berkeliumdioksidi ja kuutioinen berkeliumseskvioksidi ; julkaisussa: Inorg. Nucl. Chem. Lett. , 1967 , 3 (9), s. 327-336 ( doi: 10.1016 / 0020-1650 (67) 80037-0 ).
- B a b R.D.Baybarz: Berkeliumoksidijärjestelmä ; julkaisussa: J. Inorg. Nucl. Chem. , 1968 , 30 (7), s. 1769-1773 ( doi: 10.1016 / 0022-1902 (68) 80352-5 ).
- ^ AF Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 102. painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s.1972 .
- ^ A b A.F. Holleman , E.Wiberg , N.Wiberg : Epäorgaanisen kemian oppikirja . 102. painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s.1969 .
- B a b D. D. Ensor, JR Peterson, RG Haire, JP Young: Berkelium (III) - ja (IV) -fluoridien imeytymispektrofotometrinen tutkimus kiinteässä tilassa ; julkaisussa: J. Inorg. Nucl. Chem. , 1981 , 43 (5), s. 1001 - 1003 (doi: 10.1016 / 0022-1902 (81) 80164-9 ).
- ↑ JR Peterson, BB Cunningham: Berkelium IV: n, berkeliumtrifluoridin yhdisteiden kristallirakenteet ja ristikkoparametrit ; julkaisussa: J. Inorg. Nucl. Chem. , 1968 , 30 (7), s. 1775-1784 ( doi: 10.1016 / 0022-1902 (68) 80353-7 ).
- ↑ JR Peterson, BB Cunningham: Berkelium II: n, berkeliumtrikloridin, yhdisteiden kristallirakenteet ja ristikkoparametrit ; julkaisussa: J. Inorg. Nucl. Chem. , 1968 , 30 (3), s. 823-828 ( doi: 10.1016 / 0022-1902 (68) 80443-9 ).
- ↑ JR Peterson, JP Young, DD Ensor, RG Haire: Berkelium-249: n ja Californium-249 : n trikloridien absorptiospektrofotometriset ja röntgendiffraktiotutkimukset ; julkaisussa: Inorg. Chem. , 1986 , 25 (21), s. 3779 - 3782 ( doi: 10,1021 / ic00241a015 ).
- ↑ John H.Burns, Joseph Richard Peterson: Amerikkitrikloridiheksahydraatin ja berkeliumtrikloridiheksahydraatin kristallirakenteet ; julkaisussa: Inorg. Chem. , 1971 , 10 (1), s. 147-151 ( doi: 10,1021 / ic50095a029 ).
- ↑ John H. Burns, JR Peterson, JN Stevenson: Kristallografinen tutkimukset Joidenkin transuranic trihalogenideilla: 239 PuCl 3 , 244 CMBR 3 , 249 BkBr 3 ja 249 CFBR 3 ; julkaisussa: J. Inorg. Nucl. Chem. , 1975 , 37 (3), s. 743-749 ( doi: 10.1016 / 0022-1902 (75) 80532-X ).
- ↑ Peterson, Hobart (1984), s.48.
- ^ Hobart, Peterson (2006), s. 1469.
- ^ RL Fellows, JP Young, RG Haire, julkaisussa: Transuraanielementtien fysikaalis-kemialliset tutkimukset (edistymisraportti huhtikuu 1976 - maaliskuu 1977) (toimittaja JR Peterson), Yhdysvaltain energiatutkimus- ja kehityshallinnon asiakirja ORO-4447-048, University of Tennessee, Knoxville, sivut 5-15.
- ↑ a b c Peterson, Hobart (1984), s.53.
- ^ Hobart, Peterson (2006), s. 1465, 1470.
- B a b c Hobart, Peterson (2006), s. 1470.
- ↑ b J. N. Stevenson, JR Peterson: valmistelu ja Rakenteelliset tutkimukset alkuaine Curium-248 ja nitridit Curium-248 ja Berkelium-249 ; julkaisussa: Journal of the Less Common Metals , 1979 , 66 (2), s. 201-210 ( doi: 10.1016 / 0022-5088 (79) 90229-7 ).
- ↑ D. Damien, RG Haire, JR Peterson: valmistelu ja Hila parametrit 249 Bk Monopnictides ; julkaisussa: J. Inorg. Nucl. Chem. , 1980 , 42 (7), s. 995-998 ( doi: 10.1016 / 0022-1902 (80) 80390-3 ).
- ^ Hobart, Peterson (2006), s. 1455.
- ↑ Peterson, Hobart (1984), s. 39-40.
- ↑ Hobart, Peterson (2006), s. 1470-1471.
- ↑ Peterson, Hobart (1984), s.47.
- B a b Peterson, Hobart (1984), s.54.
- ^ Hobart, Peterson (2006), s. 1463.
- ↑ Christoph Elschenbroich : Organometallchemie , 6. painos, Wiesbaden 2008, ISBN 978-3-8351-0167-8 , s.583-584.
- ↑ Peter G. Laubereau, John H. Burns: Berkeliumin, Californiumin ja joidenkin lantanidielementtien trisyklopentadienyyliyhdisteiden mikrokemiallinen valmistus ; julkaisussa: Inorg. Chem. , 1970 , 9 (5), s. 1091-1095 ( doi: 10.1021 / ic50087a018 ).
- ↑ PG Lauberau: disyklopentadienyylikarbeliumkloridin muodostuminen ; julkaisussa: Inorg. Nucl. Chem. Lett. , 1970 , 6 , s. 611-616 ( doi: 10.1016 / 0020-1650 (70) 80057-5 ).
- ^ Hobart, Peterson (2006), s. 1471.





![\ mathrm {^ {247} _ {\ 97} Bk \ \ xrightarrow [1380 \ a] {\ alpha} \ ^ {243} _ {\ 95} päällä \ \ xrightarrow [7370 \ a] {\ alpha} \ ^ {239} _ {\ 93} Np \ \ xrightarrow [2355 \ d] {\ beta ^ -} \ ^ {239} _ {\ 94} Pu \ \ xrightarrow [24110 \ a] {\ alpha} \ ^ {235 } _ {\ 92} U}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae4921d3479472c482947d24b4155288cadf4796)
![{\ mathrm {^ {{238}} _ {{\ 92}} U \ {\ xrightarrow {(n, \ gamma)}} \ _ {{\ 92}} ^ {{239}} U \ {\ xrightarrow [{23.5 \ min}] {\ beta ^ {-}}} \ _ {{\ 93}} ^ {{239}} Np \ {\ xrightarrow [{2.3565 \ d}] {\ beta ^ {-}} } \ _ {{\ 94}} ^ {{239}} Pu}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/00b6f3352024666bbfe7ef4deba05e694195bfdf)
![{\ mathrm {^ {{239}} _ {{\ 94}} Pu \ {\ xrightarrow {4 (n, \ gamma)}} \ _ {{\ 94}} ^ {{243}} Pu \ {\ xrightarrow [{4,956 \ h}] {\ beta ^ {-}}} \ _ {{\ 95}} ^ {{243}} päällä \ {\ xrightarrow {(n, \ gamma)}} \ _ {{\ 95}} ^ {{244}} Käytössä \ {\ xrightarrow [{10.1 \ h}] {\ beta ^ {-}}} \ _ {{\ 96}} ^ {{244}} cm}} \ quad; \ quad {\ mathrm {^ {{244}} _ {{\ 96}} cm \ {\ xrightarrow {5 (n, \ gamma)}} \ _ {{\ 96}} ^ {{249}} Cm} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/20fba3c3fea74c7ee348a8b3c4a336a79b1537cf)
![{\ mathrm {^ {{249}} _ {{\ 96}} cm \ {\ xrightarrow [{64.15 \ min}] {\ beta ^ {-}}} \ _ {{\ 97}} ^ {{249 }} Bk \ {\ xrightarrow [{330 \ d}] {\ beta ^ {-}}} \ _ {{\ 98}} ^ {{249}} Vrt.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a442eb6b9df6de89b3d39182cf49f3c45daaadc)
![{\ mathrm {^ {{249}} _ {{\ 97}} Bk \ {\ xrightarrow {(n, \ gamma)}} \ _ {{\ 97}} ^ {{250}} Bk \ {\ xrightarrow [{3,212 \ h}] {\ beta ^ {-}}} \ _ {{\ 98}} ^ {{250}} Vrt.}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d1ab240176cca76b16e7835a565f5b491a42cbc9)
![\ mathrm {^ {244} _ {\ 96} Cm \ \ xrightarrow [] {(\ alpha, n)} \ ^ {247} _ {\ 98} Cf \ \ xrightarrow [3.11 \ h] {\ epsilon} \ ^ {247} _ {\ 97} Bk}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d143fca53ec79d59a3a77098ed208112e6be6274)
![\ mathrm {^ {244} _ {\ 96} Cm \ \ xrightarrow [] {(\ alpha, p)} \ ^ {247} _ {\ 97} Bk}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3fd61edf5e167f75669fbc6a521bd8e01211e482)






