Kemiallinen reaktio
Kemiallinen reaktio on menetelmä, jossa yksi tai useampi kemiallisia yhdisteitä muunnetaan osaksi muita ja energia vapautuu tai absorboituu. Myös elementit voivat olla mukana reaktioissa. Kemialliset reaktiot ovat yleensä liittyy muutoksia kemiallisten sidosten on molekyylejä tai kiteitä . Koska kemiallinen reaktio, ominaisuuksia tuotteiden voi muuttua merkittävästi verrattuna lähtöaineita . Kemialliset reaktiot eivät sisällä fysikaalisia prosesseja, jotka fyysisen tilan muutoksia, kuten sulamis- tai haihduttamalla , diffuusio , sekoitus puhtaiden aineiden osaksi aineseoksia, ja ydinreaktiot jossa elementit muunnetaan toiset.
Reaktiot koostuvat yleensä melko monimutkaisesta yksittäisten alivaiheiden sarjasta, ns. Alkureaktioista , jotka yhdessä muodostavat kokonaisreaktion. Reaktiomekanismi antaa tietoa osavaiheiden tarkasta järjestyksestä . Käytettyjen reaktioyhtälöiden kuvaamiseen käytettävät kemialliset reaktiot on esitetty graafisesti lähtöaineissa, tuotteissa ja joskus tärkeissä välituotteissa sekä nuolen, toisiinsa yhdistettävän reaktionuolen kautta .
Sekä alkeisreaktiot että reaktiomekanismit voidaan jakaa eri ryhmiin. Perusreaktiot sisältävät yhden molekyylin hajoamisen kahdeksi tai päinvastoin, kahden atomin tai molekyylin synteesin yhdeksi. Reaktiomekanismit luokitellaan usein kyseessä olevien aineiden muutoksen mukaan. Jos hapetusmäärässä tapahtuu muutoksia , puhutaan hapetuksesta ja pelkistyksestä ; kiinteä tuote syntyy liuenneista aineista, saostumisesta .
Se, missä määrin tietty reaktio kahden tai useamman kumppanin välillä tapahtuu, riippuu tuotteiden ja koulutuksen Gibbs-energian erosta , joka koostuu entalpisesta ja entrooppisesta komponentista . Negatiivisilla arvoilla reaktiotasapaino on tuotteiden puolella. On kuitenkin myös monia reaktioita, jotka ovat termodynaamisesti mahdollisia tässä mielessä , mutta etenevät kineettisesti hyvin hitaasti, äärimmäisissä tapauksissa niin hitaasti, että niitä ei voida käytännössä havaita. Syynä tähän on liian korkea aktivointienergia , jota on käytettävä niin, että jatkuva reaktio on mahdollista. Tällaiset reaktiot tapahtuvat nopeammin korkeammissa lämpötiloissa, koska suhteellisen suurella määrällä mukana olevia hiukkasia on tarpeeksi energiaa aktivointibarmin voittamiseksi. Monissa reaktioissa tämä on mahdollista myös katalyysin avulla , jossa ei tapahdu suoraa reaktiota, vaan erilaista, johon liittyy kolmas aine, joka syntyy muuttumattomana reaktiosta. Tämän katalyytin läsnäolo vähentää tarvittavaa aktivointienergiaa.
historia
Kemialliset reaktiot, kuten palaminen on tulipalo , alkoholiksi tai vähentämiseen malmien metallien - esimerkiksi raudan tapauksessa - on tunnettu hyvin pitkään. Ensimmäisen teorioita muutosta aineiden kehitettiin kreikkalainen filosofit, esimerkiksi neljän elementin teoria on Empedokles , jonka mukaan jokaista ainetta koostuu neljästä peruselementit tulen, veden, ilman ja maan ja voidaan myös jakautuu nämä. Keskiajalla alkemistit olivat pääasiassa huolissaan kemiallisista reaktioista. Erityisesti, he yrittivät muuntaa johtaa osaksi kulta , käyttäen, muun muassa, reaktiot lyijyn ja lyijy-kupari seokset, joissa rikki .
Kemiallisten aineiden tuotanto, jota ei tapahdu luonnossa sopivien reaktioiden kautta, on jo pitkään tiedetty. Tämä koskee esimerkiksi rikkihappoa ja typpihappoa , joiden ensimmäinen tuotanto johtuu kiistanalaisesta alkemistista Jabir ibn Hayyanista . Se valmistettiin kuumentamalla sulfaatti- ja nitraattimalmeja, kuten vitrioli, aluna ja suolat. 1600-luvulla Johann Rudolph Glauber tuotti suolahappoa ja natriumsulfaattia ensimmäistä kertaa reagoimalla rikkihapon ja natriumkloridin kanssa . Kanssa kehityksen lyijykammiomenetelmä rikkihapon tuotantoon ja Leblanc prosessi varten natriumkarbonaatin tuotantoon, kemiallisia reaktioita käytettiin myös teollisesti. Teollisuuden lisääntyessä teollisen synteesin merkitys kasvoi ja kehitettiin uudempia ja tehokkaampia prosesseja. Esimerkkejä ovat kontaktiin rikkihapon tuotantoon, jota käytettiin 1870, tai Haber-Boschin menetelmä ja ammoniakin synteesiin on kehitetty vuonna 1910 .
1500-luvulta lähtien tutkijat, kuten Johan Baptista van Helmont , Robert Boyle tai Isaac Newton, yrittivät tutkia havaittuja kemiallisia muutoksia tieteellisesti ja perustaa teorioita prosessistaan. Tärkeä tutkittu reaktio oli palaminen , jolle Johann Joachim Becher ja Georg Ernst Stahl kehittivät flogistoniteorian 1700-luvun alussa . Tämä osoittautui kuitenkin vääräksi ja Antoine Lavoisier saattoi kumoaa sen vuonna 1785 , joka löysi oikean selityksen palamisesta reaktiona ilmassa olevan hapen kanssa.
Joseph Louis Gay-Lussac tunnusti vuonna 1808, että kaasut reagoivat aina keskenään tietyissä suhteissa. Tästä ja Daltonin atomiteoria, Joseph Louis Proust kehitetty lain vakio mittasuhteet , joihin stökiömetriaa perustuu ja joka myös mahdollisti kehitystä reaktion yhtälöitä.
Jo pitkään on oletettu, että orgaaniset reaktiot määritetään erityinen ” elämän voima ” (vis vitalis) ja siten eroavat ei-orgaanisissa reaktioissa. Jälkeen Friedrich Wöhler syntetisoitiin urean päässä epäorgaanisista lähtöaineiden 1828, tämä oletus menettänyt paljon merkitystä kemian. Muut kemistit jotka osallistunut merkittävällä panoksella selvittämisen orgaanisen kemian reaktiota olivat esimerkiksi Justus von Liebig hänen radikaali teoria , Alexander William Williamson , joka on kehittänyt synteesin eetterien nimetty hänen , ja Christopher Kelk Ingold , joka muun muassa , tutki mekanismeja substituutioreaktioita .
Reaktioyhtälöt
Niin kutsuttu reaktio yhtälöitä käytetään graafisesti kemiallisia reaktioita . Ne koostuvat vasemman ja oikealla olevien lähtöaineiden summa- tai rakennekaavoista . Välillä on nuoli, niin kutsuttu reaktionuoli , joka osoittaa reaktion suunnan ja tyypin. Nuolen kärki osoittaa aina suuntaan, johon reaktio tapahtuu. Ja tasapaino reaktiot , kaksinkertainen on käytetty nuolia, jotka osoittavat vastakkaisiin suuntiin. Reaktioyhtälöiden tulisi olla stoikiometrisesti tasapainossa. Tämä tarkoittaa, että reaktionuolen molemmilla puolilla tulisi olla sama määrä atomeja ja että yhtälöiden tulisi olla tasapainossa eri lukumäärällä mukana olevia molekyylejä.
- Kaavio yksinkertainen reaktioyhtälö
Monimutkaisempia reaktioita edustavat kaavakaaviot, jotka osoittavat lähtöaineiden ja tuotteiden lisäksi myös tärkeitä välituotteita tai siirtymätiloja . Reaktioreitit on havainnollistettu nuolilla, jotka osoittavat yhden atomin elektroniparien hyökkäyksen muihin atomeihin. Orgaanisen kemian reaktioyhtälöissä pienet epäorgaaniset molekyylit, kuten vesi tai hiilidioksidi, sijoitetaan usein nuolelle (koulutuksille) tai alapuolelle (tuotteille) tai osoitetaan merkillä. Myös katalyytit , liuottimet , erityisolosuhteet tai muut aineet, joilla on merkitystä reaktion aikana, eivät kuitenkaan muutu tämän kanssa, on kirjoitettu reaktionuolelle.
 Tyypillisessä reaktiossa mekanismi orgaanisessa kemiassa (esimerkki: Baeyer-Villiger hapetus perustuu reaktiolla perkarboksyylihapon kanssa ketonin )
Tyypillisessä reaktiossa mekanismi orgaanisessa kemiassa (esimerkki: Baeyer-Villiger hapetus perustuu reaktiolla perkarboksyylihapon kanssa ketonin )
Reaktion merkitseminen retrosynteesinä voi olla hyödyllinen myös monimutkaisten synteesien suunnittelussa . Tällöin reaktio kirjoitetaan loppuun, eli tuote, joka hajotetaan mahdollisten synteesivaiheiden kautta, kunnes saavutetaan mahdolliset lähtöaineet. Retrosynteesit on merkitty erityisellä nuolella, retrosynteesinuolella ( ).
Alkeisreaktiot
Alkeisreaktio on pienin osa, johon kemiallisen reaktion voidaan jakaa. Makroskooppisesti havaittavat reaktiot rakentuvat suuresta joukosta alkureaktioita, jotka tapahtuvat rinnakkain tai yksi toisensa jälkeen. Yksittäisten alkureaktioiden spesifinen sekvenssi tunnetaan myös reaktiomekanismina . Yksi tai kaksi, harvoin kolme molekyyliä osallistuu yleensä alkeisreaktioon. Reaktiot useampien molekyylien kanssa ovat käytännössä mahdottomia, koska on erittäin epätodennäköistä, että yli kolme molekyyliä tulee tarpeeksi lähelle reagoimaan samanaikaisesti.
Tärkeimmät perusreaktiot ovat yksimolekulaariset ja bimolekyylireaktiot. Yksimolekyylisessä reaktiossa on mukana vain yksi molekyyli, joka muuttuu yhdeksi tai useammaksi muuksi molekyyliksi isomeroinnin tai hajoamisen kautta. Nämä reaktiot edellyttävät yleensä energian syöttämistä esimerkiksi lämmön tai valonsäteilyn muodossa.
Eräs esimerkki tyypillisestä yksimolekyylisten reaktio on cis - trans- isomerointi , jossa cis- muoto yhdisteestä, muutetaan trans- muodossa tai päinvastoin.

Siinä tapauksessa dissosiaation , sidoksen molekyylin halkeaa ja kaksi osaa on luotu. Katkaisu voidaan suorittaa homo- tai heterolyyttisesti . Ensimmäisessä tapauksessa sidos jakautuu siten, että jokainen osa säilyttää elektronin ja muodostuu radikaaleja ; heterolyyttisen pilkkomisen tapauksessa molemmat elektronit pysyvät molekyylin yhdessä osassa, kun taas toinen ei pidä mitään elektroneja jaettu sidos ja siten muodostuu ioneja . Hajoamisilla on tärkeä rooli ketjureaktioiden , kuten oksihydrogeenireaktion tai polymerointien , laukaisussa .
- Molekyylin AB hajoaminen kahteen pienempään osaan A ja B.
Bimolekyylireaktioissa kaksi molekyyliä törmäävät ja reagoivat toistensa kanssa. Yksi mahdollisuus on, että näistä kahdesta molekyylistä tulee yksi, ts. Synteesi tapahtuu. Tämä tapahtuu esimerkiksi, kun kaksi radikaalia reagoi muodostaen molekyylin. Jopa orgaanisen kemian additioreaktioiden kanssa, uusi muodostuu useista molekyyleistä.
On kuitenkin myös mahdollista, että reaktio ei tuota stabiilia molekyyliä ja vain osa yhdestä molekyylistä siirtyy toiseen. Tämän tyyppinen reaktio tapahtuu esimerkiksi redox- ja happo-emäs-reaktioissa. Redox-reaktioissa siirretty partikkeli on elektroni; happo-emäs-reaktioissa se on protoni. Tämän tyyppistä reaktiota kutsutaan myös metateesiksi .
Kemiallinen tasapaino
Jokainen kemiallinen reaktio homogeenisessa faasissa on palautuva ja voi edetä molempiin suuntiin. Jos esimerkiksi kaksi ainetta reagoi muodostaen kolmannen, myös kolmas hajoaa lähtöaineiksi. Siellä ja takana olevat reaktiot kilpailevat aina keskenään ja vaihtelevat eri reaktionopeuksien suhteen . Koska reaktionopeudet ovat myös pitoisuudesta riippuvia, ne muuttuvat ajan myötä. Edestakaisen reaktion nopeudet lähestyvät yhä enemmän reaktion edetessä, kunnes ne ovat lopulta samat. Tässä vaiheessa yksittäisten aineiden pitoisuudet reaktioseoksessa eivät enää muutu, saavutetaan tasapaino, niin kutsuttu kemiallinen tasapaino.
Kyseisten aineiden ominaisuuksien lisäksi tasapainon sijainti riippuu lämpötilasta ja paineesta ja sen määrää vähimmäisvapaa energia. Usein lasketaan vapaan entalpian, reaktion vapaan entalpian, johtaminen , jonka on oltava tasapainossa 0. Paineesta riippuvuus voidaan helposti selittää Le Chatelier -periaatteella, jonka mukaan järjestelmä kiertää rajoituksen, kuten paineen nousun, siten, että vaikutus on minimaalinen.
Tässä vaiheessa reaktion suurin saanto on saavutettu, koska tuotteen jatkokehityksellä käänteinen reaktio etenee nopeammin ja on siksi edullinen, kunnes tasapaino saavutetaan jälleen. Suuremmat saannot voidaan kuitenkin saavuttaa poistamalla tuotteet reaktioseoksesta, jossa tasapaino on häiriintynyt, tai muuttamalla painetta tai lämpötilaa. Aineiden alkupitoisuudet eivät vaikuta tasapainon asemaan.
termodynamiikka
Kemialliset reaktiot määräytyvät suurelta osin termodynamiikan lakien mukaan. Periaatteessa jokainen reaktio tapahtuu. Hyvin monissa tapauksissa tasapaino on kuitenkin melkein kokonaan koulutettujen puolella. Jotta reaktio tapahtuisi, sen on oltava eksergoninen , toisin sanoen vapaan entalpian on vähennettävä reaktion aikana. Vapaa entalpia koostuu kahdesta eri termodynaamisesta suuruudesta, entalpia ja entropia . Ne on kytketty toisiinsa vapaan entalpian perusyhtälön kautta.
- G: vapaa entalpia, H: entalpia, T: lämpötila, S: entropia, A: erot
Reaktiot voivat tapahtua monella tapaa. Yksi mahdollisuus on eksoterminen reaktio , jossa AH on negatiivinen ja energiaa vapautuu. Vapautuneen energian määrästä riippuen voi syntyä myös hyvin järjestettyjä rakenteita, joilla on alhainen entropia. Tyypillisiä esimerkkejä eksotermisistä reaktioista entropian menetyksen kanssa ovat saostumat ja kiteytymät , joissa järjestäytyneet kiinteät rakenteet syntyvät häiriöistä rakenteista kaasufaasissa, nesteessä tai liuoksessa. Endotermisten reaktioiden tapauksessa lämpö kuluu toisaalta ja sen on absorboitava ympäristöstä. Nämä voivat tapahtua vain, jos järjestelmän entropia kasvaa samanaikaisesti. Tämä voi tapahtua esimerkiksi muodostamalla kaasumaisia reaktiotuotteita, joilla on korkea entropia.
Koska entropia on lämpötilariippuvainen ja kasvaa lämpötilan noustessa, entropiaspesifiset reaktiot, kuten hajoamiset, tapahtuvat edullisesti korkeissa lämpötiloissa. Energiaspesifiset reaktiot, kuten kiteytyminen, toisaalta tapahtuvat pääasiassa matalissa lämpötiloissa. Joskus reaktion suunta voidaan kääntää muuttamalla lämpötilaa.
Esimerkki tästä on Buduaarin tasapaino .
Reaktio hiilidioksidin ja hiili on hiilimonoksidi on endoterminen, niin että tasapaino matalissa lämpötiloissa on sivussa hiilidioksidin. Vain yli 800 ° C: n lämpötiloissa tämä puoli on edullinen johtuen korkeammasta entropiasta hiilimonoksidin puolella.
Reaktioita voidaan tarkastella myös sisäisen energian muutosten kautta . Tämä voidaan kuvata käyttämällä perustavanlaatuinen yhtälö, joka ottaa huomioon entropia, tilavuuden muutokset ja kemiallinen potentiaali , muun muassa . Jälkimmäinen riippuu muun muassa on toimintaa aineiden mukana.
- U: sisäinen energia, S: entropia, p: paine, μ: kemiallinen potentiaali, n: ainemäärä, d: ero merkintätapa
Reaktiokinetiikka
Reaktiokinetiikka tutkii nopeutta, jolla reaktio tapahtuu. Tämä riippuu eri tekijöistä, reaktion, kuten järjestys reaktion , pitoisuudet aineiden mukana, lämpötila , aktivaatioenergia ja muut, enimmäkseen empiirisesti, tekijät. On myös useita teorioita, joiden avulla teoriassa voidaan laskea reaktioiden nopeudet eri järjestelmille molekyylitasolla. Toisin kuin reaktiokinetiikka, tätä työaluetta kutsutaan myös reaktiodynamiikaksi.
Perusreaktioille voidaan laatia yksinkertaiset nopeuslait, jotka eroavat reaktion järjestyksestä riippuen ja osoittavat riippuvuutta mukana olevien aineiden pitoisuuksista. Ensimmäisen kertaluvun reaktiossa, ts. Aineen A hajoamisessa, seuraava koskee reaktionopeutta v ( k : nopeusvakio, t : aika, [A]: A: n pitoisuus, [A] 0 : A : n alkupitoisuus ):
integroitu
Ensiluokkaisessa reaktiossa reaktion nopeus riippuu vain hajoavan aineen pitoisuudesta ja ominaisuuksista. Koska konsentraatio pienenee eksponentiaalisesti ajan myötä ensimmäisen asteen reaktiossa , voidaan määrittää vakio puoliintumisaika, joka on tyypillinen kyseiselle reaktiolle . Tämä arvo annetaan usein, varsinkin kun kyseessä ovat radioaktiiviset hajoamiset, jotka eivät kuulu kemiallisiin reaktioihin, mutta myös etenevät ensiluokkaisen lain mukaan . Muille reaktiojärjestyksille ja monimutkaisemmille reaktioille on vastaavasti erilaiset nopeuslait. Nopeusvakion laskemiseksi voidaan käyttää Arrhenius-yhtälöä , joka osoittaa vakion lämpötilariippuvuuden.
Yksinkertainen malli, jolla kemiallisen reaktion molekyylirata ja reaktionopeudet voidaan selittää, on törmäysteoria . Tällä tavoin vain muutama yksinkertainen reaktio voidaan laskea kohtuullisen oikein. Monimutkaisempiin reaktioihin on käytettävä tarkempia teorioita, jotka yleensä räätälöidään tiettyyn ongelmaan. Näitä ovat siirtymätilan teoria, potentiaalisen energiapinnan laskeminen, Marcus-teoria ja RRKM-teoria .
Reaktiotyypit
Reaktiot voidaan jakaa erityyppisiin, jotka eroavat toisistaan siirrettävän hiukkasen tyypin ja muodostuneiden tuotteiden välillä.
Hapetus ja pelkistys
Jos elektronit siirtyvät kahden atomin välisen reaktion aikana, mukana olevien atomien hapetustilat muuttuvat . Atomi, joka antaa yhden tai useamman elektronin ( kutsutaan pelkistimeksi ), hapetetaan, toinen, hapettava aine , pelkistyy vastaavasti. Koska molemmat reaktiot tapahtuvat aina yhdessä, puhutaan myös redox-reaktiosta.
Mikä mukana olevista reaktanteista on pelkistävä tai hapettava aine, voidaan ennustaa mukana olevien alkuaineiden elektronegatiivisuuksien perusteella . Alhaisen elektronegatiivisuuden elementit, kuten useimmat metallit , luovuttavat helposti elektroneja ja hapetetaan vastaavasti, kun taas ei-metallit, joilla on suuri elektronegatiivisuus, pienenevät hieman. Jos ionit osallistuvat redoksireaktioon, on myös otettava huomioon ionin hapettumistaso. Siten kromaatit tai permanganaatit , joissa on korkeaan hapettumistilassa olevia alkuaineita, vahvat hapettimet.
Kuinka monta elektronia elementti vapauttaa tai absorboi redoksireaktiossa, voidaan usein ennustaa reaktanttien elektronikonfiguraatiosta . Elementit yrittävät saavuttaa jalokaasukonfiguraation ja vapauttavat tai hyväksyvät siksi usein vastaavan määrän elektroneja. Tämä koskee erityisesti monia pääryhmäelementtejä , kuten alkalimetalleja , maa-alkalimetalleja tai halogeeneja . Ja siirtymämetallit ja erityisesti raskaiden atomien, kuitenkin, tämä usein ei sovelleta johtuen suuresta varauksesta tarvitaan saavuttamaan jalokaasun kokoonpano ja kasvava vaikutus relativistinen vaikutuksia . Jalokaasut , joka on jo jalokaasu kokoonpano, vastaavasti ei ole taipumusta hyväksyä edelleen elektroneja ja ovat erittäin inerttejä.
Tärkeä redoksireaktioiden luokka ovat sähkökemialliset reaktiot. On elektrolyysi , elektronit sähkövirran toimia pelkistimenä. Sähkökemialliset reaktiot tapahtuvat galvaanisissa kennoissa , joissa pelkistys ja hapetus tapahtuvat alueellisesti erotettuna. Nämä reaktiot ovat erityisen tärkeitä monien alkuaineiden, kuten kloorin tai alumiinin, tuotannossa . Käänteinen reaktio, jossa elektronit vapautuvat redoksireaktioissa ja joita voidaan käyttää sähköenergiana, on myös mahdollista. Tämä on akun periaate, jossa energia varastoidaan kemiallisesti ja muunnetaan sähköenergiaksi.
Monimutkainen muodostumisreaktio
Kompleksin muodostumisreaktiossa useat ligandit reagoivat metalliatomin kanssa muodostaen kompleksin . Tämä tapahtuu, koska yksinäiset elektroniparit ligandeissa tunkeutuvat tyhjiin metalliatomin orbitaaleihin ja muodostavat koordinaatiosidoksen . Ligandit ovat Lewisin emäksiä, joissa on yksinäiset elektroniparit. Nämä voivat olla sekä ioneja että neutraaleja molekyylejä (kuten hiilimonoksidi, ammoniakki tai vesi). Keskimetalliatomin kanssa reagoivien ligandien määrä voidaan usein ennustaa 18-elektronisäännön avulla , jota voidaan käyttää erityisen stabiilien kompleksien määrittämiseen. Mukaan kristallin kentän ja ligandin kentän teoria , geometria Kokonaisuuteen tärkeä rooli; tetrahedral tai octahedral kompleksit ovat erityisen yleisiä .
Reaktiot voivat tapahtua myös kompleksissa. Näihin kuuluvat ligandinvaihto , jossa yksi tai useampi ligandi korvataan toisella, uudelleenjärjestelyt ja redox-prosessit, joissa keskusmetalliatomin hapettumistaso muuttuu.
Happo-emäs-reaktiot
Happo- emäsreaktiot ovat - happojen Brønstedin määritelmässä - reaktioita, joissa protonit siirtyvät yhdestä molekyylistä toiseen. Protonin on aina siirretään happo (protonin luovuttajana) on pohja (protonin akseptori) (protolyysiin).
- Happo-emäs-reaktio, HA: happo, B: emäs, A - : vastaava emäs, HB + : vastaava happo
Koska protonin siirtyminen haposta emäkseen tuottaa emäksen ja hapon, niin kutsutut vastaavat hapot tai emäkset, myös käänteinen reaktio on mahdollinen. Happo / emäs ja vastaava emäs / happo ovat siten aina tasapainossa. Millä reaktion puolella tasapaino on, voidaan määrittää mukana olevien aineiden happovakiot . Mitä vahvempi happo tai emäs on, sitä helpompaa on vapauttaa tai absorboida protonia. Happo-emäs-reaktion erityistapaus on neutralointi , jossa happo ja emäs reagoivat täsmälleen samassa suhteessa kuin muodostuu neutraali liuos, ts. Liuos, jossa ei ole ylimäärää hydroksidi- tai oksoniumioneja .
saostus
Sade on reaktio, jossa aiemmin liuenneet hiukkaset yhdistyvät ja niistä tulee uusi, veteen liukenematon aine, sakka. Tämä tapahtuu pääasiassa liuenneiden ionien kanssa, jotka muodostuvat yhdessä liukoisuustuotteen ylittyessä ja muodostavat liukenemattoman suolan . Tämä voidaan tehdä esimerkiksi lisäämällä saostusaine, jolla on vähän liukoisuutta, jo liuenneeseen suolaan tai poistamalla liuotin. Olosuhteista riippuen aine voi osoittautua hyvin erilaiseksi kuin liuos. Jos saostuminen tapahtuu nopeasti, ioneilla ei ole aikaa organisoitua ja muodostuu amorfinen tai mikrokiteinen sakka. Toisaalta, kun liukoisuustuote ylitetään hitaasti ja tapahtuu ylikyllästymistä, saostuminen tapahtuu vain hitaasti. Siksi ioneilla on aikaa organisoitua ja muodostuu säännöllisiä kiteitä . Tämä voidaan tehdä myös uudelleenkiteyttämällä mikrokiteisestä sakasta.
Kiinteän tilan reaktiot
Reaktioita voi tapahtua myös kahden kiinteän aineen välillä. Kuitenkin diffuusio , joka määrää suurelta osin reaktion nopeutta, on hyvin pieni, joten solid-state-reaktiot ovat vastaavasti hitaasti reaktioita. Tämä tarkoittaa, että kiinteän olomuodon reaktiot on yleensä suoritettava korkeissa lämpötiloissa. Samanaikaisesti reagenssit tulisi jakaa mahdollisimman hienoksi, koska se luo suurimman mahdollisen pinnan, jolla nämä kaksi ainetta voivat reagoida.
Fotokemialliset reaktiot
Sähkömagneettisella säteilyllä on ratkaiseva rooli fotokemiallisissa reaktioissa . Valo ja UV-säteily , joiden aallonpituus on noin 200 - 800 nm, ovat tässä erityisen tärkeitä . Tämä säteily herättää elektroneja atomissa ja molekyyleissä, ja muodostuu viritettyjä tiloja . Nämä ovat erittäin energisiä absorboituneiden fotonien ansiosta ja voivat vapauttaa energiaa eri prosesseissa. Fyysisten prosessien, kuten fluoresenssin ja fosforesenssin , lisäksi reaktiot ovat mahdollisia myös tässä. Usein tapahtuu homolyyttisiä sidoskatkoksia, jolloin muodostuu radikaaleja . Esimerkiksi ketjureaktiot , kuten vedyn ja hapen oksi-vetyreaktio , voidaan laukaista fotokemiallisilla reaktioilla . Mutta ionisaatiot , elektroninsiirtoreaktiot , isomeroinnit tai uudelleenjärjestelyt voivat myös johtua fotokemiallisista reaktioista.
Fotosynteesi on biologisesti erittäin tärkeä fotokemiallinen reaktio , jossa orgaaniset yhdisteet syntetisoidaan valon avulla hiilidioksidista ja vedestä . Fotokemiallisesti myös tärkeä rooli in ilmakehän kemiassa , esimerkiksi että kasvun ja jakautuminen otsonia .
katalyysi
Katalyysissä kahden aineen reaktio ei tapahdu suoraan, vaan kiertotien kautta. Aina on mukana kolmas aine, ns. Katalyytti , joka puuttuu reaktioon, mutta loppujen lopuksi aina muuttuu muuttumattomana reaktiosta. Katalyysin seurauksena reaktioita, jotka kineettisesti estävät korkea aktivaatioenergia, voi tapahtua samalla kun tämä aktivaatioenergia ohitetaan. Tämän seurauksena usein käytetään vain pieni määrä energiaa, ja reaktio voidaan siten suorittaa taloudellisesti. Joskus katalyytit mahdollistavat reaktiot vain, jos esimerkiksi kilpailureaktiot tapahtuvat ensisijaisesti muuten välttämättömissä lämpötiloissa.
Katalyytit voivat olla läsnä joko eri vaiheessa (heterogeeninen) tai samassa vaiheessa (homogeeninen). Heterogeeniset katalyytit ovat enimmäkseen kiinteitä kappaleita, joiden pinnalla reaktiot tapahtuvat. Vastaavasti katalyytin pinnan tulisi olla mahdollisimman suuri tehokasta katalyysiä varten. Pintojen katalyyttiset reaktiot liittyvät usein kememisorptioon , jossa molekyyli on kemiallisesti sitoutunut pintaan ja siksi molekyylin sisäiset sidokset heikkenevät. Tämä mahdollistaa helpomman reaktion.
Heterogeenisessä katalyysissä erityisen tärkeitä ovat platinametallit ja muut siirtymämetallit, joita käytetään monissa teknisesti tärkeissä reaktioissa, kuten hydraus , katalyyttinen reformointi tai emäksisten kemikaalien, kuten typpihapon tai ammoniakin, synteesi . Homogeenisen katalyysin katalyytit voivat olla happoja, jotka lisäävät karbonyyliryhmän nukleofiilisyyttä ja mahdollistavat siten reaktion muutoin reagoimattomien elektrofiilien tai liukoisten kompleksien kanssa kuten hydroformyloinnissa .
Homogeenisilla katalyytteillä on se etu, että katalyytin saavutettavuudessa ei ole ongelmia ja että pinta-ala on liian pieni; reagoivat aineet ja katalyytti voidaan helposti saattaa yhteen sekoittamalla ja sekoittamalla. Lisäksi katalyytti, kuten kompleksi, voidaan syntetisoida spesifisesti ja toistettavasti reaktiota varten. Haittana on kuitenkin katalyytin vaikea erottaminen tuotteesta, mikä voi johtaa yleensä kalliin katalyytin saastumiseen ja häviämiseen. Siksi heterogeeniset katalyytit ovat edullisia monissa teollisissa prosesseissa.
Reaktiot orgaanisessa kemiassa
Orgaanisessa kemiassa on myös epäorgaanisten aineiden kanssa tapahtuvien reaktioiden, kuten hapettumisten, pelkistysten tai happo-emäksisten reaktioiden, lisäksi lukuisia muita reaktioita, joissa kovalenttisia sidoksia muodostuu hiiliatomien tai hiili- ja heteroatomien (esim. , halogeenit). Homolyyttisten ja radikaalisten reaktioiden välisen eron lisäksi ne luokitellaan ensisijaisesti rakennemuutoksen tyypin mukaan. Monet orgaanisen kemian erityisreaktiot nimetään nimireaktioksi niiden löytäjien mukaan.
korvaaminen
Korvauksena yksi atomi, osa molekyylistä tai ligandista (monimutkaisessa kemiassa, jossa myös substituutiot ovat mahdollisia) vaihdetaan toiseen. Hyökkäävä atomi tai molekyyli ottaa toisen atomin tai molekyylin paikan, joka on erotettu lähtevänä ryhmänä . Sitoutuminen hiiliatomin ei muutu.
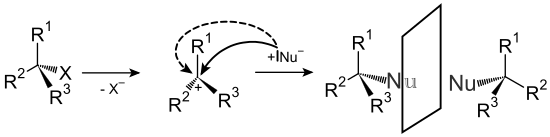
Korvausreaktiot voidaan jakaa kolmeen tyyppiin hyökkäävän hiukkasen mukaan. Nukleofiilisten substituutioiden tapauksessa nukleofiili , so. Atomi tai molekyyli, jossa on ylimäärä elektronia ja siten negatiivinen varaus tai osittainen varaus , hyökkää sopivaan hiiliatomiin ja korvaa toisen atomin tai osamolekyylin. Tyypillisiä nukleofiilejä ovat atomit, ionit tai atomiryhmät, joissa on elektronegatiivisia ei-metalleja, kuten amiinit , halogenidit , tiolit , hydroksidit tai alkoholaatit . Nukleofiilin lisäksi poistuvalla ryhmällä on myös rooli sen määrittämisessä, tapahtuuko substituutio. Hyvien lähtevien ryhmien tulisi olla helppo erottaa ja muodostaa mahdollisimman stabiileja molekyylejä tai ioneja. Esimerkkejä ovat raskaat halogenidit, bromidi ja jodidi tai typpi. Tämän tyyppinen reaktio esiintyy pääasiassa alifaattisten hiilivetyjen ja aromaattisten yhdisteiden kanssa - koska aromaattisilla aineilla on suuri elektronitiheys - se on melko harvinaista ja voi tapahtua vain erityisolosuhteissa, joissa aromaattisilla aineilla on erittäin voimakkaasti elektroneja vetäytyviä ryhmiä ( nukleofiilinen aromaattinen substituutio ). Nukleofiilinen substituutiot voivat esiintyä mukaan kaksi eri mekanismia, jota kutsutaan S- N- 1 ja S- N 2. Nimet johdetaan reaktiojärjestyksistä, joiden mukaan kahden reaktiotyypin nopeuden määritysvaiheet tapahtuvat.
S N1 -mekanismissa lähtevä ryhmä erotetaan ensin , mikä aiheuttaa karbokationin . Tätä seuraa nopea reaktio nukleofiilin kanssa.
S N2 -mekanismissa nukleofiili hyökkää ensin muodostaen yhteisen siirtymätilan, ja vasta sitten eroava ryhmä erotetaan. Kahden mekanismin eroavat stereokemia saatujen tuotteiden, joissa on S N 1 a rasemoitumista tapahtuu, koska kolmiarvoisen hiilikationin , kun taas S N 2 käänteinen aikaisemman stereokemia ( Walden kääntyminen ) havaitaan.
Nukleofiilisen substituution vastine on elektrofiilinen substituutio . Tässä tapauksessa hyökkäävä hiukkanen on elektrofiili, ts. Atomi tai molekyyli, jolla on pienempi elektronitiheys, ts. Positiivinen varaus tai osittainen varaus. Tyypillisiä elektrofiilejä ovat esimerkiksi karbokationit, hiiliatomi karbonyyliryhmissä , rikkitrioksidi tai nitroniumkationit . Tämä reaktio tapahtuu melkein yksinomaan aromaattisten hiilivetyjen kanssa, minkä vuoksi puhutaan usein elektrofiilisestä aromaattisesta substituutiosta . Mekanismissa elektrofiilin hyökkäys muodostaa aluksi niin kutsutun σ-kompleksin, siirtymätilan, jossa aromaattinen järjestelmä on suspendoitunut. Poistuva ryhmä, yleensä protoni, erotetaan sitten ja aromaattinen järjestelmä palautetaan.
Kolmannessa korvaustyypissä hyökkäävä hiukkanen on radikaali , minkä vuoksi sitä kutsutaan myös radikaaliseksi substituutioksi . Tämä tapahtuu ketjureaktion muodossa ja tapahtuu esimerkiksi alkaanien reaktiossa halogeenien kanssa. Ensimmäisessä vaiheessa esimerkiksi valo, lämpö tai erittäin epävakaiden molekyylien hajoaminen muodostavat muutaman käynnistysradikaalin. Ketjureaktiossa reaktio jatkuu radikaalin siirron kautta, kunnes ketju katkeaa kahden radikaalin rekombinaation kautta .
- Reaktiot radikaalin substituution ketjureaktion aikana
Lisäys / eliminointi
Lisäys ja vastine, poistaminen , ovat reaktiot, joissa substituenttien lukumäärä hiiliatomissa muuttuu, ja useita sidoksia muodostuu tai pilkotaan. Eliminointireaktioissa syntyy kaksois- ja kolmoissidoksia poistamalla ("eliminoimalla") yksi substituentti sidoksen jokaisesta hiiliatomista. Eliminointia varten kyseisen sidoksen hiiliatomissa on oltava sopiva poistuva ryhmä, joka voidaan irrottaa suhteellisen helposti. Samoin kuin nukleofiilinen substituutio, on olemassa useita mahdollisia mekanismeja, jotka tapahtuvat molekyylistä ja olosuhteista riippuen ja jotka puolestaan nimetään vastaavan reaktiojärjestyksen mukaan. E1-mekanismissa lähtevä ryhmä erotetaan aluksi muodostumalla karbokationi. Seuraavassa vaiheessa kaksoissidos muodostuu pilkkomalla protoni. Kahden reaktion samanlaisten olosuhteiden vuoksi E1-eliminaatio kilpailee aina SN1- substituution kanssa.
Ensimmäinen reaktiojärjestys on E1cb-mekanismi, jossa protoni hajotetaan emäksen avulla ja muodostuu karbanioni . Seuraavassa vaiheessa kaksoissidos muodostuu poistuvan ryhmän eliminoimalla.
E2-mekanismi vaatii myös perustan. Tällöin emäksen hyökkäys ja lähtevän ryhmän hajoaminen etenevät kuitenkin yhdessä, eikä ionista välituotetta muodostu. Toisin kuin El-eliminaatiot, stereokemia tuotteessa voidaan määrittää tässä, koska anti- asennossa olevan emäksen reaktio lähtevään ryhmään tapahtuu ensisijaisesti. Koska samanlaisia olosuhteita ja reagensseja, E2 poistaminen on aina kilpailee S N 2 vaihdosta.
Eliminaation vastine on lisäysreaktio . Tässä tapauksessa atomit tai molekyylit kiinnittyvät kaksois- tai kolmoissidoksiin ja muodostavat yksittäisiä sidoksia. Lisäysreaktiot voivat tapahtua sekä CC-monisidoksilla, eli alkeeneilla tai alkyyneillä , että hiili-heteroatomien monisidoksilla, kuten karbonyyliryhmillä , tiokarbonyyliryhmillä tai nitriileillä . Kuten korvaamiset, lisäykset voidaan myös jakaa useisiin ryhmiin hyökkäävän hiukkasen mukaan. On elektrofiilinen Lisäksi , elektrofiilillä, usein protoni, hyökkää kaksoissidoksen muodostamiseksi karbeniumionin. Tämä reagoi nukleofiilien kanssa tuotteen muodostamiseksi.
Karbeniumionin muodostumiselle on kaksi mahdollisuutta - millä kaksoissidoksen puolella se ensisijaisesti muodostuu, riippuu epäsymmetristen alkeenien tapauksessa eri radikaalien stabiloitumisesta. Markovnikovin sääntö tarjoaa säännön siitä, mikä tuotteista on edullinen .
Jos funktionaalisen ryhmän lisäämisen on tarkoitus tapahtua kaksoissidoksen vähemmän substituoidulla hiiliatomilla, elektrofiilinen substituutio hapoilla ei ole mahdollista. Yksi mahdollisuus on hydroboraatio , jossa booriatomi toimii elektrofiilinä ja hyökkää siksi vähemmän substituoitua hiiliatomia vastaan Markovnikovin säännön mukaisesti. Muut funktionaaliset ryhmät voivat sitten muodostaa seuraavassa vaiheessa , jonka hapettamalla tai halogenoimalla .
Vaikka elektrofiilinen lisäys tapahtuu pääasiassa elektronirikkaiden alkeenien ja alkyynien kanssa, nukleofiilisellä lisäyksellä on tärkeä rooli hiili-heteroatomin monisitomisissa sidoksissa ja ennen kaikkea niiden tärkeimmässä edustajana, karbonyyliryhmässä . Tämä liittyy usein eliminaatioon, joten karbonyyliryhmä on taas läsnä reaktion jälkeen. Tämä voidaan tehdä karboksyylihappojohdannaisten, kuten karboksyylihappokloridien , estereiden tai anhydridien tapauksessa, joilla on sopiva poistuva ryhmä karbonyyliryhmässä. Sitä kutsutaan usein lisäys-eliminointimekanismiksi . Tätä katalysoivat usein hapot tai emäkset, jotka (happojen tapauksessa) kiinnittymällä happiatomiin lisäävät karbonyyliryhmän elektrofiilisyyttä tai (emästen tapauksessa) hyökkäävän nukleofiilin nukleofiilisyyttä.
Vinylogian periaatteen mukaan hyökkäys nukleofiilisen lisäyksen avulla voi tapahtua myös a-, P-tyydyttymättömien karbonyyliyhdisteiden , kuten ketonien tai estereiden kaksoissidokselle . Tärkeä tämän tyyppisen reaktion edustaja on Michael-lisäys .
Kuten substituutiot, lisäykset voivat laukaista paitsi nukleofiilit ja elektrofiilit, myös radikaalit. Kuten radikaalisubstituutiolla, radikaali lisäys tapahtuu myös ketjureaktion muodossa. Tämä reaktio on radikaalin polymeroinnin perusta .
Muut orgaaniset reaktiomekanismit
Uudelleenjärjestelyt ovat reaktioita, joissa orgaanisen yhdisteen atomit tai molekyyliosat säilyvät, mutta järjestyvät uudelleen. Näihin kuuluvat hydridisiirtoreaktiot, kuten Wagner-Meerwein-uudelleenjärjestely , jossa alun perin muodostuu karbokatio, joka sitten järjestetään uudelleen vakaammaksi karbokationiksi siirtämällä hydridi-ionia. Useimmissa tapauksissa uudelleenjärjestelyt liittyvät kuitenkin CC-joukkovelkakirjojen rikkoutumiseen ja uudelleen muodostumiseen. Tyypillisiä esimerkkejä tästä ovat sigmatrooppiset uudelleenjärjestelyt , kuten Cope-uudelleenjärjestely , jossa yksi C-C-sidos rikkoutuu ja toinen muodostuu samanaikaisesti syklisessä reaktiossa.
Kuten sigmatrooppiset uudelleenjärjestelyt, syklikuormitukset kuuluvat myös perisyklisiin reaktioihin . Tässä reaktiossa syklinen molekyyli muodostuu useista, yleensä kahdesta kaksoissidoksesta, jotka sisältävät molekyylejä. Tärkein syklilisäys on Diels-Alder-reaktio , [4 + 2] syklinen lisäys, jossa dieeni ja alkeeni (tunnetaan myös nimellä dienofiili) reagoivat muodostaen sykloalkeenin.
Diels-Alder-reaktion lisäksi on olemassa myös [2 + 2] -syklikuormitus , jossa kaksi alkeenia tai muuta kaksoissidoksella olevaa yhdistettä reagoivat keskenään kuten ketonit. Sykliset lisäykset ovat mahdollisia myös 1,3- dipoleilla , kuten otsoni , diatsometaani tai nitriilioksidit . Se, tapahtuuko ja kuinka syklilisäys tapahtuu, riippuu kyseessä olevien kaksoissidosten p- orbitaalien järjestelystä .
Ne on sijoitettava toisiaan vastaan siten, että kiertoradat, joilla on sama aaltofunktion merkki, voivat olla päällekkäisiä ja voivat siten olla rakentavasti vuorovaikutuksessa ja muodostaa energisesti edullisemmat yksittäiset sidokset. Sykloreaktiot voidaan indusoida sekä lämpö- että valokemiallisesti säteilyttämällä valolla. Koska säteilytyksen aikana elektronit tuodaan kiertoradoille, joilla on erilainen järjestely ja symmetria, valokemiallisesti erilaiset syklikuormitukset ovat mahdollisia kuin termiset. Diels-Alder-reaktiot ovat termisiä syklikuormituksia, kun taas [2 + 2] -sykloadditiot täytyy indusoida säteilytyksellä.
Kiertoratkaisut rajoittavat mahdollisia tuotteita ja - stereoisomeeristen lähtöaineiden tapauksessa - myös niiden stereoisomeeria . Kuinka tämä tapahtuu, kuvaavat Woodward-Hoffmannin säännöt .
Biokemialliset reaktiot
Entsyymeillä on keskeinen merkitys biokemiallisissa reaktioissa . Nämä proteiinit katalysoivat yleensä spesifisesti yhtä reaktiota, jotta reaktioita voidaan hallita hyvin tarkasti. Tunnetaan kuitenkin myös entsyymejä, jotka voivat katalyyttisesti kiihdyttää useita erityistoimintoja. Reaktio tapahtuu pienessä osassa entsyymiä, aktiivisessa keskuksessa , kun taas loput entsyymistä käytetään pääasiassa stabilointiin. Aktiivinen keskus sijaitsee entsyymin kuopassa tai urassa. Katalyyttisestä aktiivisuudesta muun muassa sitoutuminen entsyymiin, muuttunut, hydrofobinen , kemiallinen ympäristö ja reaktanttien spatiaalinen läheisyys ovat vastuussa, kun taas aktiivisen keskuksen erityinen muoto on vastuussa selektiivisyydestä.
Kehon biokemiallisten reaktioiden kokonaisuutta kutsutaan aineenvaihdunnaksi . Yksi tärkeimmistä mekanismeista on aineenvaihdunnan rakentaminen , jossa monimutkaiset luonnolliset aineet , kuten proteiinit tai hiilihydraatit, syntetisoidaan yksinkertaisista esiasteista erilaisissa prosesseissa, joita ohjataan DNA: lla ja entsyymeillä, kuten proteiinibiosynteesillä . Lisäksi on energia-aineenvaihdunta , jonka kautta reaktioon tarvittava energia , kuten rakennuksen aineenvaihdunta , saadaan kemiallisten reaktioiden avulla. Tärkeä energialähde on glukoosi , jota kasvit voivat tuottaa fotosynteesin aikana tai joka voidaan kuluttaa ruoan kanssa. Tätä ei kuitenkaan voida käyttää suoraan; sen sijaan soluhengityksen ja hengitysketjun kautta syntyy hapen avulla ATP , joka toimii energiantoimittajana tulevissa reaktioissa.
Tekninen sovellus
Kemialliset reaktiot ja niiden toteutus ovat keskeisiä teknisessä kemiassa . Niitä käytetään suuressa määrin uusien yhdisteiden synteesissä luonnossa esiintyvistä raaka-aineista, kuten raakaöljystä , malmeista , ilmasta tai uusiutuvista raaka-aineista . Usein syntetisoidaan ensin yksinkertaisia välituotteita, joista valmistetaan lopputuotteita, kuten polymeerejä , pesuaineita , torjunta-aineita , lääkkeitä tai väriaineita . Tekniset reaktiot tapahtuvat reaktorissa , kuten sekoitetuissa säiliöissä tai virtausputkissa .
Teknologialle on erityisen tärkeää, että reaktioprosessi on mahdollisimman taloudellinen. Näitä ovat esimerkiksi raaka-aineiden ja energian vähäinen käyttö, korkeat reaktionopeudet ja korkeat saannot mahdollisimman pienellä jätetuotteella. Siksi on erittäin tärkeää käyttää katalyyttejä, jotka lisäävät sekä reaktionopeutta että vähentävät energiankulutusta. Pienien jätemäärien varmistamiseksi reaktiot valitaan usein teknisissä sovelluksissa, joissa on korkea atomitalous , ts. Joissa suuri osa lähtöaineista löytyy halutusta tuotteesta.
havainto
Kuinka kemiallisia reaktioita voidaan havaita ja seurata, riippuu suuresti reaktion nopeudesta. Hitaiden reaktioiden tapauksessa näytteet voidaan ottaa ja analysoida reaktion aikana. Reaktioseoksen yksittäisten aineosien konsentraatiot määritetään ja konsentraation kulkua seurataan reaktion aikana. Jos pitoisuudet eivät enää muutu jonkin ajan kuluttua, reaktio on täydellinen ja tasapaino on saavutettu. Sen varmistamiseksi, että reaktio ei etene liikaa mittauksen aikana, käytetään nopeasti ja helposti suoritettavia analyysimenetelmiä, kuten ohutkerroskromatografia tai massaspektrometria . Jatkuva havainnointi reaktion aikana on myös mahdollista käyttämällä spektroskooppisia menetelmiä, jos esimerkiksi värillisen aineen pitoisuus seoksessa voidaan määrittää. Jos tämä ei ole mahdollista, voidaan joskus käyttää erityistä merkkiainetta, kuten radioaktiivista isotooppia , jonka pitoisuus mitataan. Tätä käytetään esimerkiksi skintigrafiassa metabolisten prosessien tarkkailuun, joissa tietyt elementit kertyvät yksittäisiin elimiin. Suotuisissa olosuhteissa pintareaktioita voidaan havaita suoraan molekyylitasolla skannaavalla tunnelimikroskoopilla .
Ja detektioreaktiot ns pelata indikaattorit tärkeä rooli, jotka ovat aineita, jotka muuttuvat, esimerkiksi väri, kun tietty piste reaktion on saavutettu. Happo-emäs-indikaattorit, jotka muuttavat väriä heti, kun liuos on neutraloitu ja pH-arvo muuttuu happamasta emäksiseksi tai päinvastoin, tunnetaan ennen kaikkea . Selektiivisiä saostumisreaktioita voidaan käyttää myös aineiden havaitsemiseen tai esimerkiksi kationien erotusprosessissa ennen tarkkaa havaitsemista.
Mitä nopeammin reaktio tapahtuu, sitä vaikeampi sitä on havaita. Nopeiden reaktioiden kineettisiin tutkimuksiin käytetään ultranopeaa spektroskopiaa , joka femtosekunnisten lasereiden avulla mahdollistaa aikaresoluution pikosekuntien tai femtosekuntien alueella. Tällä tavalla reaktion aikana voidaan havaita myös lyhytaikaisia siirtymätiloja.
kirjallisuus
- Merkintä reaktio. Julkaisussa: Römpp Online . Georg Thieme Verlag, luettu 20. kesäkuuta 2014.
- Peter W. Atkins , Julio de Paula: Fyysinen kemia. 4. painos, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8 .
- AF Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 102. painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s.186-258.
- Reinhard Brückner: reaktiomekanismit. 3. painos, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9 .
nettilinkit
- Kemiallisen reaktion merkintä . Julkaisussa: IUPAC Compendium of Chemical Terminology ("kultakirja") . doi : 10.1351 / goldbook.C01033 .
Yksittäiset todisteet
- ↑ Jost Weyer: Alkemian uudemmat tulkinnat. Julkaisussa: Kemia aikamme. 1973, 7.6, s. 177-181, doi: 10.1002 / ciuz.19730070604 .
- ^ William H.Brock : Viewegin kemian historia . Vieweg, Braunschweig 1997, ISBN 3-540-67033-5 , s. 34-55.
- ^ William H.Brock : Viewegin kemian historia . Vieweg, Braunschweig 1997, ISBN 3-540-67033-5 , s. 104-107.
- ↑ Merkintä kemiallisen reaktion yhtälön . Julkaisussa: IUPAC Compendium of Chemical Terminology ("kultakirja") . doi : 10.1351 / goldbook.C01034 .
- ^ EJ Corey: Robert Robinson Luento. Retrosynteettinen ajattelu - olennaista ja esimerkkejä. Julkaisussa: Chem. Soc. Rev. 1988, 17, s. 111-133, doi: 10.1039 / CS9881700111 .
- ↑ Merkintä alkeisreaktio. Julkaisussa: Römpp Online . Georg Thieme Verlag, luettu 20. kesäkuuta 2014.
- ↑ Peter W. Atkins, Julio de Paula: Fysikaalinen kemia. 4. painos, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8 , s. 106-108.
- ^ AF Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 102. painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s.897.
- ↑ Peter W. Atkins, Julio de Paula: Fysikaalinen kemia. 4. painos, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8 , s.150 .
- ↑ Peter W. Atkins, Julio de Paula: Fysikaalinen kemia. 4. painos, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8 , s.963.
- ^ A b A.F. Holleman , E.Wiberg , N.Wiberg : Epäorgaanisen kemian oppikirja . 102. painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s. 1380-1400.
- ↑ Ennakko sademäärästä. Julkaisussa: Römpp Online . Georg Thieme Verlag, luettu 20. kesäkuuta 2014.
- ^ Ralf Alsfasser, Erwin Riedel , C.Janiak, HJ Meyer: Moderni epäorgaaninen kemia. 3. painos. de Gruyter, 2007, ISBN 978-3-11-019060-1 , s.171 .
- ↑ Peter W. Atkins, Julio de Paula: Fysikaalinen kemia. 4. painos, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8 , s. 937-950.
- ↑ Christoph Elschenbroich: Organometallchemie. 6. painos, Teubner Wiesbaden, 2008, ISBN 978-3-8351-0167-8 , s.263 .
- ↑ Reinhard Brückner : reaktiomekanismit. 3. painos, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9 , s. 63-77.
- ↑ Reinhard Brückner: reaktiomekanismit. 3. painos, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9 , s.203-206.
- ↑ Reinhard Brückner: reaktiomekanismit. 3. painos, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9 , s.16 .
- ↑ Reinhard Brückner: reaktiomekanismit. 3. painos, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9 , s.183 .
- ↑ Reinhard Brückner: reaktiomekanismit. 3. painos, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9 , s.192 .
- ↑ Reinhard Brückner: reaktiomekanismit. 3. painos, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9 , s.172 .
- ↑ Reinhard Brückner: reaktiomekanismit. 3. painos, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9 , s.125 .
- ↑ Hans Peter Latscha, Uli Kazmaier, Helmut Alfons Klein: Organische Chemie: Chemie-Basiswissen II, 2. osa, 6. painos, Springer, 2008, ISBN 978-3-540-77106-7 , s.273 .
- ↑ Reinhard Brückner: reaktiomekanismit. 3. painos, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9 , s.580 .
- ↑ Manfred Lechner, Klaus Gehrke, Eckhard Nordmeier: Makromolekulare Chemie. 3. painos, Birkhäuser, Basel 2003, ISBN 3-7643-6952-3 , s. 53–65.
- ↑ Eberhard Breitmaier, Günther Jung: Orgaaninen kemia. 5. painos, Thieme, Stuttgart 2005, ISBN 3-13-541505-8 , s.447-453.
- ↑ Reinhard Brückner: reaktiomekanismit. 3. painos, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9 , s. 637–647.
- ^ RB Woodward, Roald Hoffmann: Sähkösyklisten reaktioiden stereokemia. Julkaisussa: J. Am. Chem. Soc. 1965, 87, 2, s. 395-397, doi: 10.1021 / ja01080a054 .
- ^ Peter Karlson, Detlef Doenecke, Jan Koolman, Georg Fuchs, Wolfgang Gerok: Karlsons Biochemie und Pathobiochemie. 16. painos, Georg Thieme Verlag, 2005, ISBN 978-3-13-357815-8 , s.55-56 .
- ^ Gerhard Emig, Elias Klemm: Tekninen kemia. 5. painos, Springer, 2005, ISBN 978-3-540-23452-4 , s.33-34.
- ↑ Barry Trost : Atomitalous - synteettisen tehokkuuden etsiminen. Julkaisussa: Science . 1991, 254, sivut 1471-1477, doi: 10.1126 / science.1962206 .
- ↑ Thomas Waldmann, Daniela Künzel, Harry E.Hoster, Axel Groß, R.Jürgen Behm: Orgaanisen adlayerin hapettuminen: lintuperspektiivi. Julkaisussa: Journal of the American Chemical Society. 134, nro 21, 2012, s. 8817-8822, doi: 10.1021 / ja302593v .
- ↑ Peter W. Atkins, Julio de Paula: Fysikaalinen kemia. 4. painos, Wiley-VCH, Weinheim 2006, ISBN 978-3-527-31546-8 , s.987.











![{\ displaystyle v = - {\ frac {\ mathrm {d} [\ mathrm {A}]} {\ mathrm {d} t}} = k \ cdot [\ mathrm {A}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/02e857d43648c97f61048ef4d2b8d945278946db)
![\ mathrm {[A]} _ {t} = \ mathrm {[A]} _ {0} \ cdot e ^ {- k \ cdot t}](https://wikimedia.org/api/rest_v1/media/math/render/svg/896c5da2771260d7b5dbd5f28a9406cda180e268)