Orgaaniset hapot
Orgaaniset hapot ovat kemiallisia yhdisteitä, joissa on yksi tai useampia funktionaalisia ryhmiä tai muita rakenteellisia elementtejä, jotkaalkavat tasapainoreaktioissavapauttamalla protoneja veden tai muiden protonoitavien liuottimien kanssa . Tämä luo kyseisten orgaanisten happojen vastaavat anionit ja protonit imeytyyliuotinvesiin, jokatoimiiprotoniakteptorina ( emäksenä ), jolloin muodostuu oksoniumioneja H 3 O + . Oksoniumionien pitoisuusliuoksessa on silloin suurempi kuin hydroksidi-ionien pitoisuus, niin että liuostulee happamaksi :
Orgaanisten happojen, jotka jo reagoivat veden kanssa happoina, lisäksi on suuri määrä muita orgaanisia yhdisteitä, jotka eivät ole vastustuskykyisiä heikossa protoniakteptorivedessä, vaan vahvemmille protoniakteptoreille - kuten. B. hydridin anioni H - tai amidi anioni NH 2 - voi reagoida happojen. Molemmissa tapauksissa ei ole tasapainoa, vaan pikemminkin kaasumaisen vedyn tai ammoniakin muodostuminen:
Tällaiset reaktiot ovat myös happo-emäksisiä reaktioita , mutta ne on suoritettava ilman vettä ja liuottimessa, joka ei itse voi luovuttaa protoneja (esim. Dietyylieetterissä ). Muussa tapauksessa vesi tai sopimaton liuotin protonoi hyvin voimakkaasti emäksiset anionihydridit tai -amidit ja tuhoutuvat siten.
Orgaanisten happojen ryhmittely
Alustavat huomautukset, hapon vahvuus
Mitta happamuutta kemiallinen yhdiste on happo vakio tai sen pKa : n arvo . Happovakion arvo osoittaa kuinka voimakkaasti yhdiste reagoi ( protolysoituu ) veden kanssa happona yllä olevassa tasapainoreaktiossa , ts. H. kuinka pitkälle yllä oleva tasapaino on siirtynyt oikealle. PK pienempi: missä s- arvo, sitä suurempi on orgaanisen hapon happolujuus.
Termi orgaaninen happo on usein kiireellisesti ja yksinkertaisesti rinnastettavissa karboksyylihappoon , ts. Yhdisteisiin, joissa on yksi tai useampi karboksiryhmä (-COOH). On kuitenkin hyvin monia orgaanisia yhdisteitä, jotka voivat reagoida happoina, mutta jotka eivät sisällä lainkaan karboksiryhmiä, mutta muita ryhmiä, jotka myös erittävät protonin enemmän tai vähemmän helposti, so. H. voi reagoida hapan. Nämä voivat olla ryhmiä, kuten B. hydroksyyliryhmä in alkoholit R-OH, tai sulfanyyli ryhmä -SH ( tiolit ), tai ryhmä -SO 3 H orgaanisten ( sulfonihapot ).
Protonin vapauttaminen on sitä helpompaa, so. H. yhdiste on sitä vahvempi happo, sitä paremmin saatu anioni stabiloituu mesomerismillä tai muilla lisävaikutuksilla. Yhdiste askorbiinihappo ( C-vitamiini ) on erityisen merkittävää esimerkki tästä. Ei ole karboksiryhmä molekyylirakenteen ja vielä tämän yhdisteen p K S 4,25 on vahvempi happo kuin etikkahappo p K S 4,75, koska anioni askorbiinihappo on stabiloitu , koska enoli -ryhmien ja mahdolliset tautomeeriset vaikutuksia.
On tärkeää huomata, että C- tai N-atomiin sitoutuneet protonit voivat vapautua myös, jos muodostuneet anionit ovat stabiloituneet mesomeerisesti. Tällaisia yhdisteitä kutsutaan myös CH-happamiksi tai NH-happamiksi yhdisteiksi. Näiden yhdisteiden tapauksessa ilman vettä liuottimena protonin täydellinen vapautuminen voidaan pakottaa lisäämällä voimakasta pelkistintä natriumia , jolloin protonit pelkistetään alkyylivedyksi ja poistetaan siten tasapainosta. Kemialliset synteesit voidaan sitten suorittaa tällä tavalla tuotettujen CH- tai NH-happoyhdisteen anioneilla.
Karboksyylihapot
Karboksyylihapot p K S -arvot 3,8 (muurahaishappo) ja suuremmat ovat huomattavasti vahvempia happoja kuin alkoholien kanssa p K S -arvot 15,9 (etanoli) ja korkeampi. Karboksyylihappojen happolujuus kasvaa entisestään, jos muita elektroneja vetäviä ryhmiä on läsnä karboksiryhmän läheisyydessä (a-, p- tai y-asemassa). Niin on z. B. trifluorietikkahappoa p K S 0,23 voidaan kuvata vahvaa happoa, verrattuna substituoimaton heikkoa etikkahappoa s K S 4,75. Molemmat hapot ovat vahvempia happoja kuin 2-hydroksipropionihappo happo maitohappo p K S 3,9, joka puolestaan on vain hieman vahvempi happo kuin normaali propionihappo p K S 4,1.
Alkoholit, fenolit, enolit
Un substituoitu alkoholit (pKa : n on suurempi kuin 16), on vain hyvin pieni happamuuksilla, kun fenolit ja naftolit , koska mesomerism stabiloinnin tuloksena fenaatteja ovat selvästi hapan fenoli on pKa : n arvo on 9,9-kertaiseksi 10 6 enemmän hapan z . B. etanolia (jonka pK s 16). Fenolien aromaattisten rengasjärjestelmien substituentit, joilla on -I- tai -M-vaikutus, voivat suuresti lisätä fenolien ja naftolien happamuutta stabiloimalla muodostuneiden anionien negatiivisen varauksen. Jos läsnä on useita tällaisia substituentteja, se voi johtaa voimakkaasti happamiin yhdisteisiin, kuten. B. pikriinihapolla (pK s 0,3), jossa on kolme nitroryhmää (-M vaikutus) aromaattiseen renkaaseen, tai pentakloorifenolilla (pK s 4,7) (-I-vaikutus). Erityisessä tapauksessa enediol askorbiinihappoa , jonka pK a on enemmän hapan kuin 4,2 etikkahappoa (pK a 4,8), on jo tehty.
Tiolit
Tiolien happamuus on korkeampi kuin vastaavilla alkoholeilla; saadut tiolaatit ovat vakaampia kuin alkoholaatit . Tämä osoitetaan vertaamalla analogisia yhdisteitä etanolia (pK s 16) ja etaanitiolia (myös etyylimerkaptaania , pK s 12).
Rikkihappoesterit ja sulfonihapot
Monoesteri rikkihappo ja sulfonihapot pKa s arvo, joka on verrattavissa, koska samankaltaista rakennetta pK : n arvo toisen dissosiaatiovaiheen rikkihappoa (pK a -arvo 1,9). P-tolueenisulfonihappo kuten, jonka pKa : n 0,7. Mono-esteri rikkihapon kanssa lauryylialkoholi , ns lauryyli- sulfaatti , on enemmän hapan kuin sulfonihapon, pKa : n arvo -0,09 ja on sen vuoksi huomattavasti vähemmän hapan kuin protonin ensimmäisen dissosiaatiovaiheen rikkihapon (pK s- arvo −3).
Fosforihappoesterit ja fosfonihapot
Fosforihapon mono- ja diesterit ( fosforihappoesterit ) ja fosfonihapon orgaaniset johdannaiset ( kutsutaan yleisesti fosfonaateiksi ) ovat dissosiaatiovaiheesta riippuen keskitasoisia tai heikkoja happoja.
CH- ja NH-happamat yhdisteet
Jopa hiilivedyt, joissa ei ole karboksi-, hydroksyyli- tai sulfanyyliryhmää, voivat toimia happoina niiden CH- tai NH-happamuuden vuoksi. Useiden sidosten ja vierekkäisten funktionaalisten ryhmien tai heteroatomien esiintyminen on happamuuden syy. Tunnetuin CH-happama yhdiste on etyni ( asetyleeni ), jolla kolmoissidoksen takia pKs: n arvo on 25 (etaani: 50). Muita esimerkkejä ovat nitroetaani (pK s 8,6) ja nitrosyklopentadieeni , joka on happamampi (pK s 3,3) kuin muurahaishappo (3,75). Deprotonaation aikana muodostuu aromaattisen syklopentadienyylianionin johdannainen nitrosyklopentadieenistä . Myös tässä mesomeeriset vaikutukset yhdessä induktiivisten vaikutusten kanssa määrittävät yhdisteiden happamuuden. Asetonitriili on toinen esimerkki yksinkertaisesta CH-happamasta yhdisteestä. Tunnettuja NH-happamia yhdisteitä ovat ftalimidi (pK s = 8,3) ja sulfonyyliureat ( tolbutamidin pKa on 5,16).
Yleiskatsaus
Aineen luokka happama funktionaalinen ryhmä esimerkki pK s- arvo 25 ° C: ssa Karboksyylihapot Karboksiryhmä : R-COOH  etikkahappo
etikkahappo
4.8 Substituoidut
karboksyylihapotKarboksiryhmä: R-CH x X y -COOH  Trifluorietikkahappo
Trifluorietikkahappo
0,23 aromaattiset
karboksyylihapotKarboksiryhmä: Ar-COOH  Bentsoehappo
Bentsoehappo
4.2 Alkoholit Hydroksiryhmä : R-OH  Etanoli
Etanoli
16 Fenolit Hydroksiryhmä: Ar - OH
(Ar = aryyli ) fenoli
fenoli
9.9 Naftolit Hydroksiryhmä: Ar - OH
(Ar = aryyli )a-naftoli 9.3 Korvatut fenolit
(substituentit, joilla on -I-vaikutus
, kuten halogeenit , nitroryhmät )Hydroksiryhmä: O 2 N - Ar - OH
(Ar = aryyli ) Pikriinihappo
Pikriinihappo
0.4 Enols Hydroksiryhmä (enoli): C = C-OH  Askorbiinihappo
Askorbiinihappo
4.2 Tiolit R-SH  Etaanitiolia (C 2 H 5 -SH)
Etaanitiolia (C 2 H 5 -SH)12 Rikkihappoesteri
( sulfaatti )R-O-SO 3 H Rikkihappododekyyliesteri Happamuuden arvo -0,09
Sulfonihapot
(alkyylisulfonihapot)R-SO 3 H H 3 C-SO 3 H metaanisulfonihappo −0,6 Sulfonihapot
(areenisulfonihapot)R - Ar - SO 3 H
(Ar = aryyli )H 3 C-C 6 H 4 -SO 3 H p -tolueenisulfoni- happo ≈ 0,7 Fosfaatit
(= fosforihappoesteri )R-O-PO (OH) 2 Adenosiinimonofosfaatti 3.3 org. Fosfonihapot
(ks fosfonaatit )R-PO (OH) 2 H 3 C-PO (OH) 2 metyylifosfonihapon 2.35 CH-happamat yhdisteet
alkyynejäH-C C-R 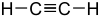 Etiini
Etiini
25 CH-happamat yhdisteet
nitroalkaanitO 2 N-CRR'-H 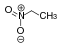 Nitroetaani
Nitroetaani
8.6 CH-happamat yhdisteet
β-dikarbonyylitRC = OCH 2 C = OR '  Asetyyliasetoni
Asetyyliasetoni
≈ 9 NH-happamat yhdisteet
imidejäR- (CO) 2 NH  Ftalimidi
Ftalimidi
8.3 Epäorgaaniset hapot vertailua varten Mineraalihapot HO-SO 2 -OH  rikkihappo
rikkihappo
−3
Yksittäiset todisteet
- ↑ Alfons Hädener, Heinz Kaufmann: Orgaanisen kemian perusteet. Springer, 2006, ISBN 978-3-7643-7040-4
- ^ A b Hans Beyer ja Wolfgang Walter : Organische Chemie , S. Hirzel Verlag, Stuttgart, 1984, s. 521, ISBN 3-7776-0406-2 .
- ↑ Merkintä tolbutamidin vuonna ChemIDplus tietokantaan Yhdysvaltain National Library of Medicine (NLM), pääsee 25. maaliskuuta 2021 mennessä.
- ↑ a b c d chem.wisc.edu: pKa Data , koostaja R. Williams (PDF, 78 kt).
- ↑ a b CRC Handbook of Tables for Organic Compound Identification , kolmas painos, 1984, ISBN 0-8493-0303-6 .
- ↑ Rappoport, Zvi., Frankel, Max.: Käsikirja taulukoista orgaanisten yhdisteiden tunnistamiseksi . 3D-painos. Chemical Rubber Co, Cleveland 1967, ISBN 0-8493-0303-6 .
- ↑ ChemieOnline-kirjain E (etyylimerkaptaani) .
- ^ PH Stahl, CG Wermuth: Handbook of Pharmaceutical Salts: Properties, Selection, and Use , 2002, Helvetica Chimica Acta, ISBN 3-906390-26-8 .
- ↑ ChemieOnline-kirje P
- ↑ ChemieOnline-kirje N
- ↑ ChemieOnline-kirje A








