Ketjureaktio (kemia)
Kemiallinen ketjureaktio on reaktio , jossa alku tapahtuma laukaisee reaktio, jonka välituote (usein radikaaleja) kokonaan tai osittain toimii lähtökohtana yhden tai useamman myöhempiä reaktioita ja joka päättyy terminaatiokodoni reaktio.
tarina
Max Planckin tutkimuksen jälkeen on ollut tiedossa, että valo koostuu erillisistä kvanteista . Magnetointi yhden kemiallisen reaktion valokvantin voisi johtua tästä, mutta ei äärimmäisen valoherkkyyttä joihinkin reaktioihin, jossa kvantti saanto oli vuonna suuruusluokkaa 10 4 kohteeseen 10 6 .
Max Bodensteinilla , joka oli jo suorittanut habitaation kemiallisen kinetiikan kaasureaktioista vuonna 1899 , oli vuonna 1913 ajatus, että tämä johtui ketjureaktiosta. Tämä tarkoittaa, että kun kaksi molekyyliä reagoi, ei vain reaktion lopputuote voi syntyä, vaan myös epävakaat molekyylit, jotka voivat jatkaa ketjua.
Tanskalainen kemisti Jens Anton Christiansen ja hollantilainen fyysikko Hendrik Anthony Kramers huomauttivat vuonna 1923, että ketjureaktiot voivat laukaista myös kahden molekyylin törmäyksen. He tutkivat myös ketjureaktion haarautumisen mahdollisuutta räjähdyksen kanssa.
Fosforin palamisen tutkimusten aikana vuonna 1926 Juli Borissowitsch Chariton ja Z. Valta havaitsivat, että reaktio väheni yllättäen happipitoisuudessa tietyn pitoisuuden yläpuolella. Näiden Nikolai Nikolajewitsch Semjonowin kokeiden jatkaminen johti räjähdysrajan löytämiseen ja Kramersin ja Christiansenin ajatusten vahvistamiseen.
Semjonow ja Hinshelwood tutkivat myös oksihydrogeenireaktiota, josta heille myönnettiin vuonna 1956 kemian Nobel-palkinto "kemiallisten reaktioiden mekanismien tutkimisesta" .
Ketjureaktioilla on suuri tekninen ja taloudellinen merkitys vapaiden radikaalien ja kationisen polymeroinnin yhteydessä. Klooriradikaaleilla on merkittävä ympäristövaikutus: Ketjun käynnistiminä ne hajottavat noin 100 000 otsonimolekyyliä ketjureaktiossa ja edistävät siten otsonikerroksen hajoamista .
Haarautumaton ketjureaktio
Jos radikaalisissa ketjureaktioissa syntyy vain yksi radikaali radikaalia kohti, puhutaan haarautumattomista ketjureaktioista.
Esimerkki tästä on kloorikaasureaktio , jossa vety ja kloori reagoivat muodostaen kloorivetyä seuraavan yhtälön mukaisesti:
Reaktio tapahtuu altistuksessa tai lämpöaktivoinnissa, vety- ja klooriradikaalien ollessa mukana ketjun kantajina .
Järjestelmän yksinkertainen kineettinen kuvaus saavutetaan käyttämällä Bodensteinin lähes stationaarisuusperiaatetta . Lasi-stationaarinen periaate perustuu oletukseen, että muodostuneiden välituotteiden pitoisuus on vakio ajan suhteen, ts. Muodostumisnopeus on yhtä suuri kuin jatkokehityksen nopeus.
Yleistä seurantareaktiota varten
reaktionopeusvakioiden kanssa ja seurauksena ovat seuraavat reaktionopeudet:
Bodensteinin lähes paikallaan olevan periaatteen mukaisesti oletetaan, että B: n pitoisuus pysyy muuttumattomana.
- .
Tuloksena on:
ja
- .
Ketjureaktiot polymeerituotteiden kanssa
Taloudellisesti merkittävä ketjureaktio on olefiinien radikaali polymerointi . Ketjun käynnistämiseksi käytetään niin kutsuttuja radikaaleja aloitusaineita , kuten dibentsoyyliperoksidia , toisin sanoen yhdistettä, joka hajoaa helposti termisesti tai fotolyyttisesti radikaaleiksi. Tämä kiinnittyy olefiiniin ja muodostaa siten primäärisen radikaalin, johon muut olefiinit kiinnittyvät muodostaen hiili-hiilisidoksen. Reaktio lopetetaan joko suhteettomuudella (oma-inhibitio) tai radikaaleja poistavien aineiden lisäämisellä (ulkoinen esto). Ketjun keskimääräistä pituutta (keskimääräinen polymeroitumisaste ) voidaan säätää radikaali-initiaattorin ja monomeerin alkupitoisuuksien suhteen.
Haarautuneet ketjureaktiot
Jos radikaaleja ketjureaktioita kohti syntyy useita radikaaleja radikaalia kohti, puhutaan haarautuneista ketjureaktioista.
Oxyhydrogen reaktio on esimerkki haarautuneet reaktio, jossa vetyä ja happea reagoimaan , jolloin muodostuu vettä mukaisesti seuraavan yhtälön avulla:
Reaktio tapahtuu vetyn, hapen ja hydroksyyliradikaalien osallistuessa ketjun kantajina .
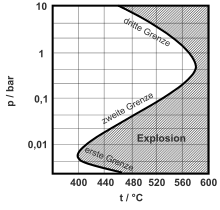
Seoksen paineesta, lämpötilasta ja koostumuksesta riippuen tapahtuu räjähdys, jos ketjun haarautumisreaktiot ovat todennäköisempiä kuin ketjun päättymisreaktiot. Jos paine on liian alhainen tai happipitoisuus on liian korkea, päättymisreaktiot ovat todennäköisempiä kuin ketjun haarat ja järjestelmä on alueella alemman räjähdysrajan alapuolella . Suuremmalla paineella ja oikeassa sekoitussuhteessa alempi räjähdysraja ylitetään ja seos räjähtää. Jopa korkeampi paine tai vetykonsentraation lisäys tarkoittaa, että ketjun lopetusreaktiot ovat taas vallitsevia esimerkiksi rekombinaation kautta ja kokonaisreaktionopeus hidastuu.
Katso myös
kirjallisuus
- WJ Moore, DO Hummel, G. Trafara, K. Holland-Moritz: Fysikaalinen kemia , 1236 sivua, Gruyter kustantamo (1986), ISBN 3-11-010979-4
- J. Bülle, A. Hüttermann: Orgaanisen kemian perustiedot , Verlag Wiley-VCH, ISBN 3-527-30847-4 ( rajoitettu esikatselu Google- teoshaulla) , s.33 .
Yksittäiset todisteet
- ↑ Merkintä ketjureaktiosta . Julkaisussa: IUPAC Compendium of Chemical Terminology ("kultakirja") . doi : 10.1351 / goldbook.C00960 .
- ^ Ludwig Hartinger, käsikirja jätevedestä ja kierrätystekniikasta metalliteollisuudelle .
- Bod M. Bodenstein: Klooriräjähdyskaasun kinetiikasta. Z. Phys. Chem. 85 (1913) 329.
- ↑ J. A. Christiansen, HA Kramers: Z. Phys. Chem. 104 (1923) 451.
- ↑ Nykyaikaisen fysiikan päällikkö: HA Kramersin tieteellinen panos , kirjoittanut D. ter Haar.
- ↑ Nikolai Nikolajewitsch Semjonow: Joitakin ketjureaktioihin ja polttoteoriaan liittyviä ongelmia (PDF; 133 kB), Nobelin palkinnon luento 1956.
- ^ Cyril Norman Hinshelwood: Kemiallinen kinetiikka viime vuosikymmeninä (PDF; 54 kB), Nobelin palkinnon luento 1956.
- ↑ Kloori maailmassa: vai hyvä huono? , kirjoittaneet David P.Gilkey ja Holly A. Williams.
- ^ Polystyreeni , Hermann Gausepohl, D.Braun, Roland Gellert.











![{\ displaystyle {\ frac {\ mathrm {d} [\ mathrm {A}]} {\ mathrm {d} t}} = - k_ {1} [\ mathrm {A}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/50e3aaf5b967cf21c0ab1666383a475ad7544626)
![{\ displaystyle {\ frac {\ mathrm {d} [\ mathrm {B}]} {\ mathrm {d} t}} = k_ {1} [\ mathrm {A}] -k_ {2} [\ mathrm { B}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0ba39fe5cc400b9e2bcb3ac6a2995c62d9c139d8)
![{\ displaystyle {\ frac {\ mathrm {d} [\ mathrm {C}]} {\ mathrm {d} t}} = k_ {2} [\ mathrm {B}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f375670c8eacfbdb53f8bfc8d7f9569b88bc4e06)
![{\ displaystyle {\ frac {\ mathrm {d} [\ mathrm {B}]} {\ mathrm {d} t}} = 0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b385dc648bbcbe00b8b9317f05f78d69ed63a9dd)
![{\ displaystyle {\ frac {\ mathrm {d} [\ mathrm {B}]} {\ mathrm {d} t}} = 0 = k_ {1} [\ mathrm {A}] -k_ {2} [\ mathrm {B}] \ Rightarrow \; [\ mathrm {B}] = {\ frac {k_ {1}} {k_ {2}}} [\ mathrm {A}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05d34a40fbf6262c42f39643ad8b4aa3a864ceba)
![{\ displaystyle {\ frac {\ mathrm {d} [\ mathrm {C}]} {\ mathrm {d} t}} = k_ {1} [\ mathrm {A}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/229b92c3170bf7c912a1458c96ec23e354dc6d00)
![{\ displaystyle [\ mathrm {C}] = [\ mathrm {A}] _ {0} \ vasen (1- \ mathrm {e} ^ {- k_ {1} t} \ oikea)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c2b7c1322906da6604ba54303c98cddde17576a8)