Osteoklasti
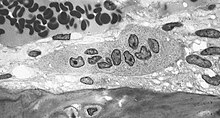
Osteoklastit ( muinaiskreikkalainen ὀστέον ostéon , saksalaiset 'luut' ja κλᾰστός klastós , saksaksi 'rikki' ; yksikkö : osteoklasti ) ovat monisoluisia soluja, jotka syntyvät luuytimen mononukleaaristen esisolujen fuusioinnista . Ne kuuluvat mononukleaariseen fagosyyttiseen järjestelmään (MPS). Sen päätehtävä on luukudoksen resorptio .
Osteoklastit kehittyä hematopoieettisten kantasolujen in luuytimessä . Jotkut niistä osoittavat kiertävien monosyyttien ja kudosten makrofagien ominaisuuksia .
säätö
Seuraavat tekijät voivat stimuloida osteoklastien muodostumista ja siten vaikuttaa luuhun resorptoivasti:
- Deksametasoni
- 1,25- (OH) 2 VitD 3
- Lisäkilpirauhashormoni
- Lisäkilpirauhashormoniin liittyvä proteiini (PTHrP)
- Peroksisomiproliferaattorin aktivoima reseptori -y (PPARγ)
- Prostaglandiini E2
- Trijodityroniini (T3)
- erilaiset sytokiinit
Seuraavat tekijät voivat estää osteoklastien toimintaa ja siten vaikuttaa reseptoreihin:
Nämä tekijät johtavat PU.1 -transkriptiotekijän aktivoitumiseen, mikä lisää makrofagien muuttumista osteoklasteiksi. Osteoklastit aktivoidaan myös RANK -ligandin (RANKL) kautta. Osteoprotegeriini (OPG) on proteiini, joka estää osteoklastien erilaistumista sitomalla RANK -ligandit. Nämä ligandit puolestaan eivät enää voi sitoutua makrofagien RANKiin eivätkä siksi enää stimuloida niitä erilaistumaan osteoklasteiksi. Tällä tavoin osteoprotegeriini estää luiden hajoamisen.
Osteoklastien toimintaa ohjaavat hormonaalisesti lisäkilpirauhashormoni (aktivointi, kalsiumin vapautuminen) ja kalsitoniini (inaktivointi, kalsiumin varastointi), joten luuta käytetään kalsiumin välivarastona kalsiumin homeostaasin säätelyyn . On kuitenkin huomattava, että itse osteoklastilla ei ole lisäkilpirauhashormonin reseptoreita, vaan se aktivoituu toissijaisesti osteoblastien (RANKL) kautta, joilla on tämä reseptori. Osteoklastilla on kuitenkin kalsitoniinireseptoreita, jotka voivat suoraan estää sen toimintaa.
Luun resorptio liittyy yleensä läheisesti osteoblastien seuraavaan uuteen synteesiin . Tätä prosessia, joka tunnetaan nimellä luukudoksen remodeling, käytetään sopeutua kuormituksiin ja estää materiaalin väsymistä.
histologia
Osteoklastit ovat suuria soluja, joiden halkaisija on 50-100 µm ja jotka voivat sisältää jopa 10 solun ydintä . Niitä esiintyy luun pinnalla resorptiokoloissa (Howship lacunae). Aivan kuten läheisesti liittyvät makrofagit , ne pystyvät liikkumaan ameboideja .
Apikaalisella napa osteoklastien kasvot luu. Tässä voidaan erottaa eri alueet:
- Keskellä on kirkas, juovikas ja rakkuloita sisältävä vyöhyke, jossa solukalvo on taitettu voimakkaasti harjareunan muodossa . Se tunnetaan rypistyneenä rajana ja on todellinen luun resorptiopaikka . Valomikroskoopin alla se näyttää vaalealta.
- Reuna -alueella voimakas väri näkyy valomikroskoopilla. Siellä osteoklasti tarttuu luuaineeseen tartuntalaitteistonsa ( integriinien ) kanssa. Liimauslaite koostuu enimmäkseen ns. Podosomeista . Osteoklastin ja luun välillä on hyvin läheinen kosketus, etäisyys vain 0,3–0,5 nm, joten tätä aluetta kutsutaan myös tiivistysvyöhykkeeksi .
- Tiivistysvyöhykettä ympäröivää sytoplasmaa kutsutaan kirkkaaksi vyöhykkeeksi , koska siinä ei ole lainkaan soluorganelleja . Sen sijaan täällä on suuri määrä supistuvia proteiineja .
fysiologia
Osteoklastin ja luuaineen välisessä tilassa on merkittävästi alempi pH -arvo (noin 4,5), jonka ylläpitää aktiivinen protonikuljetus ja joka hajottaa mineralisoidut matriisikomponentit. Lisäksi osteoklastit vapauttavat proteolyyttisiä entsyymejä, jotka liuottavat kollageenisen luun matriisin . Kollageenin fragmentit vapautetaan ovat fagosytoituja . Tämä luo Howship -aukot, joita voidaan kuvata myös osteoklastien "ruokintareitiksi". Niiden kapasiteetti on huomattava: yksi osteoklasti voi hajottaa saman määrän luuta kuin 100 osteoblastia kerääntyy tänä aikana.
Sairaudet
Vähentynyt osteoklastien aktiivisuus
- Geneettisesti määritetyssä osteopetroositautien ryhmässä ja sen alamuodossa pyknodysostoosissa osteoklastien aktiivisuus vähenee suuresti.
- PLOSL (polykystinen lipomembranoottinen osteodysplasia, johon liittyy skleroottinen leukoenkefalopatia , Nasu-Hakola-tauti )
Lisääntynyt osteoklastien aktiivisuus
Lisääntynyttä osteoklastiaktiivisuutta voidaan havaita seuraavissa sairauksissa
- osteoporoosi
- Hyperparatyreoosi
- Osteodystrophia deformans (Pagetin tauti)
- Aseptinen luun nekroosi
- Nivelreuma
- Osteogenesis imperfecta
- Rintasyöpä
- Giant solukasvain
- Gorham-Stoutin oireyhtymä
Katso myös
kirjallisuus
- T. Bellido et ai.: Interleukiini-6: n, osteoklastogeneesin ja luumassan säätely androgeenien avulla. Androgeenireseptorin rooli. Julkaisussa: J Clin. Sijoittaa. 95, 1995, s. 2886-2895.
- G. Girasole, RL Jilka, G. Passeri, S. Boswell, G. Boder, DC Williams, SC Manolanas: 17-estradioli inhiboi interleukiini-6 tuotantoa luuytimestä peräisin stroomasolujen ja osteoblastien in vitro: Mahdollinen mekanismi anti -estrogeenien osteoporoottinen vaikutus. Julkaisussa: J. Clin. Sijoittaa. 89, 1992, s. 883-891.
- Hattersley, JA Kirby, TJ Chambers: Osteoklastien esiasteiden tunnistaminen monilinjaisissa hematopoieettisissa pesäkkeissä. Julkaisussa: Endokrinologia. 128, 1991, s. 259-262.
- RL Jilka et ai.: Lisääntynyt osteoklastien kehitys estrogeenin menetyksen jälkeen: Interleukiini-6: n välitys. Julkaisussa: Science . 257, 1992, s. 88-91.
- N. Kurihara, C. Chenu, M. Miller, C. Civin, GD Roodman: Sitoutuneiden mononukleaaristen esiasteiden tunnistaminen osteoklastin kaltaisille soluille ihmisen pitkäaikaisissa luuydinviljelmissä. Julkaisussa: Endokrinologia. 126, 1990, s. 2733-2741.
- K. Matsuzaki et ai: Osteoklastien erilaistumistekijä (ODF) indusoi osteoklastien kaltaista solujen muodostumista ihmisen perifeerisen veren mononukleaarisoluviljelmissä. Julkaisussa: Biochem Biophys Res Commun . 246, 1998, s. 199-204.
- NK Shevde, AC Bendixen, KM Dienger, JW Pike: Estrogeenit tukahduttavat RANK-ligandin aiheuttaman osteoklastien erilaistumisen stroomasoluista riippumattoman mekanismin kautta, johon liittyy c-Jun-tukahduttaminen. Julkaisussa: Proc Natl Acad Sci USA . 97, 2000, s. 7829-7834.
- MM Tondravi, SR McKercher, K. Anderson, JM Erdmann, M. Quiroz, R. Maki, SL Teitelbaum: Osteopetroosi hiirillä, joilla ei ole hematopoieettista transkriptiotekijää PU.1. Julkaisussa: Nature . 386, 1997, s. 81-84.
- K. Tsukii et ai: Osteoklastien erilaistumistekijä välittää olennaisen signaalin luun resorptiolle, jonka indusoi 1 alfa, 25-dihydroksivitamiini D3, prostaglandiini E2 tai lisäkilpirauhashormoni luun mikroympäristössä. Julkaisussa: Biochem Biophys Res Commun. 246, 1998, s. 337-341.
