Kosteuttaa
Hydraatit ( antiikin kreikan ὕδωρ hydōr 'vesi') ovat yleensä kemian aineita , jotka sisältävät vettä . Termiä käsitellään jonkin verran eri tavoin kemian eri alueilla. Toisin kuin hydraatit, ovat anhydridit , yhdisteet, joista vesi on poistettu.
Epäorgaaniset hydraatit
Epäorgaaniset hydraatit ovat solvaatteja , joten ne sisältävät molekyylivettä, esimerkiksi kiteytysvedenä . Kiteytysvettä sisältävien kiteiden lisäksi komplekseihin, joissa on vesiligandeja, viitataan myös hydraateina. Aineita, joissa ei ole kiteytyvää vettä, kutsutaan myös Kutsuttu anhydraateiksi .
Hydraateissa oleva kiteytymisvesi voidaan sitoa tiettyihin ioneihin vetysidoksilla tai muilla molekyylien välisillä voimilla, mutta voi myös olla, että se on pääasiassa sisällytetty, koska se luo suotuisamman kiderakenteen . Kiteisissä hydraateissa ionisten yhdisteiden ja kiteisen veden välillä on tietty stökiometrinen suhde. Monissa tapauksissa on mahdollista käyttää useita hydraatteja, joissa on erilaisia määriä kiteytyvää vettä, joten tunnetaan natriumkarbonaatin modifikaatiot yhdellä, kahdella, viidellä, seitsemällä ja kymmenellä ekvivalentilla kiteytyvää vettä ja natriumkarbonaattia ilman kiteytysvettä.
Hydraatit syntyä nesteytys , enimmäkseen aikana kiteytyksen vesiliuoksista. Hydraatit, joissa on runsaasti kiteytymisvettä, voidaan dehydratoida esimerkiksi kuumentamalla, jolloin muodostuu joko muita vähemmän kiteytyvää vettä sisältäviä hydraatteja tai vedetön yhdiste, jolloin värimuutokset tapahtuvat usein samanaikaisesti, esim. B. koboltti (II) kloridi:
Hydraattien tunnistamiseksi empiirisissä kaavoissa tämä ei sisälly suoraan kaavaan, mutta se sijoitetaan empiirisen kaavan loppuun n H 2 O: na (n on kiteytyvän veden määrä, joka esiintyy kiteessä olevaa kaavan yksikköä kohden ). CaSO 4 · 2 H 2 O kuvataan, esimerkiksi, kalsiumsulfaatin kahdella ekvivalentilla kidevettä, joka vastaa kipsiä . -Xxxhydrate on lisätty nimi yhdiste , jossa xxx on kreikkalainen tai Latinalaisen numero varten vastaavan määrän kidevettä. Vastaavasti kipsiä kutsutaan systemaattisesti kalsiumsulfaattidihydraatiksi.
| Sukunimi | Lukumäärä vesimolekyylejä |
Esimerkit ( suolat ) | kem. kaava |
|---|---|---|---|
| at hydraatti | 0 | Magnesiumkloridi anhydraatti | MgCl 2 |
| Hemi hydraatti | 1 / 2 | Kalsiumsulfaattihemihydraatti | CaSO 4 • 0,5H 2 O |
| mono -hydraatti | 1 |
Natriumvetysulfaatilla monohydraatti Cesium tiosulfaatti-monohydraatti |
NaHSO 4 • H 2 O Cs 2 [S 2 O 3 ] • H 2 O |
| Sesqui- hydraatti | 1.5 | Kaliumkarbonaattia seskvihydraattia | K 2 CO 3 • 1,5 H 2 O |
| Di hydraatti | 2 |
Kalsiumsulfaatti -dihydraatti, kalsiumkloridi -dihydraattia |
CaSO 4 · 2H 2 O CaCI 2 · 2H 2 O |
| Tri hydraatti | 3 |
Natriumasetaatti -trihydraattia, lyijy (II) asetaattia trihydraatti |
NaC 2 H 3 O 2 • 3 H 2 O PbC 4 H 6 O 4 • 3 H 2 O |
| Tetra- hydraatti | Neljäs | Kaliumnatriumtartraatti- tetrahydraatti | KNaC 4 H 4 O 6 · 4 H 2 O |
| Penta- hydraatti | 5 | Kuparisulfaattia pentahydrate | CuSO 4 · 5 H 2 O |
| heksa hydraatti | 6. |
Alumiinikloridi heksahydraatti, koboltti (II) kloridi heksahydraatti |
AICI 3 · 6H 2 O CoCI 2 · 6H 2 O |
| hepta hydraatti | Seitsemäs |
Magnesiumsulfaatti heptahydraatti, rauta (II) sulfaatti heptahydraattia, sinkki (II) sulfaatti -heptahydraatti |
MgSO 4 • 7H 2 O FeSO 4 • 7H 2 O ZnSO 4 • 7H 2 O |
| okta hydraatti | 8. | Praseodyymi (III) sulfaatti oktahydraatti | Pr 2 (SO 4 ) 3 · 8H 2 O |
| Ei hydraattia | 9 | Kromi (III) -nitraatti- nonahydraatti | Op (NO 3 ) 3 · 9H 2 O |
| Deka- hydraatti | 10 |
Natriumsulfaattia dekahydraatti (Glauber-suola), natriumkarbonaattia dekahydraatti |
Na 2 SO 4 · 10 H 2 O Na 2 CO 3 · 10 H 2 O |
| Undeca- hydraatti | 11 | Magnesium kromaatti undecahydrate | Mg [CrO 4 ] · 11H 2 O |
| Dodeca- hydraatti | 12 | Natriumfosfaatti Dodekahydraatti | Na 3 PO 4 • 12 H 2 O |
Orgaaniset hydraatit
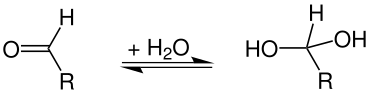
Orgaanisessa kemiassa hydratoituja yhdisteitä kutsutaan hydraateiksi. Nämä eivät yleensä ole yhdisteitä, jotka sisältävät molekyylivettä, mutta ne, joissa vesi on lisätty kemiallisesti yhdisteeseen additioreaktion avulla . Esimerkkejä ovat geminaaliset diolit tai aldehydihydraatit , jotka ovat hydratoituja aldehydejä :
Suurin osa aldehydihydraateista on epävakaita, lukuun ottamatta kloorihydraattia ja formaliinia . Geminaaliset triolit (ortokarboksyylihapot = hydratoidut karboksyylihapot ), kuten ortokarbonihappo (tetrahydroksimetaani), ovat stabiileja vain estereidensä muodossa .
On myös stabiileja orgaanisia yhdisteitä, jotka sisältävät hydraatiovettä, esimerkiksi ( R ) - kysteiinin · hydrokloridi · monohydraatin [ L- kysteiini-hydrokloridia · monohydraatti], joka on tuotettu teollisessa mittakaavassa.
Kaasun hydraatit
Tapauksessa kaasuhydraattien , toisin kuin aineita, jotka sisältävät kidevettä, se ei ole vettä aine, mutta muuten kaasumaisia yhdisteitä, kuten metaania , rikkivedyn tai hiilidioksidia, joka on suljettu , että jään . Muodostuu klatraatti , inkluusioyhdiste ilman suuria fyysisiä vetovoimia jään ja kaasun välillä. Tunnetuin kaasuhydraatti on metaanihydraatti .
hiilihydraatit
Hiilihydraatit sisältävät nimessään -hydraattia, mutta eivät kuulu hydraattiryhmään.
kirjallisuus
- Pääsy hydraatteihin. Julkaisussa: Römpp Online . Georg Thieme Verlag, käyty 3. kesäkuuta 2012.