Titaani (IV) oksidi
| Kristallirakenne | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| Titaani (IV) oksidi modifioidussa rutiilissa __ Ti 4+ __ O 2− | ||||||||||||||||||||||
| Yleistä | ||||||||||||||||||||||
| Sukunimi | Titaani (IV) oksidi | |||||||||||||||||||||
| muut nimet | ||||||||||||||||||||||
| Suhdekaava | TiO 2 | |||||||||||||||||||||
| Lyhyt kuvaus |
valkoinen, kiteinen jauhe |
|||||||||||||||||||||
| Ulkoiset tunnisteet / tietokannat | ||||||||||||||||||||||
| ||||||||||||||||||||||
| ominaisuudet | ||||||||||||||||||||||
| Moolimassa | 79,866 g mol - 1 | |||||||||||||||||||||
| Fyysinen tila |
kiinteä |
|||||||||||||||||||||
| tiheys |
|
|||||||||||||||||||||
| Sulamispiste |
1855 ° C |
|||||||||||||||||||||
| kiehumispiste |
2900 ° C |
|||||||||||||||||||||
| liukoisuus |
|
|||||||||||||||||||||
| Taitekerroin |
optisesti anisotrooppinen , kaksinkertainen tai kaksiakselinen |
|||||||||||||||||||||
| turvallisuusohjeet | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Sveitsi: 3 mg m −3 (mitattuna hengitettävänä pölynä ) |
|||||||||||||||||||||
| Toksikologiset tiedot | ||||||||||||||||||||||
| SI -yksiköitä käytetään mahdollisuuksien mukaan ja tavanomaisesti . Ellei toisin mainita, annetut tiedot koskevat vakio -olosuhteita . Taitekerroin: Na-D-viiva , 20 ° C | ||||||||||||||||||||||
Titaani (IV) oksidia ( titaanidioksidi ) on IV- arvo oksidi ja titaanin . Tämän polymorfisen oksidin lisäksi on olemassa useita ei-stökiömetrisiä titaanin suboksideja, niin kutsuttuja Magneli-faaseja, sekä titaani (III) oksidia ja titaani (II) oksidia .
Titaanidioksidilla on laaja valikoima käyttötarkoituksia valkoisena pigmenttinä , minkä vuoksi maailmassa tuotetaan vuosittain 4-5 miljoonaa tonnia. Pääasiallisia käyttöalueita ovat pinnoitteet, kuten lakat ja maalit, joita seuraavat muovivärit ja laminaattipaperit. Värilliset tuotteet sisältävät yleensä myös valkoisia pigmenttejä suuren peittokyvyn saavuttamiseksi.
Titaanidioksidin käyttö elintarvikelisäaineena on kiistanalainen. Toukokuussa 2021 Euroopan elintarviketurvallisuusviranomainen (EFSA) julisti E 171 -luokan aineen käytön vaaralliseksi. Ranska oli jo kieltänyt sen käytön elintarvikkeissa vuonna 2020; Myös Sveitsi haluaa seurata esimerkkiä vuoden 2021 loppuun mennessä.
tarina
Jälkeen William Gregor löydettiin titaani , että ilmeniitin vuonna 1791 , Heinrich Klaproth tunnustettu titaanidioksidia rutiilin . Teollinen käyttö alkoi, kun sen erinomainen soveltuvuus valkoiseksi pigmentiksi tunnustettiin Norjassa ja Yhdysvalloissa vuonna 1908 . Vuodesta 1916 lähtien pigmenttiä tuotettiin kaupallisesti nimellä Kronos Titan White. Vuoteen 1938 asti titaanivalkoista tuotettiin vain anataasimuunnoksessa , mutta sitten yhä enemmän rutiilimuunnoksessa, koska sen fotokatalyyttinen aktiivisuus on alhaisempi ja siitä valmistettujen tuotteiden säänkestävyys on vastaavasti parempi. Rutiilimodifikaatioon perustuva valkoinen pigmentti tunnetaan myös nimellä rutiilivalkoinen.
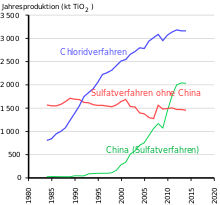
Yli puolet tuotantomäärästä käytetään pinnoitteissa, jota seuraa polymeerit ja paperi. Vuonna 2014 70 prosenttia maailman tuotannosta tuotti viisi länsimaisen valmistajan valmistajaa. Markkinajohtaja Chemoursin (USA, aiemmin DuPont ) lisäksi nämä ovat yritykset Cristal Global ( Tronoxin haltuun vuonna 2019, Saudi -Arabia), Tronox (USA), Venator Materials (Iso -Britannia, aiemmin osa Huntsmania , USA) ja Kronos (USA). Aasian suurin valmistaja on LomonBillions (Kiinan kansantasavalta). Venator Materialsin kesäkuun 2018 esittelyn mukaan viidellä suurimmalla länsimaisella valmistajalla oli 54% maailmanlaajuisesta tuotantokapasiteetista. Eniten titaanidioksidia kuluttavia alueita ovat Eurooppa (1,72 miljoonaa tonnia), Kiinan kansantasavalta (1,42 miljoonaa tonnia), muu Aasia (1 miljoona tonnia) ja Pohjois -Amerikka (0,89 miljoonaa tonnia)).
Esiintyminen
Titaani (IV) oksidia esiintyy luonnossa neljässä muunnoksessa :
- Rutiili on tetragonaalinen mineraali , jolla on enimmäkseen prismamainen tapa . Kiderakenne on avaruusryhmässä 136, joka vastaa Hermann Mauguinin symbolia P4 2 / mnm. Rutiilin TiO 2 tiheys on 4,26 g / cm 3 . Nimi rutiili tulee latinalaisesta rutiluksesta 'punertava', viitaten raudan epäpuhtauksien tuottamaan väriin.
- Anataasi muodostaa nelikulmaisia holoedrisiä kiteitä (holoedrinen tarkoittaa symmetrisintä ryhmää kidejärjestelmässä ) tetragonaalisessa muodossa eli 4 / m 2 / m 2 / m . Se kiteytyy avaruusryhmässä 141, toisin sanoen 14 1 / amd. Anataasi muuttuu peruuttamattomasti rutiiliksi 700 ° C: ssa ilmakehästä ja vieraista ioneista riippuen. Anataasin tiheys on 3,88 g / cm 3 .
- Brookite muodostaa ortorombisia mineraaleja ja kiteytyy avaruusryhmässä 61, Pbca. Brookite muuttuu myös rutiiliksi sulamispisteen alapuolella ja sen tiheys on 4,12 g / cm 3 . Teknisesti brookitilla ei ole merkitystä.
- Riesite ( IMA 2015-110a ) on korkean paineen muutos että kiteytyy , että monokliinisen kiderakenteen järjestelmä on tilaa ryhmä P 2 / c (space ryhmä no.13 ) ja löydettiin vuonna 2015 Oliver Tschauner ja Chi Ma Nördlinger Ries (Baijeri, Baden-Württemberg).
Lisämuutoksia
Luonnollisten modifikaatioiden lisäksi tunnetaan kahdeksan synteettisesti tuotettua modifikaatiota, joista kolme on metastabiileja (monokliininen, tetragonaalinen ja ortorombinen) ja viisi korkeapaineista modifikaatiota (α-PbO 2 , baddeleyite, cunnunnite sekä orthorhombic ja cubic rakenteet). Modifikaation kotoniittirakenteella ovat kuvanneet L. Dubrovinsky et ai. tunnetuimpana oksidina, jonka Vickers -kovuus on 38 G Pa ja puristusmoduuli 431 GPa (vertailuksi: timantilla on 442 GPa - 446 GPa) normaalipaineessa. Myöhemmissä tutkimuksissa saatiin erilaisia tuloksia, joiden kovuusarvot olivat pienemmät (7–20 GPa, joten pehmeämpiä kuin oksidit, kuten korundi Al 2 O 3 ja rutiili) ja puristusmoduuli (≈ 300 GPa).
| muutos | Kristallijärjestelmä | Valmistus |
|---|---|---|
| TiO 2 (B) | monoklinikka | K 2 Ti 4 O 9: n hydrolyysi ja sitä seuraava karkaisu |
| TiO 2 (H), hollandiittimainen rakenne | nelikulmainen | Kaliumnitanaattipronssin hapetus, K 0,25 TiO 2 |
| TiO 2 (R), ramssatelliittimainen rakenne | ortorombinen | Litiumtitanaattipronssin Li 0,5 TiO 2 hapettaminen |
| TiO 2 (II) -( α -PbO 2 -kaltainen rakenne) | ortorombinen | |
| Baddeleyiten kaltainen rakenne, (7 -kertainen koordinoitu Ti) | monoklinikka | |
| TiO 2 -OI | ortorombinen | |
| kuutiomainen rakenne | kuutiometriä | P > 40 GPa, T > 1600 ° C |
| TiO 2 -OII, cotunnite ( PbCI 2 ) kaltainen rakenne | ortorombinen | P > 40 GPa, T > 700 ° C |
Poiminta ja esittely
Titaanidioksidi voi olla laboratoriossa hydrolysoimalla Ti (IV) -yhdisteitä, kuten titanyylisulfaatti , titaanitetrakloridi metallialkoholaateina tai titaanitetraisopropylaatti :
- Titaanioksidisulfaatin reaktio veden kanssa titaanioksohydraatin ja rikkihapon muodostamiseksi
- Titaanitetrakloridin reaktio veden kanssa ensimmäisessä vaiheessa titaanioksikloridiksi ja suolahapoksi ja sitten titaanioksohydraatiksi ja suolahapoksi
- Titaanitetra -isopropoksidi ja vesi reagoivat muodostaen titaanidioksidia ja isopropanolia
Koska alempien n -alkanolien titaanihappoesterit reagoivat liian voimakkaasti, on suositeltavaa käyttää isopropanolia tai tert -butanoliestereitä. Titaani oxohydrate Tällä tavalla saatu, muodollisesti TiO (OH) 2 tai TiO 2 x H 2 O, muutetaan anataasiksi tai rutiilin mukaan kalsinointi , puhdasta, erittäin hehkutettu titaanidioksidi aina tuottaa rutiili ristikko. Titaani (IV) kloridin polttamista hapen kanssa käytetään harvoin laboratoriomittakaavassa. Erittäin puhdasta titaanidioksidia voidaan tuottaa hydrolysoimalla puhdistettu TiCl 4 .
Koska suurinta osaa teollisesti tuotetusta TiO 2: sta käytetään pigmenttinä, väriionit, kuten rauta, häiritsevät . Ilmeniitti (FeTiO 3 ) tai titaania sisältävä kuona päässä sähköpelkistyksessä ilmeniitin ovat yleisesti käytetään , kuten malmien varten sulfaattimenetelmällä . Tämän kuonan, kuten rutiili päässä tulva talletukset , voidaan myös käyttää teknisesti vaativa kloridi prosessi. Molemmat prosessit lisäävät merkittävästi titaanioksidin puhtautta. Värjäysionien summa on tavallisesti alle 200 ppm sulfaattiprosessissa, lähinnä niobium, alisteinen rauta, ja alle 50 ppm kloridiprosessissa, niobiumissa ja raudassa.
Titaanioksidin teollisessa tuotannossa ilmeniitistä sulfaattimenetelmällä muodostuu laimeaa happoa (laimeaa rikkihappoa), joka käytetään enimmäkseen uudelleen ilmeniitin digestoinnin jälkeen . Joissakin maissa tämä laimea happo on vielä osittain päästetään jokiin ja meriin tai polkumyynnillä tapahtuvan . In sijaan, uuttamalla käyttäen kloridi prosessi , pääasiassa rutiilista malmin tai TiO 2 kuonaa, ei salli muodostumista ohut happoa. Käytetty kloori jää suurelta osin prosessisykliin. Molemmissa prosesseissa tuotettuja rautasuoloja käytetään muun muassa kromaatin pelkistämiseen sementissä, jäteveden käsittelyssä ja biokaasulaitoksissa.
Yksittäiset kiteet
Rutiilin yksittäiset kiteet valmistetaan yleensä Verneuil -prosessilla . Joskus käytetään myös vyöhykkeen sulatusprosessia , kun taas Czochralskin prosessia kuvataan sopimattomaksi.
Anataasin yksikiteitä ei voida tuottaa sulasta. Tässä on CTR -menetelmä.
ominaisuudet
Fyysiset ominaisuudet
Titaanidioksidin sulamispiste on 1855 ° C, yhdiste on lämpöstabiili. Titaanidioksidi on myös kemiallisesti inertti . Se on valonkestävä, edullinen ja siksi tärkein valkoinen pigmentti. Se on hyväksytty elintarvikelisäaineeksi E171.
Optiset ominaisuudet
Taitekerroin on titaanioksidi on korkea, ja se osoittaa suuri hajonta . Taitekerroin riippuu myös merkittävästi kiteen modifikaatiosta. Titaanidioksidi on kaksinkertainen . Tavallisen säteen ja poikkeuksellisen säteen taitekerroinero voi saavuttaa arvon jopa .
Vuodesta coloristic kannalta, koska sen korkea taitekerroin, titaanidioksidi on korkein peittokyky kaikki valkoisia pigmenttejä ja, samaan aikaan, erinomainen vaalentamiseen teho . Titaanidioksidin suurin peittokyky on raekoolla noin 200 nm-300 nm riippuen sovelluksesta ja viitearvosta, numero- tai massapohjaisesta kokojakaumasta.
Titaanidioksidi on puolijohde , joten valenssinauha on täysin täytetty ja johtava nauha on tyhjä nollan lämpötilassa . -Aukko riippuu muutos. Kevyet kvantit, joiden energia on suurempi kuin kaistarako, absorboituvat. UV -valo voidaan myös absorboida sopivalta aallonpituudelta, mikä luo UV -suojan. Lyhytaaltoinen valosäteily nostaa elektronit valenssikaistalta johtavuuskaistalle ja jättää reiän . Kaistavälin koko riippuu kiteiden suunnasta ja nanohiukkasmateriaalin osalta myös hiukkaskoosta.
| muutos | Kaistaetäisyys (eV) | Aallonpituus (nm) | interpoloitu taitekerroin 589 nm: ssä |
|---|---|---|---|
| Anataasi | 3.23 | 385 | n e = 2,489 n o = 2,561 |
| Brookite | 3.14 | 395 | n α = 2,585 n β = 2,583 n γ = 2,702 |
| Rutile | 3.02 | 410 | n e = 2,900 n o = 2,613 |
Dielektriset ominaisuudet
Titaanidioksidilla on suhteellisen korkea dielektrisyysvakio . Rutiilille se on ε = 111 kristallografisessa a-suunnassa ja ε = 257 c-akselia pitkin. Muut lähteet antavat pienempiä arvoja, jolloin arvot riippuvat mittausparametreista, kuten taajuudesta ja lämpötilasta. Sovelluksia ovat esimerkiksi korkean k-dielektrikot .
Kemiallisia ominaisuuksia
Titaanioksideista titaanidioksidi (IV) on yleisin yhdiste. Se on kemiallisesti inertti ja voidaan liuottaa vain kuumaan rikkihappoon, fluorivetyhappoon ja kuumiin emäksiin. Se on osittain lähtöaine titanaattien valmistukseen . UV -valolla valaistuna voi tapahtua fotokatalyyttisiä radikaaleja reaktioita.
käyttää
Titaanidioksidia käytetään pääasiassa valkoista pigmenttiä ja on lueteltu Colour Index alle CI Pigment White 6 tai CI 77891. Se on kemiallisesti vakaa ja sitä käytetään merkinnän E 171 alla elintarvikelisäaineena, esimerkiksi hammastahnan, purukumin, makeisten, juuston tai kastikkeiden kirkastimena ja erottavana aineena (ks. Kohta Riskit ). Titaanidioksidipigmenttejä käytetään kosmetiikassa CI 77891. Sitä käytetään osittain myös öljyvärimaalauksessa . Titaanidioksidin teknisiin käyttökohteisiin, jotka muodostavat noin 80 prosenttia kokonaiskulutuksesta, kuuluvat maalit ja lakat , muovit ja tekstiilit; Sitä käytetään myös paperinvalmistuksessa korkean valkoisuuden saavuttamiseksi ja UV -estäjänä aurinkovoiteissa ja kirkasteissa lääkkeissä (tabletit).
pigmentti
Titaanidioksidilla on taitekerroin, joka on huomattavasti korkeampi kuin useimmilla orgaanisilla aineilla, joita käytetään värien sitomiseen. Tämä tarkoittaa, että titaanioksidista valmistetut pigmentit hajottavat valon tehokkaasti, jolloin saadaan hyvin peittävä valkoinen väri. Optimaalinen koko pigmenttien on alueella 200 nm 300 nm. Kokovalikoima tulokset Mie teoria . Hiukkaskoko vaikuttaa toisaalta opasiteettiin ja toisaalta värisävyyn; hienojakoiset pigmentit näyttävät sinertävämmiltä. Noin 60%: n markkinaosuudella tärkeimmät sovellukset ovat päällystysmateriaalit ja 25% polymeerisovellukset.
Lukuun ottamatta E171, puhdasta titaanidioksidia ei juurikaan käytetä, koska valon aiheuttamat kemialliset radikaalireaktiot tapahtuvat TiO 2: n aiheuttaman UV-suojavaikutuksen lisäksi . Pigmenttirakeiden toiminnallisuus vähentää tätä vaikutusta ja samalla parantaa väriominaisuuksia, yleensä helpomman hajottamisen avulla. Jotkut sovellukset, esim. B. Käytä kuitu- tai sementtisovelluksissa anataasipigmenttejä korkeammasta fotokemiallisesta aktiivisuudesta huolimatta, kun taas suurin osa sovelluksista koskee rutiilipigmenttejä.
Valokatalyytti
Monet valmistajat tarjoavat TiO 2 -pohjaisia fotokatalyyttejä . Nämä ovat yleensä anataasia, anataasi-rutiiliseoksia tai seostettuja titaanidioksideja, joilla on laaja valikoima mahdollisia sovelluksia. Fotokatalyysi on heterogeeninen katalyysi , jossa kaasumaiset tai liuenneet aineet reagoivat UV -valossa radikaalin reaktion tai varauskantajan siirron kautta titaanidioksidiin tai muihin aineisiin. Valaistamalla UV -valolla, jonka energia on suurempi kuin kaistarako, tai vähemmän tehokkaalla virityksellä dopingin epäpuhtauksista syntyy vapaita varauskantajia, elektroneja johtavuuskaistalla ja reikiä valenssikaistalla . Pääsääntöisesti nämä varauksen kantajan paria rekombinoitua hyvin nopeasti, mutta taivutus nauhan alueella pinnan voi johtaa varauksen kantajan erottaminen. Nämä reagoivat yleensä adsorboidun hapen ja veden kanssa muodostaen hydroksyyli- ja peroksiradikaaleja. Yleensä radikaalit reagoivat adsorboituneiden orgaanisten aineiden kanssa, paitsi jos kyseessä on suora varauksensiirto adsorbaatteihin. Reaktiotiet mineralisaation loppuun asti voivat olla hyvin monimutkaisia ja vaatia monia fotonivirityksiä.
Ulkokäyttöön käytetään esimerkkinä fotokatalyyttistä itsepuhdistusta , auringonvalon ASTM 1.5 UV-komponenttia, joka on noin 3%, enintään noin 35 W / m 2 . Sisäkäyttöön tarkoitetut sovellukset ovat yleensä epäedullisempia, toisaalta UV -komponentti on hyvin alhainen tai reaktionopeus on alhainen seostettujen katalyyttien tapauksessa. Fotokatalyysin parametrit ovat eri tavalla määriteltyjä kvanttisaantoja . Tyypillisiä arvoja ei juuri voida antaa, koska katalyysiin sisältyy suuri joukko parametreja. Yleensä mainitaan suuruusluokkaa 1 reaktio 1000 fotonia kohti. Toinen ongelma on se, että fotokatalyyttiset reaktiot eivät tee eroa orgaanisen sideainematriisin ja epäpuhtauksien välillä. Sopimattomat sideainejärjestelmät pyrkivät siksi liituutumaan aikaisin .
Muut käyttötarkoitukset
Erityisten optisten lasien valmistuksessa TiO 2: ta käytetään vaikuttamaan optiseen dispersioon, Abbe -numeroon . Titaanidioksidi anataasimuunnoksessa on katalyyttien pääkomponentti, jota käytetään savukaasujen teollisessa denitrifikaatiossa SCR -prosessin avulla . Väriaine aurinkokenno ( Grätzel -kenno ) perustuu titaanidioksidin puolijohdeominaisuuksiin . Titaanidioksidin avulla valmistettiin memristoreita . Titaanidioksidia käytetään myös luokan 1 keraamisten kondensaattoreiden keraamisten dielektristen pääkomponenttina . Synteettisiä rutiilin yksikiteitä käytetään optisiin prismoihin tai timanttijäljitelmiin optisten ominaisuuksiensa vuoksi . Jäljitelmät on helppo tunnistaa kaksisuuntaisuuden vuoksi. Lisäksi titaanidioksidia käytetään testiaerosolien valmistukseen .
todiste
Vasta kylmässä saostunut titaanidioksidi on amfoteerinen ja liukenee laimeisiin mineraalihappoihin. Hajotus tapahtuu kaliumvetysulfaatilla posliinisessa upokkaassa. Sitten se liuotetaan kylmään veteen hieman rikkihappoa. Muutamalla tipalla vetyperoksidia muodostuu keltainen (emäksinen) tai kelta-oranssi (hapan, valokuva) [Ti (O 2 ) · aq] 2+ -kationi.
Treffit
Vuonna geofysikaalisia tutkimuksia 115 vuotta vanhaa Wienin raide kaiteet maalattu noin 15 kertaa , jonka Otto Wagner , ensiesiintyminen Rutiilin valkoista käytettiin mennessä maalikerrosten.
Riskit
Titaanidioksidia ei ole luokiteltu vedelle vaaralliseksi .
Vuonna Kesäkuu 2017 kemikaaliviraston riskinarviointikomitea (RAC) arvioi luokitusta ehdotuksen Ranskan viranomaiselle, joka oli ehdottanut luokitusta ja merkintöjä kuin ”luultavasti karsinogeeninen ihmisillä” (Carc 1B), ja tuli siihen tulokseen, että titaanidioksidi epäiltiin karsinogeeninen hengitettynä on luokiteltava (Carc 2). Euroopan komission oli tarkastettava tämä luokitteluehdotus ja pantava se täytäntöön sovellettavassa lainsäädännössä.
Erittäin suuret pitoisuudet nanohiukkasia , eli hiukkasia, joiden alle 100 nm, johtavat immuunireaktioihin keuhkoissa . Immuunireaktiosta keskustellaan mahdollisen tulehdusperäisen syöpäriskin kanssa, ja alle 100 nm: n nanohiukkasmaista TiO 2: ta testataan ja pigmenttistä TiO 2: a, joka on suurempi kuin 200 nm, käytetään esimerkkisovelluksena ja tuotantomääränä.
56 ihmisen ryhmässä, joka valittiin valikoivasti titaanimplantteihin liittyvien ongelmien vuoksi, 21 henkilöllä oli positiivinen reaktio MELISA -testissä (lymfosyyttien muutostesti ) TiO 2: lla , kun taas kaikki 54 ihmistä ryhmässä testasivat laastaritestiä negatiivinen. Pohjois -Carolinan yliopiston tutkimuksessa todettiin, että titaanidioksidin nanohiukkaset olivat myrkyllisiä hiirien mikrogliaalisille aivosoluille.
Testeissä mukaan biologien on yliopiston Koblenz-Landau kanssa daphnialla (vesi kirput), joitakin merkittäviä vaikutuksia havaittiin huolimatta alhainen titaanidioksidia pitoisuudet vedessä: käytetyt konsentraatiot testissä, jopa 2 mg / l, oli jopa tekijä on yli 1000 yli sen, jonka epäillään olevan ympäristön pitoisuus ng / l - muutama µg / l. Ensisijainen vaikutus oli kautta kertyminen hiukkasten kitiininkuoren veden kirppuja kohtalokkain seurauksin testiryhmässä. Myös seuraavan sukupolven daphnia osoitti tutkimuksissa vaurioita toimintamekanismin kautta, jota ei tulkittu ja analysoitu. Jotkut näistä tutkimuksista ovat suoraan ristiriidassa vanhemman tutkimuksen kanssa, jossa pitoisuudet ovat huomattavasti korkeammat, jopa 50 mg / l.
Rotilla INRA antoi 100 vuorokautta oraalisen titaanidioksidin annon jälkeen mm. Suoliston tulehdus havaittu. Kirjoittajien mukaan annos 10 mg / kg vastaa määrää, johon ihmiset voivat altistua käyttämällä elintarvikeväriä E171. Toinen tutkimus osoittaa myös, että E171 voi pahentaa suolen tulehdusta.
Fotokatalyyttisesti aktiivisten titaanidioksidin nanohiukkasten sytotoksisuuden tutkimukset ovat osoittaneet: titaanidioksidista tehdyt nanohiukkaset voivat muodostaa reaktiivisia radikaaleja absorboidessaan UV -säteilyä, jotka kykenevät hajottamaan monia orgaanisia aineita. Tällä kiinteistöllä on lukuisia teollisia sovelluksia, mutta sillä on myös riski haitallisista vaikutuksista eläviin organismeihin.
Luokitus "todennäköisesti syöpää aiheuttava hengitettynä"
| turvallisuusohjeet | ||||||||
|---|---|---|---|---|---|---|---|---|
| Sukunimi |
Jauheen muodossa olevat seokset, joissa on vähintään 1% titaanidioksidia hiukkasmuodossa tai jotka on sisällytetty hiukkasiin, joiden aerodynaaminen halkaisija on ≤ 10 μm |
|||||||
| CAS -numero | ||||||||
| EY -numero |
236-675-5 |
|||||||
| ||||||||
| Toksikologiset tiedot | ||||||||
Vuonna 2012 titaani (IV) sisälsi EU: n meneillään olevan toimintasuunnitelman ( CoRAP ) asetuksen (EY) N: o 1907/2006 (REACH) mukaisesti osana aineen arviointia . Vaikutukset aineen ihmisten terveydelle ja ympäristölle arvioidaan uudelleen ja tarvittaessa seurantatoimet käynnistetään. Titaani (IV) oksidin käytön syyt olivat huolet muista vaaroihin liittyvistä huolenaiheista sekä karsinogeenisten ominaisuuksien epäillyt vaarat ja perimää vaurioittavien ominaisuuksien mahdollinen vaara. Uudelleenarviointi alkoi vuonna 2018 ja sen suoritti Ranska . Kun titaanidioksidi aiheutti tulehdusta eläinkokeissa ja tutkijat epäilivät syöpää aiheuttavia ominaisuuksia, Ranska päätti vuonna 2019 kieltää sen käytön elintarvikkeissa vuodesta 2020.
Mahdollinen terveysriski nähdään pääasiassa pölyjen hengittämisessä; tästä on käyty lukuisia keskusteluja. EU -komissio päätti lokakuussa 2019 luokitella ja merkitä titaanidioksidin jauhemuodossa, jossa on vähintään 1% hiukkasia, joiden aerodynaaminen halkaisija on ≤ 10 μm , oletettavasti syöpää aiheuttavaksi ihmisille (kategoria 2) hengitettynä (H350 i). Ehdotettu titaanidioksidin luokitus hyväksyttiin 18. helmikuuta 2020 osana asetuksessa (EU) N: o 2020/217 14. ATP: tä (mukauttaminen tekniikan kehitykseen), ja se on siksi pantava täytäntöön 1. lokakuuta 2021 mennessä.
Käytä elintarvikelisäaineena
Toukokuussa 2021 Euroopan elintarviketurvallisuusviranomainen (EFSA) luokitteli väriaineen epäterveelliseksi ihmisravinnoksi, koska se ei voinut sulkea pois titaanidioksidin kielteistä vaikutusta ihmisen genomiin . Sveitsissä, jossa elintarvikkeita, jotka sisältävät titaanidioksidia joutunut kantamaan muistion nano on ainesosaluettelossa toukokuusta lähtien 1, 2021 , E 171 on kielletty elintarvikkeiden lisäaineena loppuun 2021, mukaan liittovaltion elintarvikkeiden turvallisuutta ja eläinlääkintätoimisto Toimisto ; jotkut valmistajat jo vapaaehtoisesti luopuvat kiistanalaisesta väriaineesta tietyissä tuotteissa.
Käyttö lääkkeissä
Yli 30 000 lääkettä sisältää titaanidioksidia. Vuonna päivänä toukokuuta 2021 EU komissio ilmoitti, että se pyytää EU lääkeviraston EMA tutkia ja miten titaanidioksidi voidaan korvata lääkkeitä. Federal Institute for Drugs and Medical Devicesin mukaan lähes kolmannes Saksassa hyväksytyistä "kiinteistä oraalisista annosmuodoista" sisältää titaanidioksidia.
nettilinkit
- Zusatzstoffe-online.de: Titaanidioksidi
Yksilöllisiä todisteita
- ↑ Merkintä E 171: Titaanidioksidi Euroopan elintarvikelisäaineiden tietokannassa, saatavana 16. kesäkuuta 2020.
- ↑ Merkintä TITAANIDIOKSIDI vuonna CosIng tietokantaan EU: n komission, pääsee 5. elokuuta 2020 mennessä.
- ↑ b c d e f g h i Merkintä titaani (IV) oksidia on GESTIS aine tietokanta IFA , pääsee 19. joulukuuta, 2019. (JavaScript vaaditaan)
- ↑ a b Titaanidioksidia koskeva merkintä . Julkaisussa: Römpp Online . Georg Thieme Verlag, käytetty 1. kesäkuuta 2014.
- ↑ a b T. Radhakrishnan: Titaanidioksidin optiset ominaisuudet . In: Proceedings of Intian tiedeakatemian - A jakso . nauha 35 , ei. 3 , 1952, s. 117-125 , doi : 10.1007 / BF03172227 .
- ↑ Sveitsin tapaturmavakuutusrahasto (Suva): Raja-arvot-nykyiset MAK- ja BAT-arvot (haku 13463-67-7 tai titaanidioksidi ), saatavana 2. marraskuuta 2015.
- ↑ Univ. Freiburgin luennon käsikirjoituksen kemia, oksidit, osa 4: Ei-stökiometriset binäärioksidit.
- ↑ Yhdysvaltain geologinen tutkimuslaitos USGS TITANIUM MINERAL CONCENTRATES (englanninkielinen PDF; 27 kB).
- ↑ a b EFSA: Titaanidioksidi: E171: tä ei enää pidetä turvallisena, kun sitä käytetään elintarvikelisäaineena. 6. toukokuuta 2021, käytetty 11. toukokuuta 2021 .
- ↑ a b Peter Fritsche: Kiistanalainen valkaisuaine - Sveitsi kieltää myös titaanidioksidin käytön elintarvikkeissa. Sveitsin radio ja televisio (SRF), 11. toukokuuta 2021, käyty 11. toukokuuta 2021 .
- ↑ T. Brock, M. Groteklaes, P. Mischke; Maalitekniikan oppikirja; 2. painos; Vincentzin verkko; Hannover; 2000; ISBN 3-87870-569-7 ; 123.
- ↑ https://www.icis.com/explore/resources/news/2018/07/19/10243097/tio2-players-in-major-asset-shuffle/
- ↑ Chemours: TiO2 -markkinoiden kulutus (s. 9), keskeiset kilpailijat ja teknologia (s. 13) , syyskuu 2015 (tietojen tila 2014)
- ↑ b c Kiderakennetulokset tietokantaan Laskennallisen Materials Science ( Memento of alkuperäisen 11. huhtikuuta, 2011. Internet Archive ) Info: arkisto yhteys on asetettu automaattisesti eikä sitä ole vielä tarkastettu. Tarkista alkuperäinen ja arkistolinkki ohjeiden mukaisesti ja poista tämä ilmoitus. että US Naval Research Laboratory .
- ↑ U. Hålenius, F. Hatert, M. Pasero, SJ Mills: IMA Commission on New Minerals, Nomenclature and Classification (CNMNC). Uutiskirje 35 . Julkaisussa: Mineralogical Magazine . nauha 81 , ei. 1. helmikuuta 2017, s. 209–213 ( main.jp [PDF; 79 kB ; Käytetty 19. elokuuta 2017]).
- ↑ a b LS Dubrovinsky, NA Dubrovinskaia, V Swamy, J Muscat, NM Harrison, R Ahuja, B Holm, B Johansson: Materiaalitiede: Kova tunnetuin oksidi . Julkaisussa: Nature . 410, nro 6829, 2001, s. 653-654. doi : 10.1038 / 35070650 . PMID 11287944 .
- ↑ Oganov AR, Lyakhov AO: Kohti materiaalien kovuusteoriaa . Julkaisussa: J. of Superhard Materials . 32, nro 3, 2010, s.143-147. doi : 10.3103 / S1063457610030019 .
- ↑ Y. Al-Khatatbeh, KKM Lee ja B. Kiefer: TiO 2 : n korkeapaineinen käyttäytyminen kokeen ja teorian perusteella . Julkaisussa: Phys. Rev. B . 79, nro 13, 2009, s. 134114. doi : 10.1103 / PhysRevB.79.134114 .
- ↑ Nishio-Hamane D., Shimizu A., Nakahira R., Niwa K., Sano-Furukawa A., Okada T., Yagi T., Kikegawa T.: Vakaus ja tilanyhtälö varten cotunnite vaihe TiO 2 jopa 70 GPa . Julkaisussa: Phys. Chem. Minerals . 37, nro 3, 2010, s.129-136. doi : 10.1007 / s00269-009-0316-0 .
- ↑ Marchand R., L. Brohan, Tournoux M.: Uudenlainen titaanidioksidi ja kalium octatitanate K 2 Ti 8 O 17 . Julkaisussa: Materials Research Bulletin . 15, nro 8, 1980, s. 1129-1133. doi : 10.1016 / 0025-5408 (80) 90076-8 .
- ↑ M. Latroche, L. Brohan, R. Marchand, M. Tournoux: New hollandite oxides: TiO 2 (H) and K 0,06 TiO 2 . Julkaisussa: Journal of Solid State Chemistry . 81, nro 1, 1989, s. 78-82. doi : 10.1016 / 0022-4596 (89) 90204-1 .
- ↑ J. Akimoto, Y. Gotoh, Y. Oosawa, N. Nonose, T. Kumagai, K. Aoki, H. Takei: Topotactic hapetus Ramsdellite-tyypin Li 0,5 TiO 2 , New polymorfi titaanidioksidin: TiO 2 ( R) . Julkaisussa: Journal of Solid State Chemistry . 113, nro 1, 1994, s. 27-36. doi : 10.1006 / jssc.1994.1337 .
- ↑ PY Simons, F. Dachille: rakenne TiO 2 II, korkean paineen vaihetta TiO 2 . Julkaisussa: Acta Crystallographica . 23, nro 2, 1967, s. 334-336. doi : 10.1107 / S0365110X67002713 .
- ↑ Sato H., Endo S, Sugiyama M, Kikegawa T, Shimomura O, Kusaba K: Baddeleyite-Type High-Pressure Phase of TiO 2 . Julkaisussa: Science . 251, nro 4995, 1991, s. 786-788. doi : 10.1126 / science.251.4995.786 . PMID 17775458 .
- ↑ Dubrovinskaia NA, Dubrovinsky L S., Ahuja R, Prokopenko V B., Dmitriev V., Weber H.-P., Osorio-Guillen JM, Johansson B: Experimental and Theoretical Identification of a New High-Pressure TiO 2 Polymorph . Julkaisussa: Phys. Lett. . 87, nro 27 Pt 1, 2001, s. 275501. doi : 10.1103 / PhysRevLett.87.275501 . PMID 11800890 .
- ↑ Mattesini M, de Almeida JS, Dubrovinsky L., Dubrovinskaia L, Johansson B., Ahuja R.: Korkean paineen ja korkean lämpötilan synteesi kuutiometriä TiO 2 polymorfia . Julkaisussa: Phys. Rev. B . 70, nro 21, 2004, s. 212101. doi : 10.1103 / PhysRevB.70.212101 .
- ↑ a b c Georg Brauer (toim.): Handbook of Preparative Inorganic Chemistry . 3., uusittu. Painos. nauha II . Enke, Stuttgart 1978, ISBN 3-432-87813-3 , s. 1366 .
- ↑ C. Murty, R. Upadhyay, S. Asokan: Eletro sulattaminen Ilmeniitti tuotantoa varten TiO 2 kuona. (PDF; 715 kt).
- ↑ Djeva -yrityksen esite jalostamisesta Verneuil -menetelmällä (saksa, 4,2 MB PDF).
- ↑ Kazuhito Hatta, Mikio Higuchi, Junichi Takahashi, Kohei Kodaira, "Kelluvan vyöhykkeen kasvu ja alumiiniseostettujen rutiilin yksittäisten kiteiden karakterisointi", Journal of Crystal Growth, 163, 1996, s. 279-284; doi: 10.1016 / 0022-0248 (95) 00972-8 .
- ^ H. Machida ja T. Fukuda: "vaikeudet aikana Czochralski kasvu TiO 2 yhden kiteet", Journal of Crystal Growth, 112, 1991, s. 835-837; doi: 10.1016 / 0022-0248 (91) 90142-R .
- ↑ T.Sekiya ja S.Kurita, "Anataasititaanidioksidin viat", Nano- ja mikromateriaalit-Advances in Materials Research, 2008, nide 9, s. 121–141, doi : 10.1007 / 978-3-540-74557- 0_4 .
- ^ Polymeerit, valo ja tiede TiO 2 DuPontista . (1,42 Mt PDF).
- ↑ Erik Shepard Thiele: Sähkömagneettisen säteilyn sirontaa monimutkaisilla mikrorakenteilla resonanssijärjestelmässä . 1998 ( PDF, 3,2 Mt - väitöskirja, Pennsylvanian yliopisto).
- ↑ J.Winkler: Titaanidioksidi. Vincentz Network, Hannover 2003, ISBN 3-87870-738-X , s.55 .
- ↑ Michael Graetzel, Francois P.Rotzinger: Crystal Lattice -rakenteen vaikutus titaanioksidien (IV) johtumiskaistan energiaan . Julkaisussa: Chemical Physics Letters . Voi. 118, nro 5, 1985, s. 474-477.
- ↑ Bora Lee, Choong-ki Lee, Cheol Seong Hwang ja Seungwu Han: Vaihto-korrelaatiofunktionaalien vaikutus rutiili TiO 2 : n dielektrisiin ominaisuuksiin , julkaisussa: Current Applied Physics , Volume 11 (2011), S293-S296. doi: 10.1016 / j.cap.2010.11.104 .
- ↑ Rebecca A. Parker " Rutiilin staattinen dielektrinen vakio (TiO 2 ), 1,6-1060 ° K" , Phys. Rev. 124, 1961, s. 1719-1722.
- ↑ Titaanidioksidi elintarvikkeissa . Titanium Dioxide Manufacturers Association (TDMA), käytetty 11. toukokuuta 2021.
- ↑ Ceresana: Titanium Dioxide Market Study , käytetty 21. toukokuuta 2013.
- ↑ KRONOS Titan: TiO 2 : n käyttöalueet (PDF; 374 kB).
- ↑ Sachtleben: Hombikat UV 100 .
- ↑ Evonik Aerosil, Aeroxid P25 ( Memento 1. heinäkuuta 2012 Internet Archive ).
- ↑ KRONOS Titan: Kronoclean -tietolomake (PDF; 488 kB).
- ↑ Neue Zürcher Zeitung: ”Mukulakivet sumua vastaan” , katsausartikkeli, 16. marraskuuta 2011.
- ↑ Fraunhofer Photocatalysis Alliance: ”Biokäytön tehokkuuden mittaukset” (PDF; 79 kB).
- ↑ Tusnelda E. Doll: " Karbamatsepiinin , klofibristen , iomeprolin ja iopromidin fotokemiallinen ja fotokatalyyttinen hajoaminen ", Väitöskirja, 2004, DNB 1002433525/34 .
- ↑ Martin Lindner: "Valokatalyyttisen veden puhdistuksen optimointi titaanidioksidilla: Valokatalyytin kiinteä ja pintarakenne", väitöskirja, DNB 954460030/34 .
- ↑ Uusiutuvien resurssien datakeskus: Sunlight Spectrum ASTM 1.5 .
- ↑ Thorsten Ebbinghaus: "Ympäristön kannalta merkityksellisten typpiyhdisteiden yhdistetty biologinen-fotokatalyyttinen hajoaminen maatalouden jäteveden puhdistamiseen umpeenkasvaneilla kasvisuodattimilla ja TiO 2 / UV" , TU Dortmund, väitöskirja, 2003 (PDF; 1,5 Mt).
- ↑ Martin Klare: "Mahdollisuudet ympäristön kannalta merkityksellisten typpiyhdisteiden fotokatalyyttiseen hajoamiseen käyttämällä TiO 2: ta " , TU Dortmund, väitöskirja, 2003 (PDF; 3,3 MB).
- ↑ Kevin Bullis: Elektroniikan uudelleenjohdotus . Teknologiakatsaus. 8. toukokuuta 2008, katsottu 25. maaliskuuta 2010.
- ↑ VDI 3491 arkki 3: hiukkasten mittaus 2018-03 ; Testiaerosolien valmistusprosessi; Paalujen ja kiinteiden aineiden hajottaminen (Hiukkasten mittaus; Menetelmät testiaerosolien tuottamiseksi; Kiinteiden aineiden dispergoiminen). Beuth Verlag, Berliini. S.7.
- ↑ VDI 3491 arkki 9: 1989-09 hiukkasten mittaus; Testiaerosolien valmistus harjaannostelijan avulla (hiukkasten mittaus; testiaerosolien tuottaminen pyörivän harjageneraattorin avulla). Beuth Verlag, Berliini. 5.
- ↑ Otto Wagner and the Green of the 50s: Sehgewohnheiten und Reality orf. At, 31. joulukuuta 2017, katsottu 31. joulukuuta 2017.
- ↑ ECHAn lehdistötiedote 9. kesäkuuta 2017
- ↑ nanopartikel.info: Nanocare , esite, sivu 11 ja sitä seuraava (saksa, PDF; 2,7 Mt).
- ↑ Yazdi, AS; Guarda, G.; Riteau, N.; Drexler, SK; Tardivel, A.; Couillin, minä; Tschopp, J. (2010). Nanopartikkelit aktivoivat NLR: n pyriinidomeenin, joka sisältää 3 (Nlrp3) tulehdusta, ja aiheuttavat keuhkotulehduksen vapauttamalla IL-1: n ja IL-1: n . Proceedings of the National Academy of Sciences 107 (45): s. 19449-19454 doi: 10.1073 / pnas.1008155107 , PMC 2984140 (ilmainen koko teksti).
- ↑ Biodenth.be (PDF; 245 kB) K. Müller, E. Valentine-Thon: "Yliherkkyys titaanille: kliiniset ja laboratoriotodisteet" ( Muistio 9. marraskuuta 2013 Internet-arkistossa ) Neuroendocrinology Letters, Vuosikerta 27, tarvikkeet 1, 2006, s. 31--35.
- ↑ TC Long, N.Saleh, RD Tilton, GV Lowry, B.Veronesi: Titaanidioksidi (P25) tuottaa reaktiivisia happilajeja kuolemattomissa aivojen mikroglioissa (BV2): vaikutuksia nanohiukkasten neurotoksisuuteen. Julkaisussa: Environmental Science & Technology . Osa 40, numero 14, heinäkuu 2006, s.4346-4352. PMID 16903269 .
- ↑ Mirco Bundschuh, Frank Seitz, Ricki R.Rosenfeldt, Ralf Schulz, Elena A.Rozhkova: Titaanidioksidin nanohiukkaset lisäävät herkkyyttä vesikirppu Daphnia magnan seuraavan sukupolven aikana. Julkaisussa: PLoS ONE. 7, 2012, s.E48956, doi: 10.1371 / journal.pone.0048956 .
- ↑ Volker Mrasek : deutschlandfunk.de: Vaikutus jopa sukupolvien välillä (22. maaliskuuta 2014).
- ↑ Nadja Podbregar: Sukupolvien väliset seuraukset: pienten äyriäisten nanosaastuminen tekee heidän jälkeläisistään liian herkkiä. Julkaisussa: scinexx.de. 8. maaliskuuta 2013, käytetty 20. elokuuta 2019 .
- ↑ Kerstin Hund-Rinke, Markus Simon: Fotokatalyyttisten aktiivisten nanohiukkasten (TiO2) ekotoksinen vaikutus levä- ja vesikirpuun Ympäristötiede ja saastutustutkimus kansainvälinen: ESPR 13 (2006), No. 4, s. 225-232 , doi: 10.1065 / espr2006.06.311 .
- ↑ Bettini, S. et ai.: Elintarvikelaatuinen TiO2 heikentää suoliston ja systeemisen immuunijärjestelmän homeostaasia, käynnistää preneoplastisia vaurioita ja edistää poikkeavaa kryptan kehittymistä rotan paksusuolessa. Tieteelliset raportit 7, artikkelinumero: 40373 (2017), doi: 10.1038 / srep40373 .
- ↑ Titaanidioksidin nanohiukkaset voivat lisätä suoliston tulehdusta
- ↑ doi: 10.1136 / gutjnl-2015-310297
- ↑ C. Kasper, J. Z. Bloh, S. Wagner, D. W. Bahnemann, T. Scheper: Tutkimukset fotokatalyyttisesti aktiivisten titaanidioksidin nanohiukkasten sytotoksisuudesta. Julkaisussa: Chemical Engineer Technology. 82, 2010, s. 335, doi: 10.1002 / cite.200900057 .
- ↑ b Merkintä titaani (IV) oksidi jauheen muodossa, jossa on vähintään 1% hiukkasia, joiden aerodynaaminen halkaisija on ≤ 10 um on GESTIS aine tietokanta IFA , pääsee 19. joulukuuta, 2019. (JavaScript vaaditaan)
- ↑ Merkintä titaanidioksidi on luokitusten ja merkintöjen luetteloon on Euroopan kemikaaliviraston (ECHA), pääsee 7. tammikuuta 2021. Valmistajien ja jälleenmyyjien voi laajentaa yhdenmukaistettuun luokitukseen ja merkintöihin .
- ↑ Euroopan kemikaaliviraston (ECHA) yhteisön jatkuva toimintasuunnitelma ( CoRAP ) : Titaanidioksidi , saatavilla 26. maaliskuuta 2019.
- ↑ Ranska kieltää kiistanalaisen valkaisuaineen, titaanidioksidin . Spiegel Online, 17. huhtikuuta 2019.
- ↑ Asetus (EU) 2020/217
- ↑ Titaanidioksidi: Tutkimusta tarvitaan edelleen . Liittovaltion riskinarviointiministeriö, 29. heinäkuuta 2020.
- ↑ Elintarviketurvallisuus: EU: n komissio ehdottaa titaanidioksidin hyväksynnän kieltämistä. In: aika verkossa . 6. toukokuuta 2021, käytetty 11. toukokuuta 2021 .
- ↑ Titaanidioksidi / titaanidioksidi / CI 77891 | todennäköinen kielto. Julkaisussa: scriptorium. Haettu 24. toukokuuta 2021 (saksa).
- ↑ Kielletään terveydelle vaaralliset nanohiukkaset elintarvikelisäaineina. Julkaisussa: parlament.ch . 2019, käytetty 28. tammikuuta 2021 .
- ↑ Peter Fritsche: Kiistanalainen väriaine - titaanidioksidi katoaa yhä useammista tuotteista. Sveitsin radio ja televisio (SRF), 26. huhtikuuta 2021, käytetty 26. huhtikuuta 2021 .
- ↑ Jost Maurin / taz.de 30. toukokuuta 2021: Turvallinen väriaine tableteissa










