Kinoliini
| Rakennekaava | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Kenraali | ||||||||||||||||
| Sukunimi | Kinoliini | |||||||||||||||
| muut nimet |
|
|||||||||||||||
| Molekyylikaava | C 9 H 7 N | |||||||||||||||
| Lyhyt kuvaus |
väritön kellertävään, voimakkaasti taitekerroin, hygroskooppinen neste, väritön, vetistyvä prismoja hydrokloridina hydraatti |
|||||||||||||||
| Ulkoiset tunnisteet / tietokannat | ||||||||||||||||
| ||||||||||||||||
| ominaisuudet | ||||||||||||||||
| Moolimassa | 129,16 g · mol -1 | |||||||||||||||
| Fyysinen tila |
nestemäinen |
|||||||||||||||
| tiheys |
1,10 g cm −3 (20 ° C) |
|||||||||||||||
| Sulamispiste |
|
|||||||||||||||
| kiehumispiste |
237,2 ° C |
|||||||||||||||
| Höyrynpaine |
8 Pa (20 ° C) |
|||||||||||||||
| p K S -arvo |
4,94 (konjugaattihappo) |
|||||||||||||||
| liukoisuus |
|
|||||||||||||||
| Dipolihetki |
2,29 D |
|||||||||||||||
| Taitekerroin |
1,6262 (21 ° C) |
|||||||||||||||
| turvallisuusohjeet | ||||||||||||||||
| ||||||||||||||||
| Toksikologiset tiedot | ||||||||||||||||
| Termodynaamiset ominaisuudet | ||||||||||||||||
| ΔH f 0 |
141,22 kJ mol −1 |
|||||||||||||||
| Mahdollisuuksien mukaan ja tapana käytetään SI-yksiköitä . Ellei toisin mainita, annetut tiedot koskevat vakio-olosuhteita . Taitekerroin: Na-D-linja , 20 ° C | ||||||||||||||||
Kinoliini , joka tunnetaan myös nimellä atsanaftaleeni tai bentso [ b ] pyridiini , on orgaaninen yhdiste heteroaromaattisten yhdisteiden ryhmästä ja kuuluu kaksitukaisiin heterosyklisiin emojärjestelmiin. Se koostuu kahdesta fuusioitunut aromaattisen kuusi-jäsenisiä renkaita - yksi bentseeni - ja yksi pyridiinirengas, - josta empiirinen kaava C 9 H 7 N tuloksia. Muodollisesti se on naftaleenimolekyyli , jossa renkaan rakenteen hiiliatomi on korvattu typpiatomilla . Kinoliini on väritön, vettä sitova neste, jolla on epämiellyttävä, pistävä haju. Hetinoaromaattisena kinoliinilla on pienempi reaktiivisuus kuin naftaleenilla elektrofiilisen aromaattisen substituution suhteen , mutta vertailuun on helpompaa päästä nukleofiilisiin aromaattisiin substituutioihin .
Kinoliinia löytyy kivihiilitervasta ja se voidaan poistaa hiilestä . Kinoliinista on lukuisia luonnollisia johdannaisia , joita esiintyy usein alkaloideina kasveissa (katso kinoliinialkaloidit ). Kiinan alkaloidit kuuluvat tähän ryhmään, ja kiniini on tunnetuin edustaja. Kinoliini eristettiin ensin puhtaassa muodossa kivihiilitervasta Friedlieb Ferdinand Rungen toimesta vuonna 1834 . Vuonna 1842 se saatiin Charles Frédéric Gerhardtilta hajottamalla alkaloidi kinoniini , josta nimi kinoliini on peräisin.
Kinoliini on tärkeä raaka-aine kemian- ja lääketeollisuudessa . Sitä käytetään lääkkeiden , rikkakasvien ja fungisidien valmistuksessa ja emäksisenä liuottimena . Vaikka kinoliinille tunnetaan useita synteettisiä lähestymistapoja, taloudellisista syistä suuri osa kinoliinin maailmanlaajuisesta kysynnästä on silti katettu kivihiilitervaeristyksellä.
historia
Puhtaan kinoliinin eristäminen saavutettiin ensimmäisen kerran Friedlieb Ferdinand Rungen toimesta vuonna 1834. Hän otti sen kivihiilitervasta ja antoi nimeksi yhdiste leukoliini . Kinoliini oli vuonna 1842 toisen kerran Charles Frederic Gerhardt havaitsi , että kiniinin ja kinoniinin hajoamistuotteet alkalien vaikutuksesta analysoitiin ja oletettavasti molemmissa tapauksissa sama, tieto tähän mennessä tuntemattomasta kemiallisesta yhdisteestä .
”Seuraava tosiasia ei ole mielenkiintoista. Kiniini muutetaan kaustisen potaskan vaikutuksesta uudeksi typpipitoiseksi emäkseksi, joka on öljyinen normaalissa lämpötilassa. Tämä uusi yhdiste, jota kutsun kinoliiniksi ... "
Nimeäminen perustui yhdisteisiin kiniini ja kinoniini , joista hän oli saanut kinoliinia. Vuonna 1843 Gerhardt kutsui yhdistettä kinoleiiniksi , myöhemmin käytettiin kinoliinia (vertaa myös englantilaista kinoliinia ). Gerhardt kuitenkin erehtyi olettaen, että kinoliini esiintyy sekä kiniinin että kinoniinin hajoamistuotteena, koska, kuten myöhemmin osoitettiin, metoksyloitu kinoliinijohdannainen johtuu kiniinin hajoamisesta, kun taas vain kinokiniinin hajoaminen tuottaa substituoimattoman kinoliinin. Molekyylitason rakenteet Runge n leucoline ja Gerhardtille kinoliinia olivat vielä tuntemattomia aikaan havaitsemisesta. Vasta vuonna 1882 Hoogewerff ja van Dorp selvittivät näiden kahden yhteyden identiteetin .
«Näyttelydekritit dans le précédentes semplent démontret qu'il ya dans le goudron de houille une leucoline identique à la quinoléine obtenue de la cinchonine. »
"Edellisillä sivuilla kuvatut testitulokset näyttävät osoittavan, että kivihiilitervassa on leukoliinia, joka on identtinen kinoniinista saadun kinoliinin kanssa."
Tästä lähtien nimi kinoliini alkoi saada hyväksyntää.
Kinoliinin molekyylirakenne selvennettiin vuonna 1879. Aikaisemmin oletettiin, että kinoliini oli naftaleeni, jossa yksi renkaan hiiliatomi oli korvattu typellä . Koska naftaleeni voitaisiin valmistaa muutama vuosi aikaisemmin 4-fenyyli-1-buteenin syklisoinnilla , tämä hypoteesi voidaan vahvistaa N- alkaanialaniliinin analogisella syklisaatiolla kinoliiniksi. Koenigs onnistui tekemään tämä vuonna 1880 lyijy (II) oksidilla , mikä mahdollisti kinoliinin oletetun rakenteen naftaleenianalogina.
Seuraavien vuosikymmenien aikana yhdisteen kemialliset ja fysikaaliset ominaisuudet selvitettiin lukuisissa tutkimuksissa ja määritettiin erilaisia synteettisiä reittejä kinoliinille ja sen johdannaisille.
Tapahtuma
Kinoliini ei ole luonteeltaan käytännöllisesti katsoen vapaa, mutta se muodostaa lukuisien luonnollisten aineiden perusrakenteen, josta se voidaan vapauttaa hajoamisreaktioiden kautta. Tähän sisältyy kiinan alkaloidien ryhmä, joita esiintyy suurina pitoisuuksina cinchona-puissa . Noin 0,3% kinoliini havaitaan - yhdessä monien muiden heterosykliset yhdisteet - in kivihiiliterva , sivutuote on koksin uuttamalla hiilestä . Kinoliini on analyyttisesti havaittavissa tupakansavusta.
nimikkeistö
Kinoliinin lisäksi käytetään ajoittain nimiä bentsopyridiini ja 1-atsanaftaleeni . Bentsopyridiini kuvaa molekyyliä pyridiininä, jossa on fuusioitunut bentseenirengas, ja se on epäselvä ilman muita määritteitä, koska tämä nimitys koskee myös isomeeristä isokinoliinia ; Bentso [ b ] pyridiini on oikea ja yksiselitteinen . 1-atsanaftaleeni kuvaa kinoliinia naftaleenin johdannaisena, jossa hiiliatomi (tai pikemminkin metiiniryhmä) 1-asemassa on korvattu typpiatomilla. Päinvastoin kuin bentsopyridiinillä , tämä nimitys on selkeä.
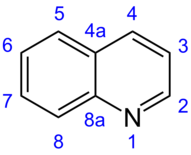
Rengasatomien numerointi noudattaa polynukleaaristen aromaattisten järjestelmien yleistä sääntöä. Tässä tapauksessa laskenta aloitetaan korkeimman asteen varsijärjestelmällä, joka tässä tapauksessa on pyridiinirengas. Heteroatomina typpiatomille annetaan korkein prioriteetti ja siten pienin mahdollinen määrä. Kinoliinin tapauksessa typpiatomilla on numero 1 ja pyridiinirenkaan hiilirengasatomit on numeroitu peräkkäin 2–4 sieltä. Laskemista jatketaan jatkuvasti bentseenirenkaassa, jolloin silloitettavat atomit ohitetaan. Nämä annetaan nimitykset 4 ja 8 mukaan yleisen numerointisuunnitelman kondensoituneelle rengasjärjestelmiä .
Systemaattinen nimi kinoliini jäännös on kinolyyli , kannan kanssa linkin edessä se lukuna. Analogisesti pyridiinitähteen kanssa ( pyridyyli systemaattisen pyridinyylin sijasta ), systemaattista nimeä kinolinyyli käytetään harvoin. Kinoliinin sulautuva komponentti emojärjestelmänä kondensoituneissa polysyklisissä aromaattisissa järjestelmissä on chino .
Uuttaminen ja esittely
Kinoliini, kuten joukko muita heterosyklisiä typpiemäksiä (esimerkiksi pyridiini ja pyrroli ), voidaan saada kivihiilitervasta, jossa se on 0,3%. Toisin kuin pyridiini, jonka maailmanlaajuinen kysyntä tyydytetään nyt suurelta osin synteettisillä prosesseilla, kinoliini saadaan edelleen suurelta osin kivihiilitervasta. Mukaan jakotislaus , se menee yhdessä isokinoliini ja kinaldiini että metyylinaftaleenifraktio yläpuolella, josta se rikkihapon kanssa metyylinaftaleeni ja isokinoliini uutettiin on. Metyylinaftaleenifraktiosta jälkeen erotetaan saostamalla kanssa ammoniakkia . Isokinoliinin 6 ° C korkeamman kiehumispisteen vuoksi jäljellä oleva kinoliinin ja isokinoliinin seos voidaan erottaa puhdistamalla . Kinoliinin jatkopuhdistukselle on olemassa useita vaihtoehtoja, kuten epäpuhtauksien hartsiminen formaldehydillä , käsittely alkalilla, selektiivinen hapetus ja hydraattien muodostus (isokinoliini ei muodosta hydraatteja). Lisäksi, kinoliini voidaan saada myös suoraan metyylinaftaleenifraktio mukaan atseotrooppisella oikaista kanssa etyleeniglykoli tai dietyleeniglykoli ja sitten puhdistettiin tislaamalla.
Skraup-synteesi
Koenigin ensimmäisen kinoliinin vuodelta 1879 mukaan skraup-reaktio, jonka Zdenko Hans Skraup julkaisi ensimmäisen kerran vuonna 1880, oli synteettinen pääsy kinoliiniin. Se perustuu aniliiniin , joka glyserolin , rikkihapon ja hapettimen läsnä ollessa kinoliini on toteutettu. Glyseriini dehydratoidaan ensin akroleiiniksi , jota tarvitaan a, p-tyydyttymättömänä karbonyyliyhdisteenä syklisointiin. Akroleiinin suora käyttö puolestaan vähentää saantoa, koska sillä on taipumus polymeroitua reaktio-olosuhteissa . Skraup-synteesissä saadaan aluksi dihydrokinoliini, joka voidaan hapettaa kinoliiniksi miedoilla hapettimilla, kuten kolmiarvoisilla rautasuoloilla , nitrobentseenillä tai jodilla . Skraup-synteesi on yksi harvoista suorista synteettisistä reiteistä substituoimattomaan kinoliiniin.
Doebner-Miller reaktio on muunnos Skraupin synteesin ja sitä käyttää α, β-tyydyttymättömät aldehydit , jolloin kinoliineja substituoitu 2-asemassa, voidaan valmistaa.
Friedländerin kinoliinisynteesi
Friedländer kinoliini synteesi perustuu o- aminobentsaldehydi , joka on syklisoidaan kanssa enolisoituvan karbonyyliyhdisteiden saatiin johdannaisia kinoliinin. Reaktiota katalysoivat trifluorietikkahappo , tolueenisulfonihappo , jodi ja erilaiset Lewis-hapot .

Niemantowski synteesi on muunnelma Friedländer kinoliinin synteesi, joka alkaa antraniilihaposta sijasta o- aminobentsaldehydit .
Muita synteesireittejä
Tunnetaan useita muita synteettisiä reittejä kinoliiniin tai sen johdannaisiin. Conrad-Limpach synteesi (mukaan Max Conrad , Leonhard Limpach ), jossa aniliinit ja β-ketoestereistä käytetään, ja Povarov reaktio , jonka aniliini, bentsaldehydi ja aktivoitu alkeenit ovat tarpeen, on mainittu nimeltä. Käytetään myös Campsin kinoliinisynteesiä , Knorr-kinoliinisynteesiä ja Gould-Jacobs-reaktiota .
Jotkut kinoliinialkaloidit esiintyvät luonnollisina aineina biologisissa järjestelmissä. Kinoliinin tarkka biosynteettinen rakenne riippuu biologisesta järjestelmästä ja kinoliinijohdannaisen tarkasta rakenteesta. Biokemiallinen yhteys Joidenkin kinoliinijohdannaisia on aminohappo tryptofaani , josta kinoliini rakenne voidaan muodostaa usean vaiheen reaktiossa. Kautta edelleen synteettinen reitti alkaen antraniili- ovat hydroksyloidut Chinolingerüste saatavilla. Synteesin jatkuminen johtaa akridiinijohdannaisiin .
ominaisuudet
Fyysiset ominaisuudet
Kinoliini on väritöntä ja nestemäistä vakio- olosuhteissa. Se kiehuu 237,2 ° C: ssa ja jäätyy -14,8 ° C: ssa. Mukaan on Antoine, höyrynpaine toiminnon tulokset log 10 (P) = A- (B / (T + C)) (P bar, T K), A = 3,94043, B = 1667,104 ja C = -87,085 vuonna lämpötila-alue 437,8 - 511,1 K. Se on erittäin valoa taittava neste, jonka taitekerroin on 1,6262 21 ° C: ssa ja aallonpituus 589 nm . Vakio-olosuhteissa kinoliinin tiheys on 1,10 g · cm −3, mikä on verrattavissa veden tiheyteen . Kinoliini on diamagneettinen ( molaarinen diamagneettinen herkkyys on -86,1 x 10-6 cc · mol -1 ) ja sen dipolimomentti on 2,29 D -. Kriittinen lämpötila on 527 ° C: ssa, kriittinen paine 57,8 bar. nestefaasissa muodostumisen standardientalpia on 141,22 kJ · mol -1 , kun taas kaasufaasissa se on 200,5 kJ · mol -1 . Kinoliinin viskositeetti on 25 ° C: ssa 3,337 mPa · s −1 ja lämmönjohtavuus 0,147 W · (m · K) -1 .
Koska kiinteä aine , yhdiste esiintyy kahdessa polymorfisessa kidemuodoissa. Muunnos kidemuodosta II kidemuodoksi I tapahtuu -53 ° C: ssa. Kidemuoto II kiteytyy monokliinisen kiderakenteen järjestelmä on tilaa ryhmän P 2 1 / c (space ryhmä ei. 14) kanssa hilaparametrien = 992 pm , b = 1085 pm, c = 1337 pm ja määritetään 150 K ( -123 ° C) β = 106,5 °, ja kahdeksan kaavan yksikköä kohti yksikköä solu . Yksittäiset molekyylit on järjestetty kahteen ortogonaaliseen ketjuun, joita pitävät yhdessä heikot CHN- vetysidokset . Ketjujen välillä on vuorovaikutusta C-H- sidosten ja aromaattisen π-järjestelmän välillä.
Kinoliini liukenee vain vähän veteen. Vain 6 g / l liukenee 20 ° C: ssa. Sen huomattavasti huonompi liukoisuus verrattuna pyridiiniin, joka sekoittuu helposti veteen , johtuu ei-polaarisesta bentseenirenkaasta. Sitä vastoin kinoliini sekoittuu vapaasti etanoliin , dietyylieetteriin , asetoniin , bentseeniin ja hiilidisulfidiin .
Kemialliset ominaisuudet
Kinoliini on heikosti emäksinen reaktio, ja kun läsnä on kloorivetyhappoa, muodostaa kiteisen hydrokloridin (C 9 H 7 N HCI), joka sulaa 134 ° C: ssa
Kinoliini kuuluu heteroaromaattisten yhdisteiden ryhmään, joiden ominaisuudet heijastuvat sen reaktiivisuudessa. Hiilianaloginaftaleeniin verrattuna se on vähemmän reaktiivinen elektrofiilisten substituutioiden suhteen , mikä johtuu typpiatomin elektroneja vetävistä ominaisuuksista, jotka toisaalta vähentävät elektronitiheyttä aromaattisessa järjestelmässä ja toisaalta voivat reagoida hyökkäävien elektrofiilien kanssa muodostaen kinoliniumyhdisteitä, jotka ovat vieläkin elektronihuonoempia. Vastakohtana naftaleenille, kinoliinilla on kuitenkin suhteellisen korkea reaktiivisuus nukleofiilisten substituutioiden suhteen . Typpiatomi on sp 2 -hybridisoitunut ja on tyypillinen perusominaisuudet olevan amiinin . Elektrofiiliset aromaattiset substituutiot tapahtuvat yleensä bentseenirenkaassa, kun taas nukleofiiliset aromaattiset substituutiot pyrkivät pyridiinirenkaaseen.
Kuten pyridiinillä, reaktio monet Lewis-happoihin johtaa ja lisäksi typpiatomiin.
Molekyyliominaisuudet
Kinoliini on täysin konjugoitu järjestelmä kymmenen π elektroneja , jotka ovat delokalisoituneina koko rengasjärjestelmä . Heteroaromaattisella molekyylillä on tasomainen rakenne, mutta elektronitiheys ei ole jakautunut tasaisesti, mikä johtuu typpiatomin negatiivisesta induktiivisesta vaikutuksesta . Tästä syystä kinoliinilla, kuten pyridiinillä, on dipolimomentti.
Joukkovelkakirjojen molekyylin ovat eri pituisia . Ligandina nikkelikompleksissa ne ovat välillä 133 - 145 pm ja, kuten aromaattisille systeemeille on tavallista, ne ovat arvojen välillä, jotka tyypillisesti odotetaan yhdistyneille ja kaksinkertaisesti sitoutuneille atomille. Vertailun vuoksi naftaleenin C-C-sidospituudet ovat välillä 135 - 142 pm, mikä viittaa tasaisempaan elektronijakaumaan tässä molekyylissä.
Vuonna kinoliini-molekyylin, kaikki rengasatomit ovat sp 2 - hybridisoidaan . Typpiatomi tarjoaa p-kiertoradan elektronin aromaattisen järjestelmän muodostumiselle, sen vapaa sp 2 -elektronipari sijaitsee molekyylitasossa ja osoittaa poispäin renkaan keskipisteestä. Asemastaan johtuen se ei voi olla vuorovaikutuksessa π-järjestelmän kanssa eikä siten edistä aromaattisuuden kehittymistä. Se on kuitenkin tärkeä kinoliinin kemiallisille ominaisuuksille, koska päinvastoin kuin naftaleeni, aromaattinen järjestelmä ei neutraloidu lisäämällä tähän kohtaan elektrofiilia . Yksinäisen elektroniparin erottaminen aromaattisesta järjestelmästä tarkoittaa kuitenkin myös sitä, että typpiatomi ei voi kehittää positiivista mesomeeristä vaikutusta . Kinoliinimolekyylissä olevan pyridiinirenkaan reaktiivisuus määräytyy suurelta osin typpiatomin negatiivisen induktiivisen vaikutuksen avulla. Sen vaikutus on kuitenkin vähemmän bentseenirenkaassa.
Kinoliini stabiloituu resonanssilla seitsemän mesomeerisen rajarakenteen kautta. Samoin kuin naftaleeni, on olemassa kaksi rajarakennetta, joilla ei ole kahtaisionista luonnetta. Lisäksi voidaan kuitenkin muotoilla viisi muuta kaksoisartikkelirajarakennetta, jotka osoittavat typpiatomille negatiivisen varauksen , jolloin positiivinen varaus jakautuu aromaattiseen järjestelmään. Varauksen sijainti typpiatomissa on yhdenmukainen sen korkeamman elektronegatiivisuuden kanssa hiileen nähden.
Reaktiot
Elektrofiiliset substituutiot
Pyridiiniin verrattuna kinoliini reagoi helpommin elektrofiilisen aromaattisen substituution merkityksessä. Tämä tosiasia johtuu aromaattisen järjestelmän suuremmasta keskimääräisestä elektronitiheydestä, jonka aiheuttaa yhdisteen suhteellisen elektronirikas bentseenirengas. Bentseenirenkaan suuremman elektronitiheyden vuoksi tässä tapahtuu ensisijaisesti elektrofiilisiä substituutioita. Usein Brønstedin tai Lewisin happoja on läsnä myös reaktioseoksessa elektrofiilisiä korvauksia varten . Nämä voivat lisätä pyridiinirenkaan typpiatomiin ja aiheuttaa siten vielä voimakkaamman pyridiinirenkaan deaktivaation. Kuvattuista sähköisistä syistä elektrofiiliset substituutiot tapahtuvat nopeimmin kinoliinin 5- ja 8-asemissa. Seosta, jossa oli yhtä suuret osat 5- ja 8-nitrokinoliini on saatu kuten nitraus tuote , kun taas muut isomeerit muodostettu vain vähäisessä määrin. Kinoliinin nitrauksella on tässä heikompi selektiivisyys kuin isokinoliinilla, jossa muodostuu melkein yksinomaan 5-nitroisokinoliini .
Mukaan sulfonoimalla kanssa oleum , in-8 asema on substituoitu kinoliini johdannainen päätuote, ja edelleen, 5-Chinolylderivat saatiin kohtalaisessa lämpötilassa. Koska elektrofiilinen substituutio tapahtuu nopeimmin näissä paikoissa, nämä ovat kineettisiä reaktiotuotteita. Kun tuote seos kuumennetaan yli 250 ° C: ssa, isomerointi on termodynaamisesti edullisempi kinoliini-6-sulfonihappo tapahtuu.
Koostumus tuotteen spektrin saatu mukaan halogenoimalla kinoliini- molekyylikaavan halogeeneilla on vahvasti sovelletaan reaktio-olosuhteissa. Rikkihapon bromaus johtaa kuitenkin yleensä siihen, että kinolijohdannaiset korvataan reaktion päätuotteina 5- ja 8-asemissa. Kinoliinihydrobromidia käyttämällä substituutio pyridiinirenkaassa on myös mahdollista lievissä reaktio-olosuhteissa, jotka tapahtuvat 3-asemassa.
Nukleofiiliset substituutiot
Monet pyridiinikemiasta tunnetut nukleofiiliset substituutiot tapahtuvat myös kinoliinilla, edullisesti pyridiinirenkaan elektroniheikossa 2-asemassa. Tämä sisältää aminointi , jonka Chichibabin reaktio , jossa amidi-ionin edullisesti lisää 2-asemaan kinoliini käyttämällä kaliumamidi kuin nukleofiilinä nestemäisessä ammoniakkia -66 ° C: ssa Seuraava hapetus kaliumpermanganaatilla voi vapauttaa 2-aminokinoliinia . Kun reaktiolämpötila nostetaan -40 ° C: seen, tapahtuu isomerointi termodynaamisesti vakaammaksi 4-substituoiduksi tuotteeksi.
Kinoliini voidaan usein alkyloida tai aryloida käyttämällä alla olevia litiumorganyylejä . Reaktion vesipitoisen käsittelyn jälkeen välituotteena muodostunut dihydrokinoliinijohdannainen voidaan lämpöstromatoida uudelleen . Jos on hyviä lähteviä ryhmiä , tiedetään joukko kinoliinin ipso- substituutioita , analogisia pyridiinin kanssa . 3-asemassa olevilla substituutioilla on yleensä vastaavien halogeeniaromaattisten yhdisteiden ipso- substituutioiden ominaisuuksia , kun taas 2- ja 4-asemissa olevat ovat samanlaisia kuin pyridiinillä.
Litioidut kinoliinit voidaan valmistaa halogeenijohdannaisista, joihin ne perustuvat, sekä pyridiinillä että bentseenirenkaalla, käyttämällä kaupallisesti saatavia litiumorganyyliä, kuten n- butyylilitiumia . Tämä reaktio kilpailee edellä kuvatun alkyloinnin kanssa, joka voidaan kuitenkin pitkälti tukahduttaa suorittamalla reaktio matalissa lämpötiloissa. Saadut litioidut kinoliinijohdannaiset voidaan joko käyttää suoraan nukleofiileinä tai aiemmin transmetalisoida toiseksi metalli-ioniksi .
Hapetus ja pelkistys
Kinoliini muodostaa analogisesti pyridiini- N- oksidin kanssa myös N- oksidin, jota voidaan tuottaa hapettamalla kinoliinia peroksikarboksyylihapoilla , usein perbentsoehapolla . Sitä vastoin voimakkaasti hapettavissa olosuhteissa tapahtuu bentseeni- tai pyridiinirenkaan hapettava hajoaminen. Kumpi renkaista hajoaa, riippuu reaktio-olosuhteista. Yleensä se vaikuttaa bentseenirenkaaseen, mikä johtaa usein kinoliinihappoon . Kaliumpermanganaatti , mangaanidioksidi tai savuava typpihappo voivat toimia hapettimina . Tehokkain menetelmä on kuitenkin sähkökemiallinen hapetus. Otsonolysoimalla kinoliini saadaan pyridiini-2,3-dialdehydiä , joka voidaan vuorostaan hapettaa kinoliinihappo myöhemmillä hapettamalla vetyperoksidilla .
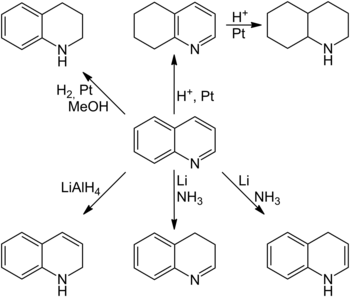
Reaktio-olosuhteista riippuen sekä bentseeni- että pyridiinirengas voidaan hydroida valikoivasti . Klassinen molekulaarisen vedyn sisään metanolissa huoneenlämpötilassa yli platinaa katalyyttinä käytetään hydrata pyridiinirenkaan . Tunnetaan kuitenkin myös hydraus käyttämällä natriumsyanoboorihydridiä ja natriumboorihydridiä ja sinkkiboorihydridiä nikkeli (II) kloridin läsnä ollessa . Selektiivistä hydrausta bentseenirengas on aikaan saattamalla reagoimaan vedyn kanssa vahvat hapot on platina katalysaattori . Täysin tyydyttynyttä dekahydrokinoliinia voidaan myös saada näissä olosuhteissa pitemmällä reaktioajalla . Dihydrogenoituja kinoliinijohdannaisia voidaan myös saada synteettisesti kinoliinista. 1,2-dihydrokinoliini voidaan valmistaa pelkistämällä litiumalumiinihydridillä , kun taas 1,4- ja 3,4-dihydrokinoliini pääsee pelkistämällä alkuaine- litiumia nestemäisessä ammoniakissa. Dihydrogenoidut kinoliinijohdannaiset pyrkivät kuitenkin usein kaksoissidoksen isomerointiin, joten niitä ei toisinaan voida eristää, vaan ne esiintyvät vain reaktion välituotteina.
käyttää
Ullmannin teknisen kemian tietosanakirja asettaa kinoliinin maailman vuotuisen tuotannon 2000 tonniksi vuonna 2005 . Vastaavasti vastaavien heterosyklisten synteesien rakennuspalikoiden kasvavaan kysyntään voidaan kuitenkin olettaa, että tuotantokapasiteettia on tällä välin lisätty. Kinoliinilla on laaja käyttötarkoitus kemianteollisuudessa. Se on tärkeä raaka-aine lääkkeiden sekä rikkakasvien ja fungisidien valmistuksessa . Sitä käytetään myös peruskatalysaattorina esimerkiksi lääketeollisuudessa .
Yksi tärkeimmistä käyttötarkoitukset kinoliinia on valmistuksessa 8-hydroksikinoliinin , joka on kompleksoivan aineen käytetty kuin desinfiointiaineena ja antifungaalisen aineen . Synteesi 8-hydroksikinoliinin saavutetaan sulfonoimalla kinoliini kinoliini-8-sulfonihappo ja sen jälkeen ipso - hydroksylaatio kuumalla natriumhydroksidiliuoksella . Lisäksi kinoliinia käytetään kinoliinihapon tuottamiseen , joka on tärkeä raaka-aine rikkakasvien torjunta-aineiden, kuten imatsapyyrin, tuotannossa . Kinoliini on myös raaka-aineena teollinen synteesimenetelmä nikotiinihapon (vitamiini B 3 ), joka on käytettävissä mukaan dekarboksylointi kinoliinihapon. Klassinen jakautuminen on hapetus käyttämällä vahvoja hapettimia , kuten kaliumpermanganaattia , mutta nykyaikaisissa teollisissa prosesseissa käytetään halvempia hapettimia.

Osittain hydrattuja kinoliinijohdannaisia käytetään myös aktiivisten farmaseuttisten aineosien ja antibioottien tuotannossa . 2-hydroksikinoliini , joka voidaan saada hapettavasti hypokloorihapolla tai entsymaattisella hydroksyloinnilla kinoliinista, on myös raaka-aine esimerkiksi sydänlääkkeiden tai antihistamiinien valmistuksessa, ja se on myös raaka-aine syaanivärien teolliseen synteesiin .
Kemiallisissa laboratorioissa tai kemian teollisuuden laitoksiin, kinoliini voidaan käyttää hyvänä liuottimena ja erittäin hyvä uuttoaineen ja polysyklisiä aromaattisia hiilivetyjä . Joskus tähän tarkoitukseen käytetään seoksia isokinoliinin kanssa. Kinoliinia käytetään myös korroosionestoaineena ja happoa sitovana emäksenä kemiallisissa reaktioissa. Kun palladiumin katalysoima hydraus alkyynien , kinoliini toimii osittain pois päältä ( myrkky ) katalyytti (ns Lindlar-katalyyttiä ). Tällä tavalla deaktivoitu katalyytti mahdollistaa alkyynin yksinkertaisen hydrauksen, jolloin saadaan alla oleva alkeeni, ja estää kaksinkertaisen hydrauksen alkaanin tuottamiseksi . Kinoliinilla deaktivoituja katalyyttejä käytetään myös Rosenmundin pelkistykseen , palladiumkatalysoituun karboksyylihappokloridien pelkistykseen aldehydeiksi.
Vaaravaroitukset
Kinoliini on luokiteltu myrkylliseksi ja ympäristölle vaaralliseksi, ja sitä voidaan käyttää vain voimakkaalla tuuletuksella ja vain sopivilla suojakäsineillä. Aineen pääsy ympäristöön on estettävä. On riittävästi todisteita siitä, että ihmisen altistuminen kinoliinille voi aiheuttaa syöpää . Lisäksi on perusteltu epäily mutageenisesta vaikutuksesta . Kinoliini on luokiteltu luokkaan 2 vaarallinen vedelle .
Kinoliini muodostaa ilman kanssa syttyviä ilma-höyryseoksia leimahduspisteestään 101 ° C. Räjähdys alue on välillä 1% tilavuus (54 g / m) kuin alemman räjähdysrajan (LEL) ja 7 til-% (376 g / m) kuin ylemmän räjähdysrajan (UEL). Syttymislämpötila on 480 ° C Siksi aine kuuluu lämpötilaluokkaan T1. Tulipalon sattuessa typpi- kaasut voivat näkyä hajoamistuotteina. Sähkönjohtavuus on melko alhainen 2,2 · 10 -6 S · m -1 .
toksikologia
Kinoliini on keskimääräinen tappava annos on 270 mg kg -1 jälkeen suun kautta nautittaviksi rotilla , kun taas se on 1400 mg kg -1 jälkeen ihon altistuminen . Rotilla tehdyssä tutkimuksessa melkein kaikki koe-eläimet kuolivat seitsemän tunnin ajan Kinoliinilla kyllästetyn ilman inhalaation jälkeen. Akuutteja altistumisen oireita olivat ataksia ja hanhen kuoppia . Verenvuoto ja turvotus on ruoansulatuskanavan oli löydetty kuolleita koe-eläimillä , jotka voidaan katsoa johtuvan altistumisesta kinoliinia. Kaneilla tehdyissä tutkimuksissa lievä tai kohtalainen turvotus ja punoitus muodostui ihon altistumisen jälkeen, mutta iho uusiutui kokonaan testisarjan päättymisen jälkeen. Lievää tai kohtalaista, mutta myös palautuvaa, silmiä ärsyttävää vaikutusta havaittiin myös.
Jälkeen suun kautta, pitkän aikavälin rotilla ja hiirillä osoittivat karsinogeeninen vaikutus, joka ilmeni muodostumista maksasolukarsinoomat ja angiosarkooma . Sitä vastoin näitä havaintoja ei esiintynyt marsuilla ja hamsterilla . Hiirillä havaittiin lievä karsinogeeninen vaikutus ihoaltistuksen jälkeen. Tutkimuksen mukaan karsinoomien kehittymiseen tarvittavan kinoliinin määrä on 250-300 kertaa suurempi kuin voimakkaan karsinogeenin bentsapyreeni . Karsinogeenisesta vaikutuksesta ei kuitenkaan vastaa itse kinoliini, vaan sen metaboliitti . Kinoliinin ja sen johdannaisten eri hajoamisreitit tunnetaan aerobisissa ja anaerobisissa olosuhteissa. Kumpi polku riippuu kyseisestä organismista. Ensimmäinen hajoamisvaihe koostuu tavallisesti aromaattisen hapetuksesta, joka johtaa esimerkiksi 2-hydroksikinoliiniin aldehydioksidaasilla tai 3-hydroksikinoliiniin sytokromi P450 -proteiineilla . Nisäkkäät erittävät hapettuneet hajoamistuotteet lyhyessä ajassa ruoansulatuskanavan kautta.
Kinoliini ympäristössä
Jälkiä kinoliini havaittiin läheisyydessä alumiini- sulatus kasvien liittyy koksinvalmistus- ja hiili-käsittelylaitoksissa, joka voidaan katsoa johtuvan esiintyminen kinoliinijohdannaisten hiiltä. Kinoliinin jäämiä vapautuu myös kivihiilitervan ja tervaöljyn käsittelyssä. Tervaöljyä käytetään tai on käytetty mädäntymistä estävänä aineena puun kyllästämiseen, esimerkiksi rautateiden ratapölkkyihin tai lennätinpylväisiin, jolloin kinoliini voidaan myös vapauttaa ympäristöön asiaankuuluvan teollisuuden ulkopuolella. Lisäksi kinoliinia voidaan tuottaa hivekaasuna orgaanisten typpiyhdisteiden epätäydellisessä palamisessa.
Kinoliini pestään nopeasti saastuneesta maaperästä vedellä ja bakteerit ja humushapot hajottavat sen . Pääsääntöisesti suotuisat olosuhteet vallitsevat tälle veden lähellä pintaa, kun taas hajoaminen syvässä vedessä tapahtuu vain hitaasti sopivien organismien puutteen ja epäedullisten kemiallisten olosuhteiden vuoksi (muun muassa alhaisen happipitoisuuden vuoksi). Kinoliniinia, joka on läsnä pinnan lähellä tai ilmakehässä, hajoaa myös fotolyysi . Tämä hajoamisreitti riippuu voimakkaasti fotonitiheydestä, pH-arvosta ja lämpötilasta. Olosuhteista riippuen kinoliinin puoliintumisaika fotolyyttisestä hajoamisesta on välillä 21 - 160 päivää. Yhdisteellä on vain vähän bioakkumulaatiopotentiaalia, koska bakteerit, kalat ja nisäkkäät hajottavat kinoliinin nopeasti. Kinoliinin jakautumista koskevat mallilaskelmat osoittivat, että yhdiste kulkeutuu olennaisesti veden läpi. Kuljetus ilmakehän läpi on takapenkillä matalan höyrynpaineen vuoksi.
todiste
UV / Vis-spektrin kinoliini esittää kolme absorptiokaistat . Nämä ovat seurausta π → π * ja n → π * -siirtymistä ja tapahtuvat aallonpituuksilla 226 nm ( ekstinktiokerroin ε = 35500 l (mol cm) −1 ), 270 nm (ε = 3880 l (mol cm)) −1 ) ja 313 nm (e = 2360 l (mol cm) -1 ). Infrapunaspektri kinoliini esittää useita absorptiokaistat. Tyypillisiä vahvoja ja erittäin vahvoja nauhoja esiintyy 3333, 1034, 941, 808, 787, 760 ja 740 cm- 1 . Lisäksi on olemassa kahdeksan muuta läheisesti sijoitettua vahvaa absorptiokaistaa välillä 1629--1319 cm- 1 .
Protoni signaalit liuotinta 1 H- NMR-spektri kinoliini olla poikkeuksetta alueella, joka on ominaista aromaattisia protoneita. Tällä alueella, kuitenkin, suhteessa bentseeniin, ne osoittavat joskus voimakkaita siirtymiä syvempiin kenttiin ja ovat osoitus pienentyneestä elektronitiheydestä näissä vetyatomissa. Spektri näyttää seitsemän signaalia, jotka vastaavat molekyylin seitsemää kemiallisesti erilaista protonia. Koska jokainen signaali edustaa protonia, signaaleilla on samat integraalit . Alimman kentän signaali saadaan protonista 2-asemassa δ (2-H) = 8,8 ppm, jota seuraa protonit 8- (δ (8-H) = 8,1 ppm) ja 4-asemassa (δ) (4-H) = 8,0 ppm). Muut protonisignaalit ovat alueella 7,7 ja 7,3 ppm. Suuremmat protonien kemialliset siirtymät hiilianaloginaftaleeniin johtuvat aromaattisen järjestelmän pienemmästä elektronitiheydestä ja vastaavat suhteellisesti näiden asemien pienempiä elektronitiheyksiä, jotka voidaan johtaa mesomeerisistä rajarakenteista. Hiiliatomien lukumäärää vastaavasti 13C -NMR-spektrissä esiintyy yhdeksän signaalia alueella 122-151 ppm. 13 C-ytimen kemialliset siirtymät käyttäytyvät analogisesti protonisignaalien kanssa. Kaksi alhaisen elektronitiheyden asemaa, jotka sijaitsevat typpiatomin läheisyydessä, osoittavat suurimpia alaspäin suuntautuvia siirtymiä (vastaavasti 151 ja 149 ppm).
kirjallisuus
- T. Eicher, S. Hauptmann: Heterosyklien kemia . 2. painos. Wiley-VCH, Weinheim 2003, ISBN 3-527-30720-6 .
- JA Joule, K.Mills: Heterosyklinen kemia . 3. painos. Blackwell Science, Oxford 2004, ISBN 0-632-05453-0 .
- DT Davies: Perustekstikemia: Aromaattiset heterosyklit . 1. painos. Wiley-VCH, Weinheim 1995, ISBN 3-527-29289-6 .
nettilinkit
Yksittäiset todisteet
- ↑ a b c Kinoliinia koskeva merkintä . Julkaisussa: Römpp Online . Georg Thieme Verlag, luettu 10. marraskuuta 2014.
- Ec a b c d O. Eckstein: Kinoliiniklorohydraatista ja happokloridien vaikutuksesta kinoliiniin . Julkaisussa: Chem. Ber. , 1906, 39, s. 2135 - 2138; doi: 10.1002 / cber.190603902173 .
- B a b c d e f g h David R. Lide (Toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, orgaanisten yhdisteiden fysikaaliset vakiot, s.3--454.
- ↑ b c d e f g h i j Merkintä kinoliini että GESTIS aine tietokanta IFA , pääsee 8. tammikuuta, 2021 mennessä. (JavaScript vaaditaan)
- ↑ a b c d e f g h i j k J. A. Joules, K. Mills: Heterosyklinen kemia . 5. painos. Blackwell Publishing, Chichester 2010, ISBN 978-1-4051-9365-8 , s. 177-199.
- ↑ b c A. D. Buckinghamin, JYH Chau, HC Freeman, RJW Le Fèvre, DAAS Narayana Rao, J. Tardif: dipolimomentit pyridiini, kinoliini, ja isokinoliini niin höyryjä ja liuenneita aineita . Julkaisussa: J. Chem. Soc. , 1956, s. 1405 - 1411; doi: 10.1039 / JR9560001405 .
- B a b W.HF Sasse: Aktivoitujen metallikatalyyttien synteettiset sovellukset. Osa VIII. Toiminnan poistettu kaasut Raney-nikkeli kinoliini ja eräät sen johdannaiset . Julkaisussa: J. Chem. Soc. , 1960, sivut 526 - 533; doi: 10.1039 / JR9600000526 .
- ↑ Merkintä kinoliinia että luokitusten ja merkintöjen luetteloon on Euroopan kemikaaliviraston (ECHA), pääsee 1. helmikuuta 2016. Valmistajien ja jälleenmyyjien voi laajentaa yhdenmukaistettuun luokitukseen ja merkintöihin .
- ↑ b c d esite kinoliini (PDF) päässä Merck , pääsee 5. syyskuuta, 2010.
- ^ A b c W. V. Steele, PO Archer, RD Chirico, WB Collier, IA Hossenlopp, A. Nguyen, NK Smith, BE Gammon: Kinoliinin ja isokinoliinin termodynaamiset ominaisuudet . Julkaisussa: J. Chem. Thermodynamics , 1988, s. 1233-1264; doi: 10.1016 / 0021-9614 (88) 90161-9 .
- B a b c d e f g h i G.Collin, H.Höke: Kinoliini ja isokinoliini . Julkaisussa: Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, Weinheim 2005.
- B a b Ch. Gerhardt : Orgaanisten emästen tutkimukset . Julkaisussa: Annalen der Chemie und Pharmacie , 1942, 42, s. 310-313; doi: 10.1002 / jlac.18420420310 .
- B a b Ch. Gerhardt : Orgaanisten aineiden kemiallisen luokituksen tutkimukset . Julkaisussa: J. Prakt. Chem. , 1843, 28, s. 65 - 100; doi: 10.1002 / prac.18430280112 .
- ↑ Kuukausiraportti: kinoliini . Julkaisussa: Archiv der Pharmazie , 1882, 20, s. 50–73; doi: 10.1002 / ardp.18822200109 .
- B a b Paul Rabe: Pyridiini- ja kinoliinisarjan tutkimukset . Julkaisussa: J. Prakt. Chem. , 1938, 151, s. 65 - 81; doi: 10.1002 / prac.19381510203 .
- ^ W. Königs: Sinkoniinin hapettumistuotteet . Julkaisussa: Chem. Ber. 1879, 12, s. 79 - 101; doi: 10.1002 / cber.18790120130 .
- B a b S.Hoogewerff, WA van Dorp: Sur la quinoléine du goudron de houille et des alcaloïdes du quinquina, et sur leur oxydation au moyen du permanganate de kalium . Julkaisussa: Rec. Trav. Chim. , 1882, 1, s. 1-17; doi: 10.1002 / recl.18820010501 .
- ↑ B. Aronheim: synteesi Naftaleeni . Julkaisussa: Chem. Ber. , 1873, 6, s. 67 - 68; doi: 10.1002 / cber.18730060125 .
- B a b W.Koenigs : Kinoliinin synteesi allylaniliinista . Julkaisussa: Chem. Ber. 1879, 12, s. 453; doi: 10.1002 / cber.187901201128 .
- ↑ M.Hesse: Alkaloidit . 1. painos. Verlag Helvetica Chimica Acta, Zürich 2000, ISBN 3-906390-19-5 , s. 375-378.
- ↑ a b c d Kinoliinin toksikologinen katsaus (PDF; 175 kB) . (PDF) Ympäristönsuojeluvirasto , syyskuu 2001.
- B a b D.Hellwinkel: Orgaanisen kemian systemaattinen nimikkeistö . 4. painos. Springer Verlag, Berliini 1998, ISBN 3-540-63221-2 .
- ↑ A. Gossauer: Biomolekyylien rakenne ja reaktiivisuus , 2006, s. 488, Wiley-VCH Weinheim, ISBN 3-906390-29-2 .
- L G.Lunge : Kivihiilen tislaus ja siihen liittyvien sivutuotteiden käsittely , Friedrich Vieweg ja Son, Braunschweig, 1867.
- ↑ S. Shimizu, N. Watanabe, T. Kataoka, T. Shoji, N. Abe, S. Morishita, H. Ichimura: Pyridiini ja pyridiinijohdannaiset . Julkaisussa: Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, Weinheim 2005.
- ↑ Eurooppalainen patentti: EP 100109, 1983, Rütgerswerke .
- ↑ Japanilainen patentti: JP 86161265, 1986, Sumikin Coke & Chemicals.
- ↑ ZH Skraup: Kinoliinin synteesi . Julkaisussa: Chem. Ber. , 1880, 13, s. 2086 - 2087; doi: 10.1002 / cber.188001302195 .
- ↑ a b c D.T. Davies: Perustekstikemia: Aromaattinen heterosykleeni . 1. painos. Wiley-VCH, Weinheim 1995, ISBN 3-527-29289-6 , sivut 46-52.
- ↑ O. Doebner, W. v. Miller: Tietoja kinoliinille homologisesta emäksestä . Julkaisussa: Chem. Ber. , 1881, 14, s. 2812 - 2817; doi: 10.1002 / cber.188101402258 .
- ^ A b F. W. Bergstrom, heterosykliset typpiyhdisteet. Osa IIA. Heksasykliset yhdisteet: pyridiinit, kinoliinit ja isokinoliinit. Julkaisussa: Chem. Rev. , 1944, 35, s. 77 - 277; doi: 10.1021 / cr60111a001 .
- ↑ A. Shaabani, E. Soleimani, Z. Badri: Triflourietikkahappo tehokkaana katalyyttinä kinoliinin synteesissä . Julkaisussa: Synth. Commun. , 2007, 37, s. 629 - 635; doi: 10.1080 / 00397910601055230 .
- ↑ C.-S. Jia, Z.Zhang, S.-J. Tu, G.-W. Wang: Nopea ja tehokas synteesi poly-substituoitu kinoliinien syöttäjänä p-tolueenisulfonihappoa alle liuotin vapaissa olosuhteissa: vertaileva tutkimus mikroaaltosäteilytyksen verrattuna tavanomaisen lämmitys . Julkaisussa: Org. Biomol. Chem. , 2006, 4, s. 104 - 110; doi: 10.1039 / b513721g .
- ↑ J. Wu, H.-G. Xia, K. Gao: Molekyylijodi: erittäin tehokas katalyytti kinoliinien synteesissä Friedländer-annulaation avulla . Julkaisussa: Org. Biomol. Chem. , 2006, 4, s. 126 - 129; doi: 10.1039 / b514635f .
- ↑ R. Varalan, R. Enugala, SR adapa: Tehokas ja nopea Friedlander synteesi Funktionalisoidut Kinoliinit katalysoi neodyymi (III) nitraatti Heksahydraatti . Julkaisussa: Synthesis , 2006, sivut 3825-3830; doi: 10.1055 / s-2006-950296 .
- ^ RH Manske: Kinoliinien kemia. Julkaisussa: Chem. Rev. , 1942, 30, s. 113-144; doi: 10.1021 / cr60095a006 .
- ↑ VV Kouznetsov, LYV Méndez, LYV Gómez: Viimeaikainen kehitys kinoliinien synteesissä . Julkaisussa: Curr. Org. Chem. , 2005, 9, s. 141 - 161; doi: 10.1002 / leuka.200516245 .
- ↑ RH Reitsema: 4-hydroksikinoliinien kemia. Julkaisussa: Chem. Rev. , 1948, 43, s. 43-68; doi: 10.1021 / cr60134a002 .
- Camp R. Camps: Alfa- ja gamma-oksikinoliinien synteesi . Julkaisussa: Chem. Ber. , 1899, 22, s. 3228-3234; doi: 10.1002 / cber.18990320389 .
- ↑ L. Knorr : Synteettinen kokeiluja asetoetikkaesteri . Julkaisussa: Liebigs Ann. , 1886, 236, s. 69 - 115; doi: 10.1002 / jlac.18862360105 .
- ^ RG Gould, WA Jacobs: Tiettyjen substituoitujen kinoliinien ja 5,6-bentsokinoliinien synteesi . Julkaisussa: J. Am. Chem. Soc. , 1939, 61, s. 2890 - 2895; doi: 10.1021 / ja01265a088 .
- ^ PM Dewick: Lääketieteelliset tuotteet: biosynteettinen lähestymistapa . 1. painos. John Wiley & Sons, New York 2009, ISBN 0-470-74167-8 , s.380-397.
- ↑ S. Malanowski: Höyryn paineet ja kiehumislämpötilat Jotkut kinoliini Bases . Julkaisussa: Bull. Acad. Pole. Sci. Ser. Sci. Chim. , 1961, 9, s. 71-76.
- ↑ David R. Lide (Toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, Fluid Properties, s.6-675.
- ↑ F. Glaser, H. Ruland: Höyrynpainekäyrien tutkimukset ja kriittiset tiedot eräistä teknisesti tärkeistä orgaanisista aineista . Julkaisussa: Chem. Ing. Techn. , 1957, 29, s. 772.
- ↑ David R. Lide (Toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, lämpökemia, sähkökemia ja ratkaisukemia, s.5-38.
- ↑ David R. Lide (Toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, Fluid Properties, s.6-212.
- ↑ David R. Lide (Toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, Fluid Properties, s.6-223.
- ^ JE Davies, AD Bond: kinoliini . Julkaisussa: Acta Cryst. , 2001, E57 , s. 0947-0949; doi: 10.1107 / S1600536801014891 .
- ↑ David R. Lide (Toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, Orgaanisten yhdisteiden fyysiset vakiot, s.
- ↑ J. Buddrus: Fundamentals of orgaanisen kemian . S. 337. 3. painos., De Gruyter Verlag, Berliini 2003, ISBN 3-11-014683-5 .
- ↑ MW Austin, JH Ridd: Heteroaromaattisen nitrauksen kinetiikka ja mekanismi. Osa I. Kinoliinit . Julkaisussa: J. Chem. Soc. , 1963, sivut 4204-4210; doi: 10.1039 / JR9630004204 .
- ^ GE McCasland: 8-kinoliinisulfonihapon valmistus . Julkaisussa: J. Org. Chem. , 1946, 11, s. 277 - 280; doi: 10.1021 / jo01173a010 .
- ↑ JL Butler, M.Gordon: Kinoliinin tunnettujen bromausreaktioiden uudelleentutkimus . Julkaisussa: J. Heterocycl. Chem. , 1975, 12, s. 1015 - 1020; doi: 10.1002 / jhet.5570120539 .
- ↑ TJ Kress, SM Constantino: Selektiiviset bromit nitrobentseenissä. Kätevä 3-bromokinoliinin, 4-bromi-isokinoliinin ja 4-fenyyli-5-bromipyrimidiinin synteesi . Julkaisussa: J. Heterocycl. Chem. , 1973, 10, s. 409 - 410; doi: 10.1002 / jhet.5570100326 .
- ↑ H. van der Plas: Aziinien hapettava amino-dehydraus . Julkaisussa: Adv. Heterocycl. Chem. , 2004, 86, s. 1-40; doi: 10.1016 / S0065-2725 (03) 86001-4 .
- ↑ JA Zoltewicz, LS Helmick, TM Oestreich, RW King, PE Kandetzki: Amidi-ionin lisääminen isokinoliiniin ja kinoliiniin nestemäisessä ammoniakissa. Anionisten σ-kompleksien ydinmagneettinen resonanssispektri . Julkaisussa: J. Org. Chem. , 1973, 38, s. 1947-1949; doi: 10.1021 / jo00950a036 .
- ^ TJ Geissmann, MJ Schlatter, ID Webb, JD Roberts: Joidenkin välituotteiden synteesi käytettäväksi salisyylialdehydi-etyleenidi-imiinikoboltin ("Salcomine") analogien valmistuksessa . Julkaisussa: J. Org. Chem. , 1946, 11, s. 741 - 750; doi: 10.1021 / jo01176a015 .
- ↑ M. Ishikura, T. Mano, I. Oda, M. Terashima: Vaihtoehtoinen synteesi dialkyylipyridyyliboraaneista . Julkaisussa: Heterocycles , 1984, s. 4271-4274; doi: 10.3987 / R-1984-11-2471 .
- ↑ H. Gilman , T. Soddy: Huomautuksia - Jotkut kinoliinin ja 2-fenyylikinoliinin organolitiumyhdisteet . Julkaisussa: J. Org. Chem. , 1958, 23, s. 1584-1585; doi: 10.1021 / jo01104a627 .
- ↑ JB Wommack, TG Barbee Jr., DJ Thoennes, MA McDonald, DE Pearson: Kinoliini- ja isokinoliinikarboksaldehydien synteesi . Julkaisussa: J. Heterocycl. Chem , 1969, 6, s. 243 - 245; doi: 10.1002 / jhet.5570060217 .
- Me J. Meisenheimer : Tietoja pyridiinistä, kinoliinista ja isokinoliini-N-oksidista. Julkaisussa: Ber. Saksan kieli Chem. Ges. , 1926, 59, s. 1848 - 1853; doi: 10.1002 / cber.19260590828 .
- ↑ CF Koelsch, AF Steinhauer: 3-atsafluoranteenin synteesi, nitraus ja hapetus . Julkaisussa: J. Org. Chem. , 1953, 18, s. 1516-1522; doi: 10.1021 / jo50017a010 .
- ↑ a b c J.C.Cochran, WF Little: Joidenkin substituoitujen kinoliinien elektrolyyttinen hapetus kinoliinihappoiksi ja asyloinnit substituoiduilla kinoliinianhydrideillä . Julkaisussa: J. Org. Chem. , 1961, 21, s. 808 - 811; doi: 10.1021 / jo01062a039 .
- ↑ G. Queguiner, P. Pastour: Synthesis dans la série de la pyridine - I - Les diformylpyridines . Julkaisussa: Bull. Soc. Chim. Fr. , 1968, 10, sivut 4117-4121; OCLC 491832299 .
- ↑ C. O'Murchu: otsonolyysi Kinoliinit: Monipuolinen synteesi Polyfunktionaaliset pyridiinejä . Julkaisussa: Synthesis , 1989, 11, s. 880-882; doi: 10.1055 / s-1989-27423 .
- ↑ GR Girard, WE Bondinell, LM Hillegass, KG Holden, RG Pendleton, I. Uzinskas: Tetrahydro-tiadiatsolo-isokinoliinit: fenyylietanoliamiini-N-metyylitransferaasin synteesi ja esto . Julkaisussa: J. Med. Chem. , 1989, 32, s. 1566-1571; doi: 10.1021 / jm00127a027 .
- ↑ A. Nose, T. Kudo: vähentäminen Heterosykliset yhdisteet. II. Vähentäminen Heterosykliset yhdisteet natriumboorihydridi--Transition Metal Salt Systems . Julkaisussa: Chem. Pharm. Bull. , 1984, 32, s. 2421 - 2425; Tiivistelmä .
- ^ BC Ranua, U. Jana, A. Sarkara: Kinoliinien ja niihin liittyvien järjestelmien regioselektiivinen pelkistys sinkkiboorihydridillä valmistetuiksi 1,2,3,4-tetrahydro-johdannaisiksi . Julkaisussa: Synth. Commun. , 1998, 28, s. 485 - 492; doi: 10.1080 / 00397919808005103 .
- ↑ GL Patrick: (±) - [4a a , 4b p , 10b p , 12a a ] -9-halogeeni-2-metyyli-1,2,3,4,4a, 4b, 5,6,10b synteesi 11,12,12a-dodekahydronafto [2,1- f ] isokinoliinit . Julkaisussa: J. Chem. Soc., Perkin Trans. 1 , 1995, s. 1273-1279; doi: 10.1039 / P19950001273 .
- ^ EA Braude, J.Hannah, Sir R.Linstead: Vedynsiirto. Osa XVI. Typpipitoisten heterosyklien dihydridit vedyn luovuttajina . Julkaisussa: J. Chem. Soc. , 1960, sivut 3249-3257; doi: 10.1039 / JR9600003249 .
- ↑ Arthur Birch , PG Lehmann: 1,4-dihydrokinoliini . Julkaisussa: Tetrahedron Lett. , 1974, 15, s. 2395 - 2396; doi: 10.1016 / S0040-4039 (01) 92265-8 .
- ↑ MF Depompei, A.Hlynsky, Diamond Shamrock, USA 4 281 125, 1980.
- ↑ JP Senet, G. Sennvey, G. Wooden, Société Nationale des Poudres et Explosifs, EP 249 556, 1987.
- ↑ NN Woroshtzow, JM Kogan: Tietoja rikkihapon ja sen suolojen vaikutuksesta kinoliinijohdannaisiin . Julkaisussa: Ber. Saksan kieli Chem. Ges. , 1930, s. 2354 - 2362; doi: 10.1002 / cber.19300630878 .
- ↑ PL Orwick, AR Templeton, American Cyanamid, EP 41 623, 41 624, 1981.
- ^ A. Streitwieser, CH Heathcock, EM Kosower: Orgaaninen kemia . 2. painos. Wiley-VCH, Weinheim 1994, ISBN 3-527-29005-2 , s. 1227.
- H S. Hoogewerff, WA van Dorp: Tietoja kinoliinin hapettumisesta kaliumpermanganaatin avulla . Julkaisussa: Chem. Ber. 1879, 12, s. 747-748; doi: 10.1002 / cber.187901201208 .
- ↑ W.Orth, E.Pastorek, W.Fickert, Rütgerswerke, EP 149857., 1984
- ↑ RWJ Rebhahn, JE Kassner, RE Werner, Hilton-Davis Chemical, US 4537971., 1985
- ↑ S. Murahashi, Sumitomo Chemical, JP 87 212 363, 1986.
- ↑ R. Lattrell, W. Dürckheimer, R. Kirstetter, Hoechst, DE 3 706020, 1987.
- ^ H. Lindlar, R. Dubuis: Palladiumkatalyytti asetyleenien osittaiselle pelkistykselle julkaisussa: Orgaaniset synteesit . 46, 1966, s. 89, doi : 10.15227 / orgsyn.046.0089 ; Coll. Vuosikerta 5, 1973, s.880 ( PDF ).
- Lind H. Lindlar: Uusi katalysaattori valikoivaa hydrausta varten . Julkaisussa: Helv. Chim. Acta , 1952, 35, s. 446 - 450; doi: 10.1002 / hlca.19520350205 .
- ↑ J. Buddrus: Fundamentals of orgaanisen kemian . 3. painos. de Gruyter Verlag, Berliini 2003, ISBN 3-11-014683-5 , s.295 .
- ↑ J. Buddrus: Fundamentals of orgaanisen kemian . 3. painos. de Gruyter Verlag, Berliini 2003, ISBN 3-11-014683-5 , s.538 .
- ^ E. Brandes, W.Möller: Turvallisuuteen liittyvät parametrit - Osa 1: Syttyvät nesteet ja kaasut , Wirtschaftsverlag NW - Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ Käyttöturvallisuuden tekninen sääntö - TRBS 2153, BG RCI -esite T033 Sähköstaattisten varausten aiheuttamien syttymisvaarojen välttäminen , huhtikuusta 2009. Jedermann-Verlag, Heidelberg.
- ↑ K. Hirao, Y. Shinohara, H. Tsuda, S. Fukushima, M. Takahashi, N. Ito: Kinoliinin syöpää aiheuttava aktiivisuus rotan maksassa . Julkaisussa: Cancer Res. , 1976, 36, s. 329-335; PMID 177193 ( kokotekstit ( PDF); PDF; 1,3 Mt).
- ^ A b Y. Shinohara, T. Ogiso, M. Hananouchi, K. Nakanishi, T. Yoshimura, N. Ito: Eri tekijöiden vaikutus maksan kasvainten induktioon eläimissä kinoliinilla . Julkaisussa: GANN , 1977, 68, s. 785-796; PMID 598648 .
- ↑ EJ LaVoie, A.Shigematsu, EA Adams, J.Rigotty, D.Hoffmann: Kinoliinin ja metyloitujen kinoliinien kasvainaloitteinen aktiivisuus SENCAR-hiirten iholla . Julkaisussa: Cancer Lett. , 1984, 22, s. 269 - 273; doi: 10.1016 / 0304-3835 (84) 90162-9 ; PMID 6324986 .
- ^ MM Ramirez-Corredores, AP Borole: Pintatieteen ja katalyysin tutkimukset 164: Biokatalyysi öljynjalostuksessa . 1. painos. Elsevier Verlag, New York 2007, ISBN 0-444-52212-3 , s.155-160 .
- ↑ P. Jenner, B. Testa: Lääkeaineenvaihdunnan käsitteet: A osa . 3. painos. Marcel Dekker, New York 1980, ISBN 0-8247-6906-6 , s.115 .
- ↑ L. Novack, BB Brodie: kinoliini ja sen hajoamistuotteiden virtsassa . Julkaisussa: J. Biol. Chem. , 1950, 187, s. 787-792 ( kokoteksti ).
- ^ JT Smith, RN Williams: Tutkimukset vieroituksesta. 65. Kinoliinin metabolia. Kinoliinin uudet metaboliitit, havaintoja 3-, 5- ja 6-hydroksikinoliinin ja 2: 4-dihydroksikinoliinin metaboliasta . Julkaisussa: Biochem. J. , 1955, 60, s. 284 - 290; PMC 1215695 (ilmainen kokoteksti).
- ↑ a b Kanadan osavaltion tutkintaselostus
- ↑ b J. A. Joule, K. Mills: Heterocyclic Chemistry . 3. painos. Blackwell Science, Oxford 2004, ISBN 0-632-05453-0 , sivut 14-16.
- ↑ H. Tschammler, H. Krischai: Chinolin- m- kresoli, vahvasti negatiivinen järjestelmää . Sisään: kuukausittain Chem. , 1951, 82, s. 259 - 270; doi: 10.1007 / BF00899511 .