Metanoli
| Rakennekaava | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Kenraali | |||||||||||||||||||
| Sukunimi | Metanoli | ||||||||||||||||||
| muut nimet | |||||||||||||||||||
| Molekyylikaava | CH 4 O | ||||||||||||||||||
| Lyhyt kuvaus |
väritön neste, jolla on miellyttävä pistävä haju |
||||||||||||||||||
| Ulkoiset tunnisteet / tietokannat | |||||||||||||||||||
| |||||||||||||||||||
| ominaisuudet | |||||||||||||||||||
| Moolimassa | 32,04 g mol -1 | ||||||||||||||||||
| Fyysinen tila |
nestemäinen |
||||||||||||||||||
| tiheys |
0,79 g cm -3 |
||||||||||||||||||
| Sulamispiste |
-98 ° C |
||||||||||||||||||
| kiehumispiste |
65 ° C |
||||||||||||||||||
| Höyrynpaine |
|
||||||||||||||||||
| p K S -arvo |
16 |
||||||||||||||||||
| liukoisuus |
sekoittuu veteen, etanoliin ja dietyylieetteriin |
||||||||||||||||||
| Dipolihetki |
5,5 · 10-30 ° C |
||||||||||||||||||
| Taitekerroin |
1,3288 (20 ° C) |
||||||||||||||||||
| turvallisuusohjeet | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
|
||||||||||||||||||
| Termodynaamiset ominaisuudet | |||||||||||||||||||
| ΔH f 0 |
−239,2 kJ / mol (neste) |
||||||||||||||||||
| Mahdollisuuksien mukaan ja tapana käytetään SI-yksiköitä . Ellei toisin mainita, annetut tiedot koskevat vakio-olosuhteita . Taitekerroin: Na-D-linja , 20 ° C | |||||||||||||||||||
Metanoli ( IUPAC ), myös metyylialkoholia (vanhentunut puu alkoholia tai puu alkoholi ), on orgaanisen kemian yhdiste jossa empiirinen kaava CH 4 : lla ( semi-rakennekaava : CH 3 OH) ja yksinkertaisin edustaja ryhmä ja alkoholit . Normaaleissa olosuhteissa metanoli on kirkas, väritön, syttyvä ja haihtuva neste, jolla on alkoholihaju. Se sekoittuu monien orgaanisten liuottimien ja veden kanssa kaikissa suhteissa.
Metanolin vuotuinen tuotanto on 60 miljoonaa tonnia (vuodesta 2012), ja se on yksi eniten tuotetuista orgaanisista kemikaaleista. Tekninen tuotanto metanolia tapahtuu pääasiassa katalyyttisesti päässä hiilimonoksidia ja vetyä . Kemianteollisuudessa sitä käytetään erityisesti lähtöaineena formaldehydin , muurahaishapon ja etikkahapon tuotannossa .
Materiaalin käytön lisäksi metanolia ja sen johdannaisia käytetään myös energialähteenä . Metanolista Bensiini teknologia muuttuu metanolia polttoaineeksi. Metanolia tarvitaan biodieselin ja koputuksenestoaineen MTBE synteesiin . Avulla polttokennot , se voi tuottaa sähköenergiaa. Siitä keskustellaan myös halpana, tiheänä pitkäaikaisena aurinko- ja tuulienergian varastointijärjestelmänä.
Luonnossa metanolia esiintyy puuvillakasveissa , hedelmissä ja ruohoissa sekä bakteerien metabolisena tuotteena . In oluen , viinin valmistus- tai tuotanto henkiä , se vapautuu pieniä määriä kuin sivutuotteena , pääasiassa jakautuminen pektiinien . Metanolin hajoamistuotteet, erityisesti formaldehydi , ovat myrkyllisiä. Siksi metanolin kulutus voi johtaa sokeuteen, suurempina annoksina se voi johtaa kuolemaan.
historia
Muinaiset egyptiläiset saivat metanolia pyrolyysillä puuta ( puupiiri ) ja palsameivat kuolleet siihen perustuvien aineiden seoksella. Prosessin kuiva tislaus, Irlannin kemisti Robert Boyle saatiin puhdasta metanolia puksipuu ensimmäisen kerran vuonna 1661 . Vuonna 1834 ranskalaiset kemistit Jean-Baptiste Dumas ja Eugène-Melchior Péligot selventivät tämän vesikirkkaan nesteen koostumusta ja antoivat sille myös nimen "metyleeni", joka on peräisin antiikin Kreikan méthy ( antiikin Kreikan μέθυ ) päihdyttävästä juomasta tai viinistä ja hylé ( muinaiskreikka ὕλη ) komposiittipuulle.
Ensimmäinen synteesi metanolia aikaan Marcelin Berthelot vuonna 1858 saippuoimalla ja metyylikloridia .
Vuonna 1930 Yhdysvallat oli vielä uuttanut noin 50% metanolista, joka tuotettiin puun kuivatislauksella. Tätä varten puu kuumennettiin noin 500 ° C: seen rauta-astioissa. Puuhiili pysyi kiinteänä jäännöksenä , kaasumaiset tuotteet imettiin pois ja osittain kondensoitiin. Lisäksi metanolia, saatua vesipitoista tislettä pääasiassa sisältyvät asetoni , etikkahappo ja metyyli- asetaatti . Näiden komponenttien erottaminen ja lopullinen kuivaus vaati useita neutralointi - tislaus - ja kuivausvaiheita . Metanolin saanto kuivitislauksessa oli noin 1% käytetystä raaka-aineesta riippuen, mutta ei koskaan saavuttanut 3% käytetystä massasta.
BASF sai vuonna 1913 patentin menetelmä metanolin tuottamiseksi kohteesta kohlestämmigem synteesikaasusta . Matthias Pier , Alwin Mittasch ja Fritz Winkler kehittivät prosessin ja käyttivät sitä ensimmäiseen laajamittaiseen metanolin tuotantoon, joka aloitettiin vuonna 1923 Leuna- Werken Merseburgin ammoniakkitehtaalla . Siinä käytettiin oksidisen sinkki - kromi - katalyytin paineessa 250 atm 300 atm. Lämpötilat olivat välillä 360 ° C ja 380 ° C ja suhde hiilimonoksidin ja vedyn oli 1-2,2.
Mukana olevat tutkijat tunnistivat jo varhaisessa vaiheessa, että kuparipohjaiset katalyytit olivat paljon aktiivisempia. Nämä olivat kuitenkin hyvin herkkiä synteesikaasun sisältämille rikkiyhdisteille . Metanolisynteesin jatkokehitys liittyi kivihiilikaasutustekniikan ja kaasunpuhdistusprosessien kehitykseen . Kun oli mahdollista rajoittaa kaasujen rikkipitoisuus alle 0,1 ppm teollisessa mittakaavassa , ICI- yritys kehitti vuonna 1966 ensimmäisen matalapainesynteesin, joka perustui kuparioksidi-sinkkioksidi-alumiinioksidikatalyyttiin.
Tapahtuma
Metaanin jälkeen metanoli on toiseksi yleisin orgaaninen kaasu maapallon ilmakehässä ja sitä esiintyy 0,1 - 10 ppb : n pitoisuuksina . Se on merkittävä ilmakehän formaldehydin ja hiilimonoksidin lähde . Suurin osa ilmakehän metanolista on kasvien päästöjä. Kosteikoilla havaittiin metanolipäästöjä 268 mikrogrammaa neliömetriä ja tuntia kohden, kun taas ruoholla ja laitumilla havaittiin arvot 100-500 mikrogrammaa neliömetriä ja tuntia kohti. Metanoli suoritetaan pektiinin (osittain esteröity metanolipoly -galakturonihapolla ) vapauttamalla pektiinimetyyliesteraasi (PME ), kuten vastauksena saalistajien hyökkäykseen. Kasvien päästämän metanolin kokonaismäärän arvioidaan olevan yli 100 miljoonaa tonnia vuodessa.
Metyyliesterit ja eetterit , jossa metanoli on kemiallisesti sidottu, ovat monissa hedelmät (metyyliesterit) ja ligniinin , joka on osa kasvin soluseinän ( fenyyli metyyli eetteri ). Metyyli- fenyylieetteriryhmän on koniferyylidiasetaatti ja sinapyl alkoholin yksiköt esittää ligniinin Split veden imeytymistä metanolissa ja fenolisen jäännös.
Metanoli on määräajoin entsymaattinen hydrolyysi ja galakturonihaposta -metyyliesteri maseraation vapautetaan. Metanolipitoisuuden pitämiseksi lopputuotteessa, mikä ei ole toivottavaa metanolin toksisuuden vuoksi, pyritään minimoimaan metanolin vapautuminen sopivilla menetelmillä. Tällä tavalla pektolyyttinen entsyymiaktiivisuus voidaan minimoida lisäämällä happoa. Lisäksi, sisällön rikkidioksidin ja lämpötila mäskin vaikuttavat entsymaattisen aktiivisuuden. Lämmittämällä sekoitus hetkeksi 90 ° C: seen ja jäähdyttämällä se nopeasti metanolipitoisuutta voidaan vähentää 40-90%. Alkoholin metanolipitoisuus voidaan pitää alhaisena sopivilla menettelytavoilla tislauksen aikana, esimerkiksi erittäin haihtuvien ainesosien kondensaatiolla. Alkoholijuomat sisältävät joskus huomattavia määriä metanolia. Erilaisten hedelmämehujen ja alkoholijuomien tutkimuksessa Baden-Württembergin tutkintatoimisto löysi huippuarvot enintään 4,7 g · l –1 metanolia väkevissä alkoholijuomissa ja enintään 0,2 g · l –1 viineissä ja hedelmämehuissa .
Tupakka sisältää osittain ligniiniä sisältäviä komponentteja, joiden fenyylimetyylieetterit hajoavat pyrolyyttisesti ja ovat vastuussa metanolin esiintymisestä tupakansavussa. Savun tupakointi vapauttaa metanolia saman periaatteen mukaisesti . Kun aspartaami , metyyliesteri on dipeptidi, α- aminohappojen L - asparagiinihappo ja L - fenyylialaniini , pilkotaan, metanoli lohkaistaan. Kun kulutetaan normaalia määrää aspartaamilla makeutettuja elintarvikkeita, toksikologisesti haitallisia metanoliarvoja ei kuitenkaan saavuteta.
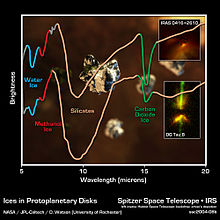
Metanoli on yleistä tähtienvälisessä tilassa , vaikka sen muodostumisen mekanismia ei ole selvitetty. Vuonna 2006 tähtitieteilijät onnistuivat havaitsemaan suuren metanolipilven MERLIN-radioteleskoopilla Jodrell Bankin radio- observatoriossa. Spitzer-avaruusteleskoopin herkillä instrumenteilla oli mahdollista havaita metanoli nuorten tähtien ympärillä olevissa protoplaneettalevyissä .
Valmistus
Metanoli on emäksinen orgaaninen kemikaali ja laajamittainen, laajamittainen alkoholi. Vuonna 2008 metanolin maailmanlaajuinen kulutus oli 45 miljoonaa tonnia. Suurimmat metanolin viejät vuonna 2006 olivat Karibian maat, kuten Trinidad ja Tobago 7,541 miljoonalla tonnilla, Chile ja Argentiina 3,566 miljoonalla tonnilla ja Persianlahden maat 5,656 miljoonalla tonnilla. Suurimmat tuojat olivat Yhdysvallat 7,112 miljoonalla tonnilla, Länsi-Eurooppa 8,062 miljoonalla tonnilla, Taiwan ja Etelä-Korea yhteensä 2,361 miljoonalla tonnilla ja Japani 1,039 miljoonalla tonnilla.
Metanolin tekninen tuotanto tapahtuu yksinomaan katalyyttisissä prosesseissa synteesikaasusta , hiilimonoksidin ja vedyn seoksesta suhteessa noin 1: 2. Nämä menettelyt on jaettu kolmeen alueeseen reaktiopaineiden mukaan. Alun perin kehitetty korkeapaineprosessi toimi alhaisen katalyyttiaktiivisuuden ja reaktion tilavuuden supistumisen vuoksi paineissa 250-350 bar ja lämpötiloissa 360-380 ° C. Keskipainekromatografialla prosessi toimii 100-250 bar ja 220-300 ° C: ssa, alhainen paine prosessi on 50-100 bar ja 200-300 ° C Jokainen prosessi toimii tiettyjen katalyyttien ja hiilimonoksidin ja vedyn massasuhteiden kanssa.
Metanolisynteesiin tarvittava synteesikaasu voidaan tuottaa fossiilisista raaka-aineista, kuten kivihiilestä, ruskohiilestä, maaöljyjakeista ja turpeesta. Kun käytetään uusiutuvia raaka-aineita, kuten puuta, biokaasua tai muuta biomassaa, tuotteeseen viitataan myös nimellä biometanoli. Lisäksi synteesikaasun tuottamiseen voidaan käyttää jätettä tai jätevesiliettettä.
Höyryreformointi ja osittaista hapetusta maakaasun, suurin taloudellisesti käyttökelpoinen mukainen nykyisten arvioiden hiilivety lähde ovat lisäksi hiilen tärkein toimittaja synteesikaasun. Pohjois-Amerikassa ja Euroopassa maakaasua käytetään enimmäkseen raaka-aineena; Kiinassa ja Etelä-Afrikassa synteesikaasun tuotanto perustuu hiileen tai ruskohiileen. Vuonna 2005 Kiina tuotti 5,4 miljoonaa tonnia metanolia, josta 65% eli 3,5 miljoonaa tonnia perustui hiileen.
Seuraavat yhtälöt voidaan formuloida metanolin muodostamiseksi synteesikaasusta:
ja
Alhaisilla synteesipaineilla ja lämpötiloissa saavutettavien taloudellisten etujen vuoksi metanolia tuotetaan suurelta osin matalapaineprosessilla. Dimetyylieetteri , metyyliformiaatti ja etanoli muodostuvat sivutuotteina ja ne voidaan tislata pois. Keskipaineprosessit kompensoivat korkeamman paineen taloudelliset haitat suuremmilla saannoilla . Kohopaineprosessia ei enää suoriteta tänään.
Kiina on nykyisin suurin metanolin tuottaja ja kuluttaja. Pelkästään Kiinan tuotantokapasiteetin odotetaan ylittävän 60 miljoonaa tonnia vuodessa lähivuosina. Vaikka suurinta osaa metanolista käytetään tällä hetkellä kemianteollisuudessa, sen käyttö polttoainealalla on korkeinta. Vuonna 2008 Kiina käytti noin kolme miljoonaa tonnia metanolia sekoituskomponenttina polttoaineseosten tuotannossa . Sopivien moottoreiden ja muiden metanolin kanssa yhteensopivien moottorikomponenttien kehittäminen aiheuttaa ongelmia metanolin laajalle levittämiselle ja suuremmille osuuksille polttoaineessa. Vuonna 2000 Saksassa tuotettiin noin kaksi miljoonaa tonnia, josta noin 1,4 miljoonaa tonnia valmistettiin jäännösöljyistä .
ominaisuudet
| Fyysiset ominaisuudet | |
| Äänen nopeus | 1123 m s −1 (25 ° C) |
| Pintajännitys | 0,0226 Nm −1 (20 ° C ilmaa vastaan) |
| Dynaaminen viskositeetti | 0,544 10 −3 Pa s (25 ° C) |
| Dielektrinen vakio | 33,8 = (25 ° C) |
| Taitekerroin | 1,326 (25 ° C, Na D -linja) |
| Isoterminen kokoonpuristuvuus | 12 · 10 −5 bar −1 (20 ° C) |
| Lämpökapasiteetti | 81,08 J mol −1 K −1 (25 ° C) |
| Itsesyttymislämpötila | 470 ° C |
| Kriittinen lämpötila | 512,5 K |
| Kriittinen paine | 8,084 MPa |
| Kolmoispiste | 175,5 K |
| Magneettinen herkkyys | 5,3 · 10 −7 cm3 · g −1 |
| viskositeetti | 0,808 mPas (0 ° C) 0,690 mPas (10 ° C) 0,593 mPas (20 ° C) 0,449 mPas (40 ° C) 0,349 mPas (60 ° C) |
| Muodostumisen standardientalpia | -238 kJ / mol |
| Tavallinen höyrystysentalpia | +37,4 kJ / mol |
| Tavallinen molaarinen entropia | 127,2 J / (mol K) |
| Tavallinen palamisentalpia | −726 kJ / mol |
| Van der Waalsin yhtälö | a = 964,9 l 2 kPa / mol 2 b = 0,06702 l / mol |
Alkaneista, jotka ovat muodollisesti peräisin alkaaneista, viitataan alkanoleina . Metanoli on yksinkertaisin alkoholi ja muodostaa ensimmäisen jäsenen homologisessa alkanolisarjassa. Aiemmin monet alkoholit viitataan kuten karbinolit perusteella on ehdotus, jonka Hermann Kolbe johdannaisiksi metanoli - johdettu karbinoli . Vuodesta 1957 lähtien IUPAC on suositellut, että tätä nimikkeistöä ei enää käytetä.
Fyysiset ominaisuudet
Normaaleissa olosuhteissa metanoli on väritön, helposti liikkuva neste. Kiehumispiste on 65 ° C. Metanoli kiinteytyy alle -98 ° C: seen värittöminä kiteinä. Mukaan on Antoine, höyrynpaine toiminto johtaa vastaavasti
jossa P bar ja T Kelvin, sekä = 5,20409, B = 1581,341 ja C = -33,5 lämpötila-alueella 288-357 K.
Johtuen napaisuus hydroksyyliryhmä , vetysidoksia välille muodostuu metanoli molekyylien . Sulamispiste vastaa melkein tarkalleen metyylikloridin , mutta vetysidosten muodostuminen nestemäisessä tilassa johtaa suhteellisen korkeaan kiehumispisteeseen verrattuna metyylihalogenideihin . Dissosiaatio energia vetysidoksen on noin 20 kJ / mol.
Metanoli muodostaa atseotroppeja suuren määrän orgaanisten yhdisteiden kanssa, kuten asetonitriilin , bentseenin , kloroformin , syklopentaanin , metyylimetakrylaatin ja tetrahydrofuraanin kanssa . Metanoli sekoittuu veden kanssa supistuvana tilavuutena . Kun tilavuusosuus on 55 - 60% metanolia ennen sekoittamista, saadaan sekoitustilavuus 96,36%.
Metanoli kiteytyy ortorombinen kristallijärjestelmän kanssa hilan parametrit a = 643 pm, b = 724 pm ja c = 467 pm. Rakennetta voidaan kuvata ketjuspolymeeriksi, joka on sitoutunut vetysidosten kautta. Edelleen jäähdytys, joka on faasimuutos tapahtuu taittamalla polymeeriketjun osaksi monokliininen kide järjestelmä .
Molekyyliominaisuudet
Metanolimolekyyli koostuu yhdestä hiilestä , yhdestä hapesta ja neljästä vetyatomista . Molekyylillä on metyyliryhmä, jolla on trigonaalinen symmetria, ja hydroksyyliryhmä rakenneyksiköinä . Molekyyligeometrian tiedot on esitetty luonnoksessa. Sidos kulma välillä hiilen, hapen ja vedyn atomia on 108,9 °, ja on hieman supistui verrattuna tetraedrisen kulma 109,47 °. Sidos pituus välillä happi- ja vetyatomit on 96 pm, ja on näin ollen pienempi kuin hiili-vetysidos pituus metyyliryhmä, joka on 110 pm (1,10 Ä), koska suurempi elektronegatiivisuus happea.
Hiili-happi- sidoksen kiertymisen eston määritettiin olevan 4,48 kJ / mol ja on siten vain kolmasosa kahdesta metyyliryhmästä, esimerkiksi etaanissa .
Kemialliset ominaisuudet
Polaarisen hydroksyyliryhmän vuoksi metanoli voidaan sekoittaa veden kanssa missä tahansa suhteessa. Samankaltaisuus veteen nähdään joidenkin mineraalisuolojen, kuten kalsiumkloridin ja kuparisulfaatin, liuotuskyvyssä metanolissa. Se liukenee myös helposti dietyylieetteriin , hiilivetyihin ja moniin muihin orgaanisiin liuottimiin vettä lukuun ottamatta. Joissakin liuottimissa jopa pienet vesimäärät voivat aiheuttaa erottumisen. Metanoli ei ole kovin liukoinen kasvirasvoihin ja öljyihin .
PK s arvo metanolia on 16, metanoli reagoi happamia vesiliuoksessa. Metanoli voidaan deprotonoida ja metanolaatti vahvojen emästen kanssa . Metanolia voidaan protonoida voimakkailla hapoilla , kuten rikkihapolla .
Metanoli palaa vaaleansinisellä, melkein näkymättömällä liekillä hiilidioksidiksi ja vedeksi. Leimahduspiste on 9 ° C Metanolihöyryt muodostavat räjähtäviä seoksia ilman kanssa välillä 6% - 50% . Metanoli reagoi kanssa alkali- ja maa-alkalimetallien muodostaen vetyä ja metanolaatit. Se reagoi helposti monien hapettimien , kuten bariumperkloraatin , bromin tai vetyperoksidin kanssa . Metanoli hyökkää erilaisiin muoveihin, maaleihin ja kumiin.
Metanoli reagoi kanssa karboksyylihappojen sisään hapon tai emäksen katalyysin kanssa veden vapautuminen, jolloin muodostuu metyyliesterit ; Kanssa karboksyylihappoesterit , transesteröinti on mahdollista vapauttaa ja poistaminen muuta alkoholia komponentti reaktioseoksesta tai yli metanolissa.
Metanoli voidaan katalyyttisesti hapettaa formaldehydiksi . Että happamien katalyyttien läsnä ollessa, metanoli reagoi kanssa aldehydien ja ketonien ja hemiasetaaleja tai dimetyyli asetaaleja , joita voidaan käyttää suoja- ryhmiä, orgaanisessa kemiassa.
käyttää
Metanolia käytetään muun muassa lähtöaineena kemianteollisuudessa tai energiantoimittajana. Materiaalin kierrätys kemiallisena raaka-aineena vaatii erityisen puhtaan tuotteen. Raaka metanoli voidaan polttaa energialähteenä kiinteissä laitoksissa. Puhtaan metanolin ja veden seos tarjoaa myös kemiallisen energian polttokennojen käyttämiseen, jotka muuttavat ne sähköenergiaksi. Käyttö polttoaineena, ns. Polttoaine-metanolina , tutkitaan perusteellisesti. Se voidaan lisätä tavanomaisiin moottoripolttoaineisiin tai puhdasta metanolia voidaan käyttää. Metanolia käytetään polaarisena liuottimena . Tässä Rectisol prosessissa , sitä käytetään erillisiä happamat komponentit, kuten hiilidioksidia tai karbonyylisulfidia kaasuvirroista. Vuosina 2005–2009 aineellisesti käytetyn metanolin kokonaismäärä kasvoi noin 6%, kun taas energinen käyttö kasvoi 55%.
Metanoli kemiallisena raaka-aineena
Metanoli on tärkeä lähtöaine synteeseille kemianteollisuudessa. Määrällisesti suuri merkitys on ensisijainen johdannaisia formaldehydin, etikkahapon, MTBE, metyyli-metakrylaatti , metyylikloridia ja metyyli amiineja . Nämä prosessoidaan useiksi toissijaisiksi ja tertiäärisiksi johdannaisiksi. Tunnettuja esimerkkejä ovat vinyyliasetaatti , etikkahappoanhydridi , fenoli-formaldehydihartsit ja melamiinihartsit .
formaldehydi
Suurin osa metanolista jalostettu osaksi formaldehydi muunnetaan hapettamalla hapella on hopea katalyyttejä tai Formox prosessissa rautaoksidiin / molybdeeni / vanadiinioksidi katalyyttien 400 ° C: ssa
Formaldehydimarkkinat Pohjois-Amerikassa kutistuivat noin 15% vuosina 2006–2010, mikä johtui pääasiassa huonekalu- ja rakennusalan kysynnän laskusta. Markkinoiden määrä Pohjois-Amerikassa oli noin 4 miljoonaa tonnia vuonna 2010. Formaldehydiä käytetään pääasiassa urea- , fenoli- ja melamiini-formaldehydihartsien tuotannossa , joista suurimpia kuluttajia ovat rakennus- , auto- ja puuteollisuus . Formaldehydihartseja käytetään puutuotteiden valmistuksessa, esimerkiksi kovalevyn ja lastulevyn sideaineina . Nopeasti kasvavat markkinat ovat polyoksimetyleenin , metyleenidi-isosyanaatin ja 1,4-butaanidiolin valmistus . Vuonna 2005 Kiina oli maailman suurin formaldehydin tuottaja, jonka kapasiteetti oli 11 miljoonaa tonnia.
etikkahappo
Metanolia käytetään etikkahapon tuottamiseen reaktiossa hiilimonoksidin kanssa Monsanto-prosessin mukaisesti ja etikkahappoanhydridin tuottamiseksi metyyliasetaatin avulla Tennessee-Eastman-etikkahappoanhydridimenetelmän mukaisesti . Katalyyttisesti aktiivinen laji on anioninen rodium monimutkainen cis- [Rh (CO) 2 I 2 ] - , jossa vetyjodidin kuin kokatalyyttinä .
Katalyyttisessä syklissä metanoli reagoi ensin hydriodihapon kanssa muodostaen metyylijodidia , joka lisää oksidatiivisesti rodiumkompleksia. Hiilimonoksidi työntyy metalli-metyylisidokseen muodostaen formyylikompleksin . Tämä eliminoituu kompleksista happohalidina . Happojodidi reagoi jälleen veden kanssa muodostaen hydrogeenihapon ja etikkahapon.
Tuotannon etikkahappoanhydridin , osa tuotetta muunnetaan metyyliasetaattia metanolilla ja johdetaan takaisin prosessiin. Etikkahappoanhydridi saadaan kokonaan synteesikaasun perusteella.
Toinen tästä synteesistä johdettu tuote on vinyyliasetaatti . Mukaan hydrocarbonylating etikkahapon anhydridiä ja metyyliasetaattia , kun läsnä on homogeeninen rodium- katalyyttejä lämpötiloissa noin 150 ° C ja paineessa noin 40 bar 70 bar etylideeni taatti muodostuu, joka voidaan jakaa vinyyliasetaattia ja etikkahappoa kohonnut lämpötila happokatalyysillä.
Muut johdannaiset
Metyylimetakrylaatti , monomeeri on polymetyylimetakrylaatti , valmistetaan hydrolysoimalla ja sen jälkeen esteröimällä 2-methylpropenenitrile muodostettu mistä asetonisyaanihydriinin rikkihapon kanssa metanolin läsnä ollessa.
Metanoli voidaan dehydrogenoida metyyliformiaatiksi seostettujen kuparikatalyyttien avulla . Kun tuotettu vety on erotettu, metyyliformiaatti pestään ensin kylmällä metanolilla ja erotetaan sitten tislaamalla.
Esteröimällä voidaan valmistaa joukko sivutuotteita. Kloorimetaania voidaan tuottaa selektiivisesti muuntamalla halpa suolahappo . Rasvahappometyyliestereitä voidaan valmistaa tavanomaisilla uudelleenesteröintimenetelmillä. Dimetyylitereftalaatti saadaan hapettamalla p- ksyleeni kaksivaiheisesti esteröinnin välivaiheella .
Metanolin reaktio ammoniakin kanssa käyttäen alumiinisilikaatteja katalysaattorina tuottaa metyyliamiinien seoksia , mikä on väriaineiden, lääkkeiden ja torjunta-aineiden esiaste.
Muuntamalla metanoli ZSM-5-tyyppisiksi zeoliiteiksi metanoli-olefiiniprosessissa voidaan tuottaa lyhytketjuisia olefiineja , kuten etyleeni , propyleeni ja buteenit , jotka saatiin aikaisemmin enimmäkseen krakkaamalla kevyt teollisuusbensiini . Ensimmäisessä vaiheessa muodostuu dimetyylieetteri, joka reagoi edelleen muodostaen eteenin veden poistuessa.
Selektiivisyyttä aromaattisille tuotteille voidaan muuttaa vaihtelemalla reaktio-olosuhteita (metanolista aromaattiseksi, MtA) .
Metanoli energia-alalla
Metanolia voidaan käyttää energialähteenä monin tavoin. Sitä voidaan käyttää raaka-aineena kemiallisessa muuntamisessa muiksi polttoaineiksi. Lisäksi metanolia voidaan käyttää 15-prosenttisena seoksena bensiinin (M15) kanssa tai suoraan puhtaana metanolina (M100). Energiatiheys (lämpöarvo) on noin puoli että bensiinin . Puhdas metanoli voi toimia vedyn toimittajana polttokennoissa, tai sitä voidaan käyttää suoraan metanolin suorassa polttokennossa (ts. Ilman välituotetta vetyä) sähköenergian tuottamiseksi. Yhdessä energian varastointimateriaalin katalyyttisen tuotannon kanssa voidaan asettaa suljettu tai avoin piiri ratkaisemaan vaihtoehtoisten energialähteiden energiapuskuriongelma. Useita sähköisiä tai fotonisia reaktioita sisältäviä valmistusvaihtoehtoja on jo käytössä, ja niitä kehitetään parhaillaan aktiivisesti korkeamman hyötysuhteen suuntaan. Toisen maailmansodan aikana metanolia sisältäviä seoksia käytettiin polttoaineena raketti- ja lentokoneiden moottoreissa ( MW-50 ). Siten C-aine , metanolin, hydratsiinia , vettä ja Kaliumtetracyanidocuprat (I) (K 3 [Cu (CN) 4 ]), sekä T-kangas , suuren pitoisuuden vetyperoksidia , kuten itsesyttyvä, hypergolisia käytetty polttoaine.
Metanoli polttoaineena
| Metanolipolttoaine | |
|---|---|
| muut nimet |
M100, Metoli, Spritoli, Metyylioksihydraatti, Methynol, Pyroholzether, Spiritol, Holzin, puualkoholi, puupiiri, karbinoli, puupiiri, karbinoli, metyylialkoholi |
| Lyhyt kuvaus | Bensiini mukautetuille moottoreille |
| Tyypilliset komponentit |
Metanoli |
| CAS-numero | |
| ominaisuudet | |
| Fyysinen tila | nestemäinen |
| tiheys |
0,79 kg / l |
| lämpöarvo |
15,7 MJ l −1 = 19,9 MJ kg −1 |
| Lämpöarvo |
17,9 MJ l −1 = 22,7 MJ kg −1 |
| Oktaaniluku |
106 RON |
| Leimahduspiste |
9 ° C |
| Syttymislämpötila | 440 ° C |
| Räjähdysraja | 6–50 tilavuusprosenttia |
| Lämpötilaluokka | T2 |
| turvallisuusohjeet | |
| YK-numero | 1230 |
| Vaaran numero | 336 |
| Mahdollisuuksien mukaan ja tapana käytetään SI-yksiköitä . Ellei toisin mainita, annetut tiedot koskevat vakio-olosuhteita . | |
Metanolia voidaan käyttää joko suoraan polttoaineena tai polttoaineen lisäaineena monin eri tavoin. Nykyään tunnetaan useita mahdollisuuksia käyttää bensiini- ja dieselpolttomoottoreissa . Mukaan eurooppalaisen standardin varten bensiinin EN 228 , enintään seoksia 3 tilavuusprosenttia polttoaineen sallitaan lisäämällä stabilointiaineita . Tällaiset pienet lisäaineet voidaan käsitellä nykypäivän bensiinimoottoreissa ilman säätöjä. Kustannussyistä Saksa ei ole vielä käyttänyt näitä mahdollisuuksia.
Lisäksi metanolia voidaan käyttää seoksena suurempina pitoisuuksina bensiiniin tai melkein puhtaana metanolipolttoaineena. Saksassa liittovaltion opetus- ja tutkimusministeriö sponsoroi laajamittaisen testin 1980-luvulla M15-polttoaineella, joka koostui 15% metanolista ja 85% bensiinistä, ja M85-polttoaineella vastaavilla suhteilla; se testasi näitä perusteellisesti yli 1000 ajoneuvolla kaikilta saksalaisilta autonvalmistajilta mineraaliöljyteollisuuden ja lukemattomien tutkimuslaitosten tuella . Ajoneuvot on mukautettu materiaalien ja seosten suhteen käytettäviksi näiden polttoaineiden kanssa. Yhdysvallat, Japani, Kiina, Uusi-Seelanti ja Etelä-Afrikka tekivät samanlaisia kokeita. Ohjelma testasi myös autojen metanoli-diesel-sekoitettua polttoainetta, jossa oli 20% metanolia.
Hyötyajoneuvojen dieselmoottoreita on muunnettu käyttämään puhdasta metanolia (M100). Koska pieni setaaniluku metanolia, se ei ole mahdollista käyttää moottoria kuten puristus-sytytys moottori . Siksi testaajat käyttivät ylimääräisiä sytytysvälineitä diesel- pilotti- tai kipinäsytytyksen tai hehkusytytyksen muodossa . Säiliöalusalus Lindanger on tyypin alus seitsemälle tuotesäiliöalukselle, joiden kaksipolttoainekaksimoottorit toimivat metanolilla. Dual-fuel pääkonetta tyypin B & W 6G50ME-9,3 LGIB kanssa nimellisteholtaan 10320 kW 100 rpm ajetaan metanolin ja MGO kuten sytytys öljynä . Ne on kehittänyt MAN B&W Kööpenhaminassa ja rakentaneet Hyundai Heavy Industriesin moottori- ja konepajateollisuus.
Kahden polttoaineen dieseli-metanolitoiminto on myös mahdollista. Metanoli hehku sytytin moottorin kehittämä by Franz Pischinger on hyvät päästöarvot alhainen kulutus.
Moottoreissa on sovitettu puhtaalla metanolilla M100 ja M85, verrattuna bensiinimoottorit, jopa 10% suurempi moottorin teho ja noin 15% parempi terminen hyötysuhde voidaan saavuttaa, siten vähemmän energiaa kulutusta . Nestemäisenä polttoaineena metanoli on erityisen sopiva liikennealalle, koska se on helposti käsiteltävissä kaasumaisiin polttoaineisiin verrattuna, tie-, vesi- ja rautatiekuljetuksiin sekä rajoitetusti ilmailuun.
Vaikka nykyään bensiinimoottoreissa yleisesti käytetyllä katalysaattoritekniikalla ei ole enää etuja hiilivetyjen, hiilimonoksidin ja typpioksidien rajoitetuille päästöille, rajoittamattomille päästöille on vähäisiä etuja. Esimerkiksi metanoli ei lähetä aromaattisia aineita, kuten bentseeniä , tolueenia ja alempia polysyklisiä aromaattisia hiilivetyjä, ja sillä on pieni otsoninmuodostuspotentiaali . Toisaalta haittana on lisääntynyt formaldehydipäästö, jolloin kaikkien tässä lueteltujen päästökomponenttien taso on erittäin alhainen katalyytin takia. Dieselpolttoaineiden avulla rikkipäästöt ja noken muodostuminen eliminoidaan suurelta osin . Metanolissa on lähes 50% dieselin ja bensiinin lämpöarvosta .
Metanolin myrkyllisyys, joka vaatii varotoimenpiteitä tankkaamisen ja ajoneuvon parissa työskentelyn yhteydessä, on haitallista. Koska metanoli on biologisesti hajoavaa , ympäristölle ei ole juurikaan vaaraa onnettomuustapauksissa.
Yhdysvaltain moottoriurheilussa 1960-luvulla amerikkalainen Formula Racing -sarja ( CART , Indy Car ) korvasi bensiinin, jota ei voitu sammuttaa vedellä, metanolilla Indianapolis 500: n vakavien palo-onnettomuuksien jälkeen . Haittana on, että puhtaan metanolin polttaminen on tuskin näkyvissä. Kilpailussa tankkaamisen jälkeen vettä suihkutetaan aina täyttökaulan yli vuotaneen metanolin poistamiseksi ennen kuin se syttyy kuumiin osiin. Kuten etanoli, metanoli on erityisen sopiva ahdettuihin moottoreihin . Dragstereilla, joissa on kahdeksan litran ahdettu V8-moottori ja jotka ovat huippumetanoliluokkaa, saavutetaan yli 3500 hv: n teho.
Mallirakentamisessa hehkusytytysmoottoreissa käytetään metanolia, johon on lisätty nitrometaania . Sen käyttö vähenee voimakkaasti, koska mallirakennepolttoaineet ovat kalliita ja modernit litiumioniakkuilla varustetut sähkömoottorit ovat yhä halvempia ja hiljaisempia.
Metanoli polttokennoissa
Metanolia voidaan käyttää sähköenergian saamiseksi polttokennoista kahdella tavalla: joko metanoli toimii vedyn toimittajana vetypolttokennossa tai se muuttuu suoraan polttokennossa. Vetypolttokennojen toimittamiseksi metanoli on ensin muutettava vedyksi ja hiilidioksidiksi CO 2 lisäämällä energiaa . Tässä vaiheessa käytetään metanolireformaattoria (katso epäsuora metanolin polttokenno ). Sitten vety erotetaan CO 2: sta (ja mahdollisesta CO) ja syötetään polttokennoon, jossa se muuttuu. Vaihtoehtona yhdistelmä reformerin ja H 2 soluun, suoraan metanolia polttokennot sopivat tämä voi käyttää metanoli-vesi-seos suoraan, toisin sanoen ilman muuntamista vety. Tämä toimintaperiaatteeltaan yksinkertaisempi muunnelma on edullinen pienille kuluttajille, kuten jääkaapit tai televisiot, kun leiriytyvät tai mittaavat laitteita. Valmistajan mukaan yli 40 000 tällaista polttokennoa oli myyty vuoteen 2018 mennessä.
Tapahtuvat reaktiot ovat:
Anodireaktio:
Katodireaktio:
Kokonaisreaktio:
Tämän tyyppinen solu käyttää protoninvaihtokalvon kuin elektrolyytti . Metanoli-vesi-seos syötetään anodin ja metanoli hapetetaan siellä, jotka tuottavat hiilidioksidia kuin pakokaasun . Tällä katodi , vety ionit reagoivat ilmakehän hapen kanssa muodostaen vettä. Yksi suora metanolipolttokennon ongelma on kalvon läpäisevyys metanolille, mikä vähentää tehokkuutta.
Metanolijohdannaiset polttoaineena
Metanolin primaarijohdannaisia käytetään jo monin eri tavoin polttoaineena tai polttoaineen lisäaineena. Käyttö oktaani booster MTBE, joka on hyväksytty Yhdysvalloissa vuonna 1979, että EPA pitoisuuksina välillä 2 ja 5%, on tunnettua. Dimetyylieetterijohdannaista (DME) käytetään dieselpolttoaineena. Metanolia käytetään kasviöljyn uudelleenesteröintiin ja biodieselin tuotantoon. Johdannaisten etuihin kuuluu niiden vapaus rikistä ja aromaattisista aineista. Energiatiheys on korkeampi kuin puhtaalla metanolilla.
Biodieseli
In biodieselin tuotannossa , käytetään metanolia transesteröimiseen kasviöljyjä. Tätä tarkoitusta varten esimerkiksi rapsiöljy transesteröidaan metanolilla emäksisen katalyysin avulla. Metanolia lisätään glyseroliesterin ja alkoholin stökiömetrisen suhteen yli reaktion siirtämiseksi metyyliesterin puolelle . Glyseriiniä tuotetaan sivutuotteena. Kun reaktio on päättynyt, faasit erotetaan ja biodiesel pestään ja tislataan jatkokäsittelyä varten. Nykyaikaisen biodieselin tuotantolaitosten kapasiteetti on noin 200 000 tonnia vuodessa; Saksan kokonaiskapasiteetti vuonna 2006 oli 3 840 500 tonnia.
Metanoli bensiiniksi
Metanoli-bensiini-prosessissa metanolia käytetään korkeaoktaanisten kaasuttimien tuottamiseen . Konvertoimalla zeoliitin - katalyyttien tyypin ZSM-5 on välituote dimetyyli eetteri, hiilivety seos muodostuu. Reaktio tapahtuu ensimmäisessä vaiheessa dehydratoimalla dimetyylieetteri eteeniksi ja muiksi kevyiksi olefiineiksi, jotka voivat oligomeroida ja syklisoitua jatkovaiheissa tuotteiksi, joissa on vähintään viisi hiiliatomia . Reaktiomekanismi on monimutkainen, ja sitä on tutkittu intensiivisesti tähän päivään saakka.
Viipymäajat ovat pidempiä ja lämpötilat ovat korkeammat kuin niihin liittyvine MTO ja MTA prosesseja. Saatu bensiini on rikitöntä ja sen bentseenipitoisuus pieni . Prosessi voidaan suorittaa kiinteä- tai leijupetimenetelmällä . Leijukerrosprosessilla on etuja jatkuvan katalyytin regeneroinnin kautta , mikä mahdollistaa alhaisemmat paineet. Yhteensä perustanut koelaitoksen, jonka tuotantokapasiteetti on 1700 tonnia polttoainetta päivässä Uudessa-Seelannissa. Rheinbraun käytti toista koelaitosta pitkään Berrenrathissa Nordrhein-Westfalenissa . Sen rakensivat Uhde ja Lurgi yhdessä .
MTBE
Metanolin happokatalysoidulla konversiolla isobuteenin kanssa on valmistettu metyyli- tertiäärinen butyylieetteri (MTBE), joka on oktaanin tehostaja. MTBE: n happipitoisuus parantaa polttoaineen palamista kaasuttimen moottoreissa. Tällä tavoin saavutettu ilmanparannus oli tärkein syy siihen, miksi bensiinin happipitoisuutta lisäävien kemikaaliryhmän hapettimien käyttö määrättiin Yhdysvaltojen vuonna 1992 antamassa Clean Air Actissa (CAA). Jalostamot saavuttivat asetuksessa määritellyn polttoaineen tavoitteen, joka on 2,7 painoprosenttia happea , pääasiassa MTBE: n avulla.
Sen jälkeen, kun MTBE havaittiin pohjavedessä, Kalifornia ja muut Yhdysvaltojen osavaltiot kieltivät MTBE: n käytön oktaanilukuna, koska pitoisuudet, jotka olivat noin 40 µg MTBE: tä vesilitraa kohden, heikensivät juomaveden laatua. Euroopassa ja Saksassa MTBE: n käyttöä lisättiin direktiivillä 85/535 / ETY ja myöhemmin polttoaineiden laatua koskevalla direktiivillä 98/70 / EY, jonka mukaan enintään 15 tilavuusprosentin seos on sallittu. Saksassa ja EU: ssa tutkimuksissa ei ole havaittu suoraa terveys- tai ympäristövahinkoa MTBE: stä, eikä kieltoa harkittu.
Dimetyylieetteri
Helposti nesteytetty kaasun dimetyylieetteri (DME) voidaan valmistaa metanolin katalyyttisellä dehydrauksella piidioksidi-alumiinioksidikatalyyttien läsnä ollessa. Jotkut yritykset pitävät DME: tä lupaavana polttoaineena dieselmoottoreissa ja kaasuturbiineissa. DME: n setaaniluku on 55 ja siten suurempi kuin tavanomaisen dieselin. Palaminen on suhteellisen puhdasta ja johtaa vain pieniin hiukkaspäästöihin, typen oksideihin ja hiilimonoksidiin. Eurooppalainen BioDME-projekti tutkii, voidaanko lignoselluloosasta tuotettua DME: tä tuottaa teollisessa mittakaavassa.
Muu käyttö
Metanolia käytetään myös monilla alueilla. Sitä käytetään liuottimena ja jäätymisenestoaineena . In lämpöputket keskipitkällä maksimilämpötila 500 K, metanolia käytetään siirto nestettä . Sitä käytetään myös digitaalisten yksiobjektiivisten refleksikameroiden antureiden puhdistamiseen , koska se ei jätä juovia ja haihtuu jättämättä jäämiä. Mono- ja perdeuteroitua metanolia käytetään liuottimina ydinmagneettisen resonanssin spektroskopiassa . Jätevedenpuhdistamoissa jätevesiin lisätään metanolia denitrifikaation tukemiseksi , nitraatin muuttamiseksi kaasumaiseksi typeksi. Bakteerien aineenvaihduntaprosessit edellyttävät metanolia lisäenergialähteenä. Jätteiden käsittelyssä, metanolia käytetään solvolyyttinen kierrätystä ja polyeteenitereftalaatista . Prosessissa otetaan talteen etyleeniglykoli ja dimetyylitereftalaatti. Metanolia käytetään erottamaan polystyreeni ja kloropreenikumi polymeeriseoksista, esimerkiksi kapseloimaan muita polymeerejä, kuten butadieenikumia .
Metanolin käyttöä hiilen kuljettamiseen metanoli-hiili- lietteissä on tutkittu laajasti. Tässä prosessissa hiili-metanoliliete voidaan polttaa suoraan tai metanoli voidaan erottaa tislaamalla ja pumpata takaisin paikkaan, josta hiili uutetaan putkistojen kautta. Metanolia käytetään uuttoaineena kemian- ja öljyteollisuudessa esimerkiksi aromaattisten ja parafiinisten hiilivetyjen erottamiseksi.
Biologinen merkitys
Metanoli substraattina anaerobisessa aineenvaihdunnassa
Metanoli ei hajoa vain hiilidioksidiksi energian tuottamiseksi, vaan se voi myös toimia hiilen lähteenä solukomponenttien rakentamiseksi. Tämä koskee erityisesti anaerobisen methanotrophs että omaksua C 1 yhdisteitä . Yleensä metanoli hapetetaan ensin formaldehydiksi, ja se voidaan rakentaa hiilihydraateiksi joko ns. Wood-Ljungdahl -reitillä , seriinireitillä tai ribuloosimonofosfaattireitillä .
Metanoli välituotteena metaanin aerobisessa hajoamisessa
Metanoli muodostuu metaanin hapettumisen metanotrofisten bakteerien metabolian välituotteena. Metylotrofisia bakteerit ( Methylophilaceae ) ja hiivat, esimerkiksi leipurin hiiva , myös hapettaa muita C 1 yhdisteet, kuten metanoli ja formaldehydiä energian tuotantoon. Hajoaminen tapahtuu aerobisissa ympäristöissä lähellä metaanikerrostumia.
Metaanin aerobinen biologinen hajoaminen tapahtuu metanolin, formaldehydin ja formiaatin vaiheiden kautta hiilidioksidin (CO 2 ) muodostamiseksi.
Seuraava koskee yleistä reaktiota:
Metaanin hapettumista metanoliksi katalysoi metaanimono-oksigenaasi- entsyymi kuluttamalla happea ja nikotiiniamidiadeniinidinukleotidia (NAD (P) H). Tuloksena olevan metanolin edelleen hapettuminen formaldehydiksi tapahtuu eri tavoin lajista riippuen. Gram-negatiiviset bakteerit hapettavat metanoli kautta liukoinen metanoliin dehydrogenaasi on periplasmiseen tilaan , jossa pyrrolokinoliini- kinoni (PQQ) kuten koentsyymi . Grampositiiviset, metanotrofiset bakteerit, kuten basillit ja aktinomykeetit, käyttävät sytosolista NAD (P) H -riippuvaista dehydrogenaasia. Sitä vastoin hiivat hapettavat metanolia peroksisomeissa , jota katalysoi FAD- riippuvainen alkoholioksidaasi . Elektronit siirtyvät happeen, jolloin syntyy vetyperoksidia .
Formaldehydin hapettumiselle tunnetaan useita aineenvaihduntareittejä. Formaldehydi on erittäin reaktiivinen ja sitoutunut esimerkiksi adduktina tetrahydrofoolihappoon tai tetrahydrometaanetanopteriiniin tai vaihtoehtoisesti glutationiin .
Yksisoluiset proteiinit
Menetelmää yksisoluisten proteiinien (yksisoluisten proteiinien) tuottamiseksi metanoliin perustuen on tutkittu laajasti. Esimerkiksi bakteerit Methylophilus methylotropha tyyppi on fermentoitu on airlift reaktoreissa , käyttäen ammoniakkia typpilähteenä . Tämä johtaa proteiini-rikas tuotteita, joiden aminohappo- koostumus on samanlainen kuin kalajauhoa . Metanoliin perustuvien yksisoluisten proteiinien käyttö rehutarkoituksiin on toksikologisesti ja ravitsemuksellisesti vaaraton. Asianmukaisen käsittelyn jälkeen proteiineja voidaan käyttää ruokana. ICI prosessi on jo toteutettu teollisessa mittakaavassa, mutta tuotteet eivät voineet pitää kaupan verrata edullisia soija- ja kalajauhotuotteita. Metanolin käytön etuna muihin hiililähteisiin verrattuna on sen sekoittuvuus veteen, pienempi happitarve ja pienempi lämmöntuotanto käymisen aikana.
Deuteroitu metanoli
Metanolista on kolme erilaista deuteroitua muunnosta:
- Metanoli-d1 , myös MeOD , jossa vain hydroksyyliryhmän vetyatomi vaihdettiin deuteriumiksi
- Metanoli-d3 , jossa metyyliryhmän vetyatomit on korvattu
- Metanoli-d4 , jossa kaikki vetyatomit on vaihdettu
Metanoli-d4: ää (perdeuterometanoli) käytetään liuottimena ydinmagneettisen resonanssin spektroskopiassa (NMR).
toksikologia
Metanoli imeytyy helposti hengitettynä , nieltynä tai joutuessaan iholle. Se jakautuu nopeasti kehossa nesteiden kautta. Pienet määrät erittyvät muuttumattomina keuhkojen ja munuaisten kautta.
Aineenvaihdunta ja myrkyllisyys vastaavat etyleeniglykolilla havaittuja . Raaka-aine metanoli korvataan vain alhaisella myrkyllisyydellä ( myrkyllisyys ). Sen hajoamistuotteet ( metaboliitit ) ovat myrkyllisiä , kuten ADH: n ( alkoholidehydrogenaasin ) muodostama formaldehydi (ks. Kuva oikealla) ja siitä tuotettu muurahaishappo . Erityisesti jälkimmäinen johtaa metabolisen asidoosin kehittymiseen 6-30 tunnin latenssivaiheen jälkeen , joka on usein ilman oireita . Muurahaishappo hajoaa ihmisen aineenvaihdunnassa vain hyvin hitaasti ja kerääntyy siten kehoon metanolin suhteellisen nopean hajoamisen aikana. Formaldehydin myrkyllisyys on kiistanalainen metanolimyrkytyksessä. Koska katalyyttinen entsyymin toiminnan aldehydidehydrogenaasi, se on edelleen jakaa muurahaishappoa hyvin nopeasti, niin että ei kerry formaldehydin kehossa. Annokset 0,1 g metanolia painokiloa kohti ovat vaarallisia, yli 1 g / kg ruumiinpainoa ovat hengenvaarallisia.
Myrkytysoireita metanolia myrkytyksen suorittaa kolmessa vaiheessa. Heti metanolin nauttimisen jälkeen ilmenee huumausaine , kuten etanolilla , mutta päihdyttävä vaikutus on vähäisempi kuin etanolilla. Latenssivaiheen jälkeen kehittyvän metabolisen asidoosin yhteydessä esiintyy päänsärkyä, heikkoutta, pahoinvointia, oksentelua, huimausta ja kiihtynyttä hengitystä . Kolmannelle vaiheelle, asidoosille, on tunnusomaista hermojen, erityisesti näköhermon (näköhermon) vaurioituminen . Näköhäiriöt, jotka voivat heiketä, ovat alun perin aiheuttama turvotus on verkkokalvolle . Rappeutumista näköhermon - tässä tapauksessa myrkyllistä optikusneuropatian - myöhemmin johtaa sokeuteen . Tämä vahinko on peruuttamaton. Kuolema voi johtua hengityshalvauksesta .
Metanolimyrkytyksen hoitamiseksi estetään metanolin hajoaminen ihmiskehossa, jotta myrkyllisiä sivutuotteita ei synny. Tätä tarkoitusta varten voidaan antaa noin 0,7 g etanolia (yleisesti: alkoholi) painokiloa kohti, mikä estää kilpailulla metanolin hajoamisen, koska entsyymillä on suurempi affiniteetti etanoliin ja hajottaa siten sitä ensisijaisesti ( substraattispesifisyys ). Tehokkaan hoidon saavuttamiseksi etanolitaso on pidettävä yllä päivien ajan osittain päihtymisasteesta ja myrkytetyn fyysisestä kunnosta riippuen. On tehokkaampaa ottaa ADH- estäjä 4-metyylipyratsoli ( fomepitsoli ), joka myös kilpailevasti estää metanolin hajoamista . Samanaikaisesti muurahaishapon hajoamista kehossa voidaan edistää antamalla foolihappoa . Kanssa natriumbikarbonaattia happamoituminen rungon (voi asidoosi ) ovat vastakkain. Vakavan myrkytyksen tai erityisten sairauksien, kuten maksakirroosin tai vastaavien, tapauksessa hemodialyysi voi olla tarpeen. Hoitoa on jatkettava, kunnes metanolipitoisuus veressä on laskenut tietyn rajan alle.
Vuoteen asetuksella nro. 110/2008 Euroopan parlamentin ja neuvoston metanolipitoisuutta erilaisia alkoholijuomia, joissa Euroopan unioni on rajoitettu. Hedelmäjäännös Brandyn metanolipitoisuus 15 g · l −1 (laskettuna puhtaasta etanolipitoisuudesta) on yläraja.
Harvinaisissa tapauksissa alkoholijuomat voivat sisältää lisääntyneitä määriä metanolia väärän sekoittamisen , käymisen ja tislauksen tai pakastamisen seurauksena . Suurin osa tunnetuista metanolimyrkytystapauksista, esimerkiksi kiellon tai vuonna 1986 tehdyn metanoliviiniskandaalin aikana , voidaan jäljittää juomaan alkoholia, joka on sekoitettu tietoisesti tai tiedostamattomasti metanoliin.
Vuonna 2012 EU sisällytti metanolin yhteisön meneillään olevaan toimintasuunnitelmaan ( CoRAP ) asetuksen (EY) N: o 1907/2006 (REACH) mukaisesti osana aineen arviointia . Vaikutukset aineen ihmisten terveydelle ja ympäristölle arvioidaan uudelleen ja tarvittaessa seurantatoimet käynnistetään. Metanolin käyttöönoton syyt olivat huoli kuluttajien käytöstä , ympäristölle altistuminen, työntekijöiden altistuminen ja laaja käyttö sekä vaarat, jotka johtuvat mahdollisesta luokituksesta CMR- aineiden ryhmään . Uudelleenarviointi tehtiin vuodesta 2012, ja sen suoritti Puola . Sitten julkaistiin loppuraportti.
todiste
Metanolilla on alkoholin kaltainen haju. Jos metanoli sekoitetaan booraksin kanssa ja sytytetään, tuloksena oleva trimetyyliboraatti palaa voimakkaalla vihreällä liekillä. Tämä reaktio toimii samanlaisilla tuloksilla, mutta vähemmän voimakkaalla vihreällä värillä, jopa etanolin kanssa lisäämällä väkevää rikkihappoa . Siksi etanoli ja metanoli voidaan erottaa tällä ns. Booraksinäytteellä.
Metanoli havaitaan usein kaasukromatografisilla menetelmillä, kuten liekki-ionisaation ilmaisulla tai kytketyllä massaspektrometrialla . Näytteen alkuperästä riippuen se joko konsentroidaan tai uutetaan etukäteen eri menetelmillä. Ilmassa olevan metanolin havaitsemiseksi se johdetaan ensin silikageelin tai aktiivihiilen läpi metanolin adsorboimiseksi ja väkevöimiseksi. Metanoli vapautuu uudestaan seuraavalla termisellä desorptiolla . Nestemäisten näytteiden tapauksessa, esim. Detektoimiseksi polttoaineessa, näyte uutetaan ensin esimerkiksi eteeniglykolilla ja analysoidaan sitten kaasukromatografialla. Uutto vedellä on mahdollista kiinteille näytteille.
Tuotantojärjestelmiä voidaan seurata suoraan valmistusprosessin aikana käyttämällä infrapunaspektroskopiaa . Toinen menetelmä on metanolin hapetus voimakkailla hapettimilla, kuten kaliumpermanganaatilla , formaldehydiksi, joka voidaan havaita tavanomaisilla menetelmillä.
Katso myös
kirjallisuus
- Holger Menrad, Alex König: Alkoholipolttoaineet . Springer, Wien / New York 1982, ISBN 3-211-81696-8 .
- Liittovaltion tutkimus- ja teknologiaministeri (toim.): Autoteollisuuden ja tieliikenteen kehityslinjat . Tutkimusraportit 1977-1985, TÜV Rheinland, Köln.
- F. Asinger : Metanolin, kemikaalien ja energian raaka-aine . Akademie-Verlag, Berliini 1987, ISBN 3-05-500341-1 .
- GA Olah, A.Goeppert, GK Surya Prakash: Öljyn ja kaasun ulkopuolella: metanolitalous. Verlag Wiley-VCH ( rajoitettu esikatselu Google -teoshaulla ).
- Bernd Höhlein: Liikenteen uudet energialähteet: metanoli ja alkoholiseokset. Verlag Forschungszentrum Jülich, 1991, ISBN 3-89336-068-9 .
- VDI-kirja: Energiakäsikirja: Energian tuottaminen, muuntaminen ja käyttö. Springer Verlag, 2002, ISBN 3-540-41259-X .
- Klaus Weissermel , Hans-Jürgen Arpe : Teollinen orgaaninen kemia: tärkeitä raaka - aineita ja välituotteita. Wiley-VCH Verlag, 2003, ISBN 3-527-30578-5 , s. 30 ja sitä seuraavat.
- Martin Bertau , Heribert Offermanns, Ludolf Plass, Friedrich Schmidt, Hans-Jürgen Wernicke: Metanoli: Tulevaisuuden kemialliset ja energialähteet: Asingerin visio tänään. Verlag Springer, 2014, ISBN 978-3-642-39708-0 .
- Karl-Heinz Hochhaus: Vaihtoehtoiset polttoaineet merenkulussa. Julkaisussa: Schiffs-Ingenieur Journal. Nro 2/2017.
nettilinkit
- Metanolin oktaania lisäävä vaikutus bensiinissä (lähde Menrad, motorlexikon.de)
- Metanolin instituutti, Arlington (englanti).
- Pääsy metanoliin . Julkaisussa: P.J.Linstrom, W.G. Mallard (Toim.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69 . Kansallinen standardi- ja teknologiainstituutti , Gaithersburg MD .
Yksittäiset todisteet
- ↑ Merkintä metyylialkoholia vuonna CosIng tietokantaan EU: n komission, pääsee 28. joulukuuta 2020 mennessä.
- ↑ b c d e f g h i j k l m n o p q r s Merkintä metanolilla että GESTIS aine tietokanta IFA , pääsee 1. helmikuuta, 2016. (JavaScript vaaditaan)
- ^ Kirjoittajien yhdistys: Organikum . 19. painos. Johann Ambrosius Barth, LeipzigBerlinHeidelberg 1993, ISBN 3-335-00343-8 , s.445 .
- ↑ Merkintä metanolista. Julkaisussa: Römpp Online . Georg Thieme Verlag, luettu 1. kesäkuuta 2014.
- ↑ Hans Lohninger : Inorganische Chemie: Dipolmomente (taulukko) , inorganicik.chemie.vias.org, käyty 9. maaliskuuta 2021.
- ↑ David R. Lide (Toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, orgaanisten yhdisteiden fysikaaliset vakiot, s.3-3326.
- ↑ Merkintä metanolilla että luokitusten ja merkintöjen luetteloon on Euroopan kemikaaliviraston (ECHA), pääsee 1. helmikuuta 2016. Valmistajien ja jälleenmyyjien voi laajentaa yhdenmukaistettuun luokitukseen ja merkintöihin .
- ↑ Sveitsin tapaturmavakuutusrahasto (Suva): Raja-arvot - nykyiset MAK- ja BAT-arvot (haku 67-56-1 tai metanoli ), käytetty 13. syyskuuta 2019.
- ↑ David R. Lide (Toim.): CRC Handbook of Chemistry and Physics . 97. painos. (Internet-versio: 2016), CRC Press / Taylor ja Francis, Boca Raton, FL, lämpökemia, sähkökemia ja ratkaisukemia, s.5--26.
- ^ Metanoli Gelsenchemin verkkosivustolla 28. helmikuuta 2020.
- ↑ Virta metanoliin - pitkäaikainen varastointi ilmastonsuojelun kannalta välttämätön - Solar Energy Association Germany (SFV) - aurinkoenergia, aurinkosähkö, aurinkoenergia, tuulienergia, geoterminen energia, vesivoima, biomassajäämät ja sähkön varastointi energiansiirtoon. Haettu 8. syyskuuta 2019 .
- ↑ A. Gossauer: Biomolekyylien rakenne ja reaktiivisuus. Verlag Wiley-VCH, s.176 ( rajoitettu esikatselu Google -teoshaulla ).
- ^ A b G.A.Olah, A.Goeppert, GK Surya Prakash: Öljyn ja kaasun ulkopuolella: metanolitalous. Verlag Wiley-VCH, 2009, ISBN 978-3-527-32422-4 .
- ↑ S. Lee: metanoli synteesi tekniikka. CRC Press, 1990, ISBN 0-8493-4610-X .
- ^ JR Couper, OT Beasley, WR Penney: Kemian prosessiteollisuuden infrastruktuuri: toiminta ja taloustiede. Marcel Dekker kustantamo, 2000, ISBN 0-8247-0435-5 .
- ↑ Tietoja BASF: stä. Historia 1902–1924. (Ei enää saatavana verkossa.) BASF, arkistoitu alkuperäisestä 20. heinäkuuta 2012 ; luettu 6. syyskuuta 2018 .
- ↑ b B. Höhlein, Th. Grube, P. Biedermann, H. Bielawa, G. Erdmann, L. Schlecht, G. Isenberg, R. Edinger: Metanoli als Energieträger ( Memento 13. elokuuta 2016 Internet Archive ) (PDF-tiedosto; 5,5 Mt). Julkaisussa: Tutkimuskeskuksen kirjoitukset Jülich. Energiateknologiasarja. Osa 28, ISBN 3-89336-338-6 .
- ↑ T. Holst, A. Arneth, S. Hayward, A. Ekberg, M. Mastepanov, M. Jackowicz-Korczynski, T. Fribourg, PM Crill, K. Bäckstrand: BVOC-ekosysteemin virtausmittaukset Atmos-kosteikon suurilla leveysasteilla . Julkaisussa: Chem. Phys. 10, 2010, s. 1617-1634.
- ^ DJ Jacob, BD Field, Q. Li, DR Blake, J. de Gouw, Carsten Warneke, A. Hansel, A. Wisthaler, HB Singh, A. Guenther: Metanolin kokonaisbudjetti: Rajoitukset ilmakehän havainnoista. Julkaisussa: Journal of Geophysical Research . Osa 110, 2005; doi: 10.1029 / 2004JD005172 .
- ↑ CC von Dahl, M.Hävecker, R.Schlögl, IT Baldwin: Caterpillarin aiheuttama metanolipäästö: uusi signaali kasvien ja kasvinsyöjien vuorovaikutuksessa? Julkaisussa: The Plant Journal . Osa 46, 2006, s. 948-960; doi: 10.1111 / j.1365-313X.2006.02760.x .
- B a b c E.Kolb: Henkien tekniikka . Behr's Verlag, 2002, ISBN 3-86022-997-4 .
- ↑ Metanoli: kuinka turvallisia ovat ... (PDF) Elintarvikkeiden seurannan ja eläinten terveyden tutkintatoimistot Baden-Württemberg, käyty 6. syyskuuta 2018 .
- ↑ HG Classen, PS Elias, M. Winter: Elintarvikkeiden ainesosien ja lisäaineiden toksikologinen-hygieeninen arviointi. Behr's Verlag, 2001, ISBN 3-86022-806-4 .
- ^ W.Helferich, CK Winter: Ruokatoksikologia. CRC Press, 2000, ISBN 0-8493-2760-1 .
- ↑ L.Harvey -Smith, RJ Cohen: Suurten maserien löytäminen W3: ssa (OH). Julkaisussa: Tähtien muodostuminen turbulentissa ISM: ssä. (= Proceedings IAU Symposium. Nro 237). 2006, doi: 10.1017 / S1743921307002104 .
- ↑ ES Wirström1, CM Persson1, A.Hjalmarson1, JH Black, P.Bergman1, WD Geppert, M.Hamberg, E.Vigren: Havainnointirajoitukset tähtienvälisen metanolin muodostumiselle. Julkaisussa: Orgaaninen aine avaruudessa. (= Proceedings IAU Symposium. Nro 251). 2008, doi: 10.1017 / S1743921308021406 .
- ↑ Protoplaneettalevyjen Spitzer-spektrit osoitteessa caltech.edu
- ^ Ote Metanolin ja johdannaisten globaalista näkymästä 2000–2012. ( Memento 24. heinäkuuta 2012 web-arkistossa archive.today )
- ↑ Kiinan petrokemikaalit kukoistavat. (PDF; 99 kB) Dechema eV, helmikuu 2007, käyty 6. syyskuuta 2018 .
- ↑ b c d e f g h i F. Asinger: Metanoli, kemiallisten ja energian raaka-aineiden . Akademie-Verlag, Berliini 1987, ISBN 3-05-500341-1 .
- ↑ 5-prosenttinen ratkaisu ( muisto 29. marraskuuta 2014 Internet-arkistossa ) osoitteessa metanol.org, elokuu 2009.
- ^ M. Hennecke: Suunnittelutieto. Verlag Springer, Berliini 2007, ISBN 978-3-540-71851-2 .
- ↑ H. Daniel: Fysiikka: Mechanics, aallot, lämpö . Verlag de Gruyter, 1997, ISBN 3-11-015602-4 ( rajoitettu esikatselu Google- teoshaulla ).
- ↑ a b c d e f g h i Tekniset tiedot ja käyttöturvallisuustiedote metanolin käsittelystä ( Memento 26. elokuuta 2011 Internet-arkistossa ) (PDF-tiedosto; 578 kt)
- ↑ A. Topel: Chemistry and Physics Milk: luonnonmateriaalista - Raaka-aine - Food . Behr's Verlag, 2004, ISBN 3-89947-131-8 , s. 65 ( rajoitettu esikatselu Google- teoshaulla ).
- ↑ L. Bergmann, T. Dorfmüller, C. Schaefer: Kokeellisen fysiikan oppikirja: mekaniikka, suhteellisuusteoria, lämpö . Verlag de Gruyter, 1998, ISBN 3-11-012870-5 ( rajoitettu esikatselu Google- teoshaulla ).
- ^ S. Lee, JG Speight, SK Loyalka: Vaihtoehtoisten polttoainetekniikoiden käsikirja. CRC Press, 2007, ISBN 978-0-8247-4069-6 ( rajoitettu esikatselu Google-teoshaulla).
- ↑ NMR-002: näytelaitteet ja magneettinen herkkyys
- ↑ Langen kemian käsikirja. 10. painos. 1967, s. 1669-1674.
- ↑ a b c d Merkintä metyylialkoholista (kondensoituneen vaiheen lämpökemian tiedot). Julkaisussa: P.J.Linstrom, W.G. Mallard (Toim.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69 . National Institute of Standards and Technology , Gaithersburg MD, käyty 17. marraskuuta 2019.
- ↑ Langen kemian käsikirja. 10. painos. 1967, s. 1522-1524.
- ↑ Competition Science Vision , osa 3, nro 25, maaliskuu 2000 ( rajoitettu esikatselu Google-teoshaulla).
- ↑ D. Ambrose, CHS Sprake: termodynaamiset ominaisuudet Organic happiyhdisteistä. XXV. Alifaattisten alkoholien höyrynpaineet ja normaalit kiehumislämpötilat. Julkaisussa: J. Chem. Thermodyn. 2, 1970, s. 631-645.
- B a b L.Pauling: Kemiallisen sidoksen luonne. 3. painos. Verlag Chemie, Weinheim 1973, s.443.
- ↑ Metanolin tekniset tiedot ja turvallisen käsittelyn opas ( Memento 16. syyskuuta 2012 Internet-arkistossa ) (PDF-tiedosto; 1,6 Mt)
- ↑ KJ Tauer, WN Lipscomb: Kristallirakenteissa metanolin jäännös entropia ja dielektrinen poikkeama. Julkaisussa: Acta Crystallographica . 5, 1952, s. 606-612, doi: 10.1107 / S0365110X52001696 .
- ↑ alkoholit. (PDF; 303 kB) (Ei enää saatavilla verkossa.) Www.uni-tuebingen.de, arkistoitu alkuperäisestä 26. kesäkuuta 2013 ; Haettu 10. tammikuuta 2010 .
- ↑ EV Ivash, DM Dennison: Journal of Chemical Physics 21, 1953, s.1804
- ↑ S. Hauptmann: Reaktio ja mekanismi orgaanisessa kemiassa. Verlag Teubner, s. 61 ( rajoitettu esikatselu Google-teoshaulla).
- ^ Klaus Weissermel, Hans-Jürgen Arpe: Teollinen orgaaninen kemia: tärkeitä raaka -aineita ja välituotteita. Wiley-VCH Verlag, 2003, ISBN 3-527-30578-5 .
- ↑ GW Becker, D.Braun, L.Bottenbruch: Kunststoffhandbuch. 11 osaa 17 osassa, tilavuus 3/1, tekniset kestomuovit. BD 3 / osa 1, Verlag Hanser Fachbuch , 1992, ISBN 3-446-16368-9 .
- ↑ J. Buddrus: Fundamentals of orgaanisen kemian. Verlag Gruyter, 2011, ISBN 978-3-11-024894-4 .
- ↑ a b c d e http://www.metetan.org/Methanol-Basics/Resources/MMSA-Global-Methanol-Supply-and-Demand.aspx (linkki ei ole käytettävissä)
- ↑ Rectisol-prosessi ( Memento 16. kesäkuuta 2012 Internet-arkistossa )
- ↑ ICIS : Formaldehydin käyttötavat ja markkinatiedot
- ↑ Formaldehydi ( Memento , 27. elokuuta 2013 Internet-arkistossa ), MMSA: lta.
- ^ Formaldehydin käyttö- ja markkinatiedot. ICIS , käyty 9. tammikuuta 2010 .
- ↑ A. Behr : Alifaattinen välituotteita. Julkaisussa: Roland Dittmeyer, Wilhelm Keim , Gerhard Kreysa , Alfred Oberholz (toim.): Winnacker, Küchler. Kemian tekniikka: Prosessit ja tuotteet Osa 5: Orgaaniset välituotteet, polymeerit. WILEY-VCH Verlag, Weinheim, ISBN 3-527-30770-2 .
- B a b W.Keim , A.Behr , G.Schmitt : Teollisen kemian perusteet: tekn. Tuotteet ja prosessit. 1. painos. Salle, Frankfurt / Berliini / München 1986, ISBN 3-7935-5490-2 (Sauerländer, ISBN 3-7941-2553-3 ).
- ↑ Tutkimus hiilipohjaisen metanolin soveltuvuudesta kuljetuksen polttokennojärjestelmiin ( Memento 3. helmikuuta 2013 Internet-arkistossa ) (PDF-tiedosto; 766 kB)
- ↑ Virta metanoliin - pitkäaikainen varastointi ilmastonsuojelun kannalta välttämätön - Solar Energy Association Germany (SFV) - aurinkoenergia, aurinkosähkö, aurinkoenergia, tuulienergia, geoterminen energia, vesivoima, biomassajäämät ja sähkön varastointi energiansiirtoon. Haettu 8. syyskuuta 2019 .
- ^ Athanasios A. Tountas, Xinyue Peng, Alexandra V. Tavasoli, Paul N. Duchesne, Thomas L. Dingle: Kohti aurinkometanolia: menneisyys, nykyisyys ja tulevaisuus . Julkaisussa: Advanced Science . nauha 6 , ei. 8 , 2019, ISSN 2198-3844 , s. 1801903 , doi : 10.1002 / advs.201801903 , PMID 31016111 , PMC 6468977 (ilmainen kokoteksti).
- ↑ Katsaus metanolin käyttöön raketti- ja lentopolttoaineissa
- ↑ Tom B.Reed, RM Lerner: Metanoli: monipuolinen polttoaine välittömään käyttöön. Julkaisussa: Science . 182.4119, 1973, s. 1299 - 1304; doi: 10.1126 / tiede.182.4119.1299 .
- ↑ alkoholipolttoaine , umweltlexikon-online.de
- ↑ VOIMASSA METANOLILLA
- ↑ H. Heitland: Vaihtoehdot liikenteessä: arvioida niiden mahdollisuuksiin ja riskeihin avulla PC simulointimallien. Verlag Frank Timme, s. 65 ( rajoitettu esikatselu Google-teoshaulla).
- ↑ Francais Du Petrole (toim.): VII. Kansainvälinen symposium alkoholipolttoaineista. Editions Technip, ISBN 2-7108-0517-0 , s.277 ( rajoitettu esikatselu Google- teoshaulla ).
- ↑ S. Geitmann: Uusiutuvat energialähteet ja vaihtoehtoiset polttoaineet. Uusi energia tulevaisuuteen. Verlag Hydrogeit, 2005, ISBN 3-937863-05-2 .
- ↑ JJ Romm: Vetypuomi: halu ja todellisuus kilpailussa ilmastonsuojelun puolesta. Wiley-VCH Verlag, 2006, ISBN 3-527-31570-5 .
- ↑ B. Aldrich: ABC: t Afv: n oppaasta vaihtoehtoisiin polttoaineajoneuvoihin. Diane Pub, 1995, ISBN 0-7881-4593-2 ( rajoitettu esikatselu Google- teoshaulla ).
- ↑ M. Trzesniowski: kilpa- autotekniikka: perusteet, rakentaminen, komponentit, järjestelmät. Vieweg + Teubner kustantamo, 2008, ISBN 978-3-8348-0484-6 .
- ↑ Ulrike Schramm: SFC Energy ja Beijing Green Century Technologies allekirjoittivat kumppanuussopimuksen EFOY Pro -polttokennoista Kiinassa. Julkaisussa: Sijoittajat, lehdistötiedote. SFC Energy AG, 24. huhtikuuta 2018, luettu 18. toukokuuta 2018 .
- ↑ MTBE-tietolomake # 3 MTBE: n ja etanolin käyttö ja jakelu (PDF-tiedosto; 20 kB)
- ↑ Biodieselin tuotantokapasiteetti Saksassa
- ↑ K. Liu, C. Song, V. Subramani: Vedyn ja synteesikaasun tuotanto- ja puhdistustekniikat: Hiilivetyjen käsittely H 2 -tuotannossa. Verlag John Wiley & Sons, 2010, ISBN 978-0-471-71975-5 , s.510 ja sitä seuraavat.
- ↑ Niin kauan kuin R. Błaszkowski, Rutger A. van Santen: CC- sidoksen muodostumisen teoreettinen tutkimus metanoli-bensiini-prosessissa. (PDF-tiedosto; 222 kt). Julkaisussa: J. Am. Chem. Soc. 119, 1997, sivut 5020-5027; doi: 10.1021 / ja963530x .
- ↑ Michael Seiler, Udo Schenk, Michael Hunger: Metanolin muuttuminen hiilivedyiksi zeoliitilla HZSM-5 tutkittu in situ MAS NMR -spektroskopialla virtausolosuhteissa ja online-kaasukromatografialla. Julkaisussa: Catalysis Letters . 62, 1999, s. 139-145; doi: 10.1023 / A: 1019086603511 .
- ↑ ThyssenKrupp Base: Metanoli ( Memento 8. heinäkuuta 2012 alkaen verkkoarkistoarkistossa. Tänään )
- ↑ MTBE polttoaineissa , EPA.gov.
- ↑ MTBE Ban Kaliforniassa (PDF-tiedosto; 674 kt), julkaisulta GAO.gov.
- Methyl Metyyli-tertiäärisen butyylieetterin (MTBE) ympäristövaikutus, erityisesti vesiensuojelu , Umweltbundesamt.de.
- ↑ a b Vuotuinen teknisen edistymisen raportti hankkeelle, jonka otsikko on ”DME-dieselpolttoaineen sekoitusominaisuuksien vaikutus dieselpolttoaineen ruiskutusjärjestelmiin” 16. toukokuuta 2003 .
- ↑ Patentti US 4341069 : Menetelmä sähkön tuottamiseksi pyynnöstä.
- ↑ Ympäristö, energia ja liikenne (PDF-tiedosto; 1,1 Mt) EU: n tutkimustulokset kaupunki- ja alueellisen liikenteen alalla.
- ^ DME, puhdas polttoaine liikenteessä , Kansainvälisessä DME-yhdistyksessä.
- ↑ BioDME. BioDME, käyty 6. syyskuuta 2018 .
- ↑ Patentti US 52264553 : Menetelmä yhtenäisten polymeeripallojen, komposiittihiukkasten ja polymeerikapseloitujen hiukkasten muodostamiseksi.
- ↑ BEA Jacobs: Lietekuljetusjärjestelmien suunnittelu. Verlag Elsevier, s. 254 ( rajoitettu esikatselu Google-teoshaulla).
- ↑ Prosessi aromaattisten hiilivetyjen erottamiseksi seoksista ( Memento 28. tammikuuta 2012 Internet-arkistossa ) (PDF-tiedosto; 424 kB).
- ↑ http://www.eawag.ch/about/haben/homepages/buergmhe/Stoffwechsel08/Stoffwechsel_Termin_6-2009.pdf (linkki ei ole käytettävissä).
- ↑ H.Kloosterman, JW Vrijbloed, L.Dijkhuizen (2002): Nudix-hydrolaasiproteiinin molekulaarinen, biokemiallinen ja toiminnallinen karakterisointi, joka stimuloi nikotinoproteiinialkoholi-dehydrogenaasin aktiivisuutta. Julkaisussa: J Biol Chem . 277 (38), sivut 34785-34792. PMID 12089158 ; PDF (ilmainen koko tekstin käyttö).
- ↑ Georg Fuchs (Toim.), Hans. G. Schlegel (Kirjoittaja): Yleinen mikrobiologia. 8. painos. Thieme Verlag, Stuttgart 2007, ISBN 978-3-13-444608-1 , s.311 .
- ↑ Cleanthis J. Israelidis: Ravinto - yksisoluinen proteiini, kaksikymmentä vuotta myöhemmin. (Ei enää saatavana verkossa.) Www.biopolitics.gr, arkistoitu alkuperäisestä 7. lokakuuta 2011 ; luettu 6. syyskuuta 2018 .
- ↑ Metanoli-d1 : n ulkoiset tunnisteet tai tietokantalinkit : CAS-numero:1455-13-6 , EY-numero: 215-933-0, ECHA: n tietokortti: 100.014.485 , PubChem : 123113 , ChemSpider : 109729 , Wikidata : Q82908334 .
- ↑ Metanoli-d3 : n ulkoiset tunnisteet tai tietokantalinkit : CAS-numero:1849-29-2 , EY-numero: 217-435-9, ECHA InfoCard: 100.015.851 , PubChem : 123132 , ChemSpider : 109747 , Wikidata : Q83041789 .
- ↑ Metanoli-d4 : n ulkoiset tunnisteet tai tietokantalinkit : CAS-numero:811-98-3 , EY-numero: 212-378-6, ECHA Konekortti: 100.011.253 , pubchem : 71568 , ChemSpider : 64640 , wikidata : Q1100804 .
- ↑ R. Kavet, KM Nauss: Inhaloitujen höyryjen toksisuus metanoli. (PDF-tiedosto; 2,2 Mt). Julkaisussa: Kriittiset arvostelut toksikologiassa . 1990.
- ^ GF Fuhrmann: Toksikologia luonnontieteilijöille. Vieweg + Teubner Verlag, 2006, ISBN 3-8351-0024-6 , s.269 .
- ^ B. Madea, B. Brinkmann: Oikeuslääketieteen käsikirja, 2. osa. Verlag Springer, ISBN 3-540-66447-5 , s. 523 ( rajoitettu esikatselu Google-teoshaulla).
- ^ PU Fechner, KD Teichmann: Lääketieteellinen silmähoito: perusteet ja käytäntö. Georg Thieme Verlag, 2000, ISBN 3-13-117924-4 , s.516-517.
- ↑ Metanolimyrkytys - tehokas hoito formepitsolilla - GFI
- ↑ Euroopan parlamentin ja neuvoston asetus (EY) N: o 110/2008, annettu 15 päivänä tammikuuta 2008, tislattujen alkoholijuomien määritelmästä, kuvauksesta, esittelystä ja merkinnöistä sekä tislattujen alkoholijuomien maantieteellisten merkintöjen suojasta ja asetuksen (ETY) N: o 1576/89
- ↑ Stuart A.Schneck: metyyli, alkoholi. (PDF-tiedosto; 763 kt). Julkaisussa: Kliinisen neurofysiologian käsikirja. Vuosikerta 36, 1979, sivut 351-360.
- ↑ Viini: Upea idea . Julkaisussa: Der Spiegel . Ei. 16 , 1986, s. 130-132 ( verkossa - 14. huhtikuuta 1986 ).
- ^ Euroopan kemikaalivirasto (ECHA): Aineiden arviointiraportti ja päätelmäasiakirja .
- ↑ päivitettävän yhteisön toimintasuunnitelman ( säännöllisesti päivitettävän ) ja Euroopan kemikaaliviraston (ECHA): Metanoli , pääsee maaliskuun 26. päivänä 2019.
- ↑ G. Blumenthal, D. Linke, S. Vieth: Kemia: Perustiedot insinööreille. Vieweg + Teubner kustantamo, 2006, ISBN 3-519-03551-0, s.242 .
- ^ PJ Baugh: Kaasukromatografia: käyttäjälähtöinen esitys . Publisher Vieweg ( rajoitettu esikatselu Google- teoshaulla ).
- ↑ Metanolin kemialliset ominaisuudet ( Memento, 10. maaliskuuta 2010 Internet-arkistossa )