D -aminohapot
D -aminohappoja ovat luokan aminohappoja , joissa funktionaaliset ryhmät - karboksi (-COOH) ja amino (NH 2 ) - α-asemassa in D - konfiguraatiossa läsnä. Ne ovat peilikuva isomeerit L -aminohapoista.
D- aminohappoa ovat edustettuna kaikissa tunnetuissa biologisten järjestelmien paljon harvemmin kuin niiden L - isomeerit , jotka ovat tärkeitä rakennuspalikoita elämän muodossa 23 proteinogeenisiä aminohappoa . Tämän vuoksi oletettiin pitkään, että D- aminohapoilla ei ole lainkaan biologisia toimintoja ja ne ovat "luonnotonta". Tämä kuva on muuttunut 1990 -luvun alusta. Nykyään tiedämme, että D- aminohappoja ovat esimerkiksi bakteerien tuottamat peptidiantibiootit ja erilaiset kasvit, kuten riisi, valkosipuli ja herneet.
Jotkut D -aminohapot täyttävät myös tärkeitä fysiologisia toimintoja ihmisillä . Että keskushermostoon erityisesti , ne ovat D - seriini ja D - asparagiinihappo . D- aminohapoilla näyttää olevan myös rooli tietyissä sairauksissa , kuten skitsofreniassa . Tämä tutkimusala on verrattain uusi, ja monet vapaiden D- aminohappojen ja peptideihin tai proteiineihin sitoutuneiden toiminnot ovat edelleen suurelta osin tuntemattomia tai niitä ei ymmärretä.
Avulla kromatografisten analyysimenetelmiä, D- aminohappoja voidaan havaita useita elintarvikkeita ja organismeja . Yksi sovellus tässä on aminohappojen dating fossiilien iän määrittämiseksi .
Nykyisen tieteen mukaan vapaat D -aminohapot ovat ihmisille vaarattomia määrinä, joita nautitaan päivittäin ruoan kanssa. Teknisesti tuotettuja D- aminohappoja käytetään rakennuspalikoina (puolisynteettisten) antibioottien valmistukseen ja ne ovat kemiallisesti sitoutuneita komponentteja moniin muihin lääkkeisiin .
Perusasiat
Kiraalisuus

Lukuun ottamatta glysiiniä , yksinkertaisinta aminohappoa, kaikissa proteinogeenisissä aminohapoissa on vähintään yksi hiiliatomi, joka sisältää neljä eri atomia tai atomiryhmää ( substituentteja ). Paikallisesti katsottuna nämä substituentit vievät tetraedrin neljä kulmaa . Tämä järjestely aiheuttaa epäsymmetrian, joka johtaa kahteen eri mahdollisuuteen korvata substituentit. Nämä kaksi muotoa, joita kutsutaan enantiomeereiksi tai peilikuva -isomeereiksi, käyttäytyvät kuin kuva ja peilikuva. Epäsymmetrinen hiiliatomi muodostaa ns. Stereokeskuksen . Enantiomeerien kuvaa ja peilikuvaa ei voida tehdä samaan. Tämä koskee myös jokapäiväisen elämän esineitä, joissa ei ole pyörivää peiliakselia . Kädet ovat esimerkki tästä. Vasen ja oikea käsi ovat kuin kuva ja peilikuva, mutta niitä ei voida yhdistää linjaan. Erot oikean ja vasemman käden välillä tulevat erityisen selväksi, kun ne ovat vuorovaikutuksessa muiden kiraalisten (kreikkalainen sana "käsi") järjestelmien kanssa. Esimerkiksi, kun oikea käsi ravistaa toista oikeaa tai vasenta kättä tai yrittää laittaa "väärän" käsineen. Kiraalisissa ympäristöissä erot molekyylin enantiomeereissä ovat myös ilmeisiä.
Saksan kemian Nobel -palkinnon saaja Emil Fischer kehitti Fischer -projektion , jolla kiraalisen kemiallisen yhdisteen tilarakenne voidaan kartoittaa selvästi kahteen ulottuvuuteen. Hän valitsi vertailuaineen ( glyseraldehydin ). Fischer -projektion sääntöjen mukaan happoryhmä ( karboksiryhmä ) piirretään aina yläpuolelle ja aminohappoja erottava tähde R aina alle. Jos aminoryhmä on vasemmalla tässä projisointimenetelmässä ( lat. Laevus ), puhutaan L -aminohaposta . Kirjain L on sijoitettu aminohapon nimen eteen pienillä korkkeilla ; esimerkiksi L - seriini . Jos aminoryhmä on Fischer -projektion oikealla puolella (latinaksi: dexter = 'oikea'), se on D -aminohappo. Adjektiivit vasemmalle ja oikealle liittyvät vain Fischer -projektion mukaisesti esitettyyn kokoonpanoon .
In osalta niiden fysikaalisten ominaisuuksien , kuten sulamispiste , tiheys , liukoisuus veteen ja muihin liuottimiin ja isoelektrisen pisteen , D - ja L - aminohapot ovat täysin identtisiä. Jopa akiraalisessa ympäristössä, eli ympäristössä, jossa ei ole muita kiraalisia molekyylejä, ne käyttäytyvät samalla tavalla yhtä poikkeusta lukuun ottamatta: kaksi enantiomeeriä kiertävät lineaarisesti polarisoidun valon polarisaatiotasoa samoissa olosuhteissa (pitoisuus, lämpötila, pH -arvo) , Liuottimet jne.) Vaikuttavat samaan, mutta eri suuntiin. Jos käännät valoa myötäpäivään, puhutaan myötäpäivään tai (+) - muotoon. Vastapäivään muotoa kutsutaan vasenkätiseksi tai (-) muodoksi. Aminohappojen pyörimisnopeudella ja -suunnalla ei ole juurikaan merkitystä päivittäisessä käytännössä. Kokoonpano - D - tai L on paljon tärkeämpää . Aminohapon pyörimissuunta (vasen tai oikea) on täysin riippumaton aminohapon kokoonpanosta. Tämä esitetään kirjallisuudessa usein väärin. Usein termiä "kiertävät aminohapot" käytetään, kun viitataan L -aminohappoihin . Itse asiassa pyörimissuunta ja pyörimissuunta riippuvat suuresti ulkoisesta ympäristöstä. Esimerkiksi, aminohappo L - leusiini on tietyssä kulmassa ja kierto on + 15,1 ° (= vastapäivään) huoneenlämpötilassa kuusi molaarista suolahappoa ja tietyssä kulmassa ja kierto on -10,8 ° (= myötäpäivään) on neutraalilla vedellä. Toisaalta 3-molaarisessa kaustisessa soodassa se on vastapäivään 7,6 °: ssa.
Seosta, jossa on 50% D- ja 50% L -aminohappoja, kutsutaan rasemaatiksi . Rasemaatteja syntyy muun muassa tavanomaisissa teknisissä aminohappojen synteeseissä. Ne ovat optisesti inaktiivisia, eli ne eivät pysty kiertämään polarisoidun valon värähtelytasoa. Verrattuna puhtaisiin enantiomeereihin rasemaateilla on toisinaan erilaisia fysikaalisia ominaisuuksia (esimerkki: sulamispiste ), mutta jatkuvasti erilaisia fysiologisia ominaisuuksia.
Nimeämiskäytännöt ja nimikkeistö
Fischerin projektio on edelleen edullinen aminohappojen ja sakkaridien projektiojärjestelmä. Lisäksi aminohappoja varten käytetään CIP-järjestelmää ( Cahn-Ingold-Prelog ), joka kuvaa kiraalisten molekyylien absoluuttista kokoonpanoa. CIP -järjestelmän mukaan useimmat proteinogeeniset L -aminohapot ovat ( S ) -aminohappoja. Heidän peilikuvillaan, D -aminohapoilla, on lähes aina ( R ) -konfiguraatio. Poikkeuksia ovat L - kysteiini , L - kystiini ja L - selenokysteiini , koska rikki ja seleeni on korkeampi prioriteetti kuin happi mukaan CIP nimikkeistön . Nämä kolme L -aminohappoa ovat ( R ) -konfiguraatiossa. Sitä vastoin kolmella vastaavalla D -aminohapolla on ( S ) -konfiguraatio.
In aminohapposekvenssit , The D -aminohappoja on kolmen kirjaimen koodin edeltää pieniä pääoman D (pieniä kirjaimia).
Käyttämällä esimerkkiä heptapeptidi -dermorfiinista
H-Tyr-D-Ala-Phe-Gly-Tyr-Pro-Ser-NH2
Että yksi -kirjain koodi , D -aminohappoja on varustettu pieni kirjain L -aminohapoista.
Dermorfiiniesimerkissä:
YaFGYPS-NH2
Luonnollinen esiintyminen ja löytöhistoria
D- aminohapot ovat paljon harvinaisempia luonteeltaan kuin isomeeristen L- aminohappoja, joissa proteinogeenisiä aminohappoja - yhdessä nukleiinihappojen - ovat perusrakenneosia elämän . Samanlainen epäsymmetria esiintyy kahden tyyppisten enantiomeerien esiintymisessä hiilihydraattien tapauksessa . Tässä D -muoto, esimerkiksi D - glukoosi , on "luonnollinen" kokoonpano. On arvioitu, että D- glukoosia on maapallolla 10 15 kertaa enemmän kuin L- glukoosia. Aminohapoista ei ole vielä luotettavia arvioita.
Pitkään oletettiin, että vain L- aminohapot valittiin peptidien ja proteiinien muodostamiseksi evoluution aikana. 1980 -luvulta lähtien parannetut analyysimenetelmät ovat johtaneet tämän oletuksen tarkistamiseen. D- aminohappoja on havaittu yhä useammissa elävissä olennoissa , joten niiden jakautuminen ja esiintymistiheys ovat huomattavasti suuremmat kuin alun perin oletettiin. Uudemmassa kirjallisuudessa D -aminohappoja pidetään siksi kasvien ja elintarvikkeiden yleisenä osana. Mutta jopa korkeammissa elävissä olennoissa, mukaan lukien ihmiset, D- aminohapot ovat mukana tärkeissä fysiologisissa prosesseissa, joista joitakin ei vieläkään suurelta osin ymmärretä.
Elämän kehittyminen maan päällä edellytti homokiraalisuutta eli aminohappojen ja muiden elämän rakennuspalikoiden yhtenäistä kokoonpanoa. Itsensä replikointi ei voi tapahtua raseemisessa ympäristössä . Aminohappojen kahden isomeerisen muodon esiintymistiheyden äärimmäisen epätasapainon ensisijaisesta syystä on useita hypoteeseja . Siitä kohdasta, jossa ensimmäinen pieni epätasapaino D- ja L -kokoonpanon välillä esiintyi, ollaan laajalti yksimielisiä . Tästä eteenpäin kiraalista monistusta - eräänlaista itseään vahvistavaa vaikutusta, joka johtaa kemiallisessa reaktiossa enantiomeerisen muodon edelleen lisääntymiseen, joka oli aiemmin lievässä ylimäärässä - voidaan selittää enantiomeerisen muodon äärimmäiselle rikastumiselle. hyvin. On kuitenkin täysin epäselvää, miten peilisymmetria rikkoutui , mikä suurella todennäköisyydellä johti aluksi lievään ylimääräiseen aminohappojen L -kokoonpanoon paljon ennen elämän alkamista maan päällä . Mahdollisia syitä tauko peilisymmetrisesti ovat muun muassa rikkoo pariteetti aikana β-hajoamisen ( Vester-Ulbrichtin hypoteesi ) ja ”inokulaatio ensiarvoisen keittoa ” ulkoavaruuden L- aminohapon ylilyöntejä. Jälkimmäistä teoriaa tukee se tosiasia, että esimerkiksi Murchisonin meteoriitissa voitaisiin havaita ylimäärä ei-proteinogeenisten aminohappojen 2-amino-2,3-dimetyylipentaanihapon ja isovaliinin vastaavasta L- enantiomeeristä . Murchisonin meteoriitissa L- isovaliinin ylimäärä oli noin 18,5 prosenttia ja Orgueil- meteoriitissa noin 15,2 prosenttia. Tämä ylimäärä syntyi mahdollisesti pyöreästi polarisoidusta UV -säteilystä , joka - kokeellisesti vahvistettuna - tuhoaa ensisijaisesti D -aminohapot.
Muodostuminen D -aminohappojen rasemisoinnilla
Suuremmat määrät D -aminohappoja voivat johtua rasemoitumisesta L -aminohapoista. Aminohapon rasemaatin, eli seoksen, joka sisältää 50% D- ja 50% L -aminohappoa, muodostaminen on termodynaamisesti edullista. Entalpia säilyy ennallaan, mutta korkeampi ”aste häiriö” johtaa kasvuun entropia , mikä tarkoittaa sitä, että vapaa entalpia Δ G järjestelmä vähentää. Arvo 25 ° C: ssa noin -1,6 kJ / mol . Korkeammat lämpötilat johtavat suurempaan vapaan entalpian vapautumiseen, minkä vuoksi rasemoituminen nopeutuu merkittävästi. Puoli-elämän rasemoitumiselta, joka määritellään aika, jossa ee-arvo laskee 100-50%, ei riipu ainoastaan lämpötilasta, vaan myös pH , aminohappo, liuottimen tai kosteuden ja läsnä ja katalyyttejä . Jatkuvissa olosuhteissa rasemoituminen voidaan laskea hyvissä ajoin tai päinvastoin tutkitun näytteen ikä voidaan päätellä rasemoitumisasteesta. Tätä prosessia, joka tunnetaan nimellä aminohappojen dating , voidaan käyttää fossiilisten näytteiden, mutta myös elävien organismien iän määrittämiseen. Kaikki prosessit, jotka estävät aminohappojen rasemoitumista sairaissa organismeissa, päättyvät kuolemaan. Elämä on taistelua entropiaa vastaan, ja viimeistään kuoleman myötä rasemoitumista estävät prosessit päättyvät. Joissakin kudoksissa, joissa proteiiniaineenvaihdunta on erittäin vähäistä , tämä prosessi alkaa kudoksen rakentamisen jälkeen. Esimerkki tästä on kollageeni on haramasluun hampaiden tai silmän linssin . Hampaiden suhteellisen vakio lämpötila- ja pH -arvot mahdollistavat myös elävän organismin iän määrittämisen noin ± 4 vuoden tarkkuudella asparagiinihapon rasemoitumisasteen avulla . Menettelyä käytetään muun muassa oikeuslääketieteessä . Esimerkkinä tehokkuus Tämän menetelmän tutkimuksia, jotka tehtiin vuonna 1996 luiden keisari Lothar von Supplinburg (1075-1137). Vaimoonsa Richenzaan ja ylpeisiin Heinrichiin verrattuna Lotharilla todettiin olevan paljon korkeampi rasemoitumisaste, joka vastasi noin 9000 vuoden ikää. Toisaalta kahden vertailunäytteen rasemoitumisaste vastasi erittäin hyvin niiden noin 850 vuoden ikää. L -asparagiinihapon rasemoitumisaste mitattiin kaikissa kolmessa tapauksessa . Lotharin korkea rasemoitumisaste johtuu hänen kuolemansa erityisolosuhteista. Hän kuoli lähellä Breitenwang vuonna Tirolissa , noin 700 kilometrin päässä hänen pääkonttori Königslutter am Elm . Suojellakseen ruumistaan hajoamiselta ennen pitkää kuljetusta ruumista käsiteltiin "saksalaisen tavan" ( mos teutonicus ) mukaisesti. Lotharin ruumis keitettiin, liha poistettiin luista ja luut siirrettiin Königslutteriin. Kiehumisen seurauksena 859 vuotta myöhemmin mitattu L- asparagiinihappo rasmisoitui paljon voimakkaammin kuin vaimon ja vävyn normaalisti haudatuissa ruumiissa. Rasemisointiasteen avulla kypsennysaika voidaan määrittää noin kuudeksi tunniksi.
Hiukset on noin 5300 vuotta vanha ruumis on miestä iältään Tisenjoch , joka tunnetaan paremmin nimellä " Ötzi ", 37%: lla hydroksiproliini on vuonna D konfiguraatiossa. 3000 -vuotiaalla muumialla 31%, keskiajan hiuksilla (noin 1000 vuotta vanhoilla) 19%ja tuoreilla hiusnäytteillä 4%.
Proteiinien L- aminohapot voivat myös rasistua lämpötilan ja äärimmäisten pH-arvojen vaikutuksesta valmistettaessa ruokaa . Yksittäiset aminohapot ratsioituvat eri nopeuksilla. Rasemoitumisnopeus on vahvasti riippuvainen vastaavan aminohapon sivuketjusta ja sen läheisyydessä olevista aminohapoista. Elektronia vetävät ryhmät helpottavat a-C-atomin protonointia, mikä helpottaa rasemoitumista. Tämä koskee esimerkiksi seriiniä ja asparagiinihappoa. Lisäksi steerisillä vaikutuksilla on oma roolinsa. Asparagiini ja asparagiinihappo rasemoituvat erityisen helposti, jos peptidisekvenssi sisältää glysiiniä välittömässä läheisyydessä. Sitten voi muodostua syklinen sukkinimidi, joka termodynaamisesti suosii voimakkaasti epimerisaatiota. Alhaisilla pH -arvoilla, esimerkiksi kuuden molaarisen suolahapon kohdalla, asparagiinihappo rasemoituu voimakkaimmin. Proliini ja glutamiinihappo rasemoituvat paljon hitaammin , kun taas isoleusiini , valiini , seriini ja treoniini rasemoituvat hyvin vähän näissä olosuhteissa . Sitä vastoin seriini rasistuu nopeimmin yhdessä molaarisessa natriumhydroksidiliuoksessa, jota seuraa asparagiinihappo, fenyylialaniini , glutamiinihappo ja valiini.


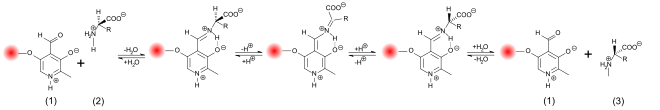
Emäksen ja hapon katalysoima rasemisaatio vaatii melko rajuja reaktio-olosuhteita, jotta täydellinen rasemoituminen saadaan muutamassa tunnissa. Sitä vastoin entsyymikatalysoitu rasemisaatio biologisissa järjestelmissä tapahtuu paljon nopeammin ja hyvin lievissä olosuhteissa - neutraalilla pH -alueella ja huoneen tai kehon lämpötilassa. Rasemaasit katalysoivat deprotonoitumista aminohapon a-C-atomissa. Tässä asemassa vetyatomi on vain erittäin heikosti hapan. Happamuus vakio protonoidun muodon pKa : n arvo ≈21 ja isoelektrisen pisteen kanssa ≈29 vielä heikompi. Useimmissa rasemaaseissa pyridoksaalifosfaatti (PLP) helpottaa huomattavasti protonin halkeamista . Näiden entsyymien aktiivisessa keskuksessa PLP sitoutuu lysiinitähteeseen . L -aminohapon aminoryhmä sitoutuu PLP: n aldehydiryhmään ja muodostaa siten Schiff -emäksen (aldimiini). Kuten elektrofiilisen katalyytti, PLP vetää elektroneja päässä α-C-atomi aminohapon kautta aromaattinen rengas , joka deprotonates paljon helpommin. Lisäksi jäljellä oleva anioni stabiloidaan mesomeerinä . Uudelleenprotonointi ja veden lisääminen vapauttaa sitten rasemoituneen aminohapon reaktiotuotteena Schiff -emäksen hydrolyysin kautta.
On myös PLP-riippumattomia rasemaaseja, joiden aktiivisessa keskuksessa kahden kysteiinin tioliryhmät katalysoivat protonaatiota. In kahden emäksen mekanismi, joka on deprotonoitu tiolaatti (RS - ) aluksi vie protonin α-C-atomin, joihin kuuluvat mm. Toisen kysteiinin tioliryhmä on sitten vastuussa uudelleenproto- noinnista. Nämä entsyymikatalysoidut rasemoitumisprosessit tuottavat suurimman osan D -aminohapoista organismeissa.
Peptidiantibiootit ja muut luontaista alkuperää olevat peptidilääkkeet

Suuri määrä peptidiantibiootteja koostuu D- aminohapoista. Peptidiantibiootit ovat luonnollisia tuotteita , jotka valmistetaan prokaryooteilla käyttämällä ei-ribosomaalista peptidisynteesiä . Farmakologisesti erittäin tärkeä ryhmä penisilliinien sisältää oleelliset rakennuspalikka D - penisillamiini , ei-Proteinogeeniset α-aminohappo. Polymyksiinit (polymyksiini B1 D -fenyylialaniini) ja aktinomysiinit ( D -valiinin) ovat myös koostuu D -aminohapoista. Basitrasiinia muodostettu bakteerien lajien Bacillus subtilis koostuu, muun muassa, on D -asparagiinihappo, glutamiinihappo, ornitiini ja -fenyylialaniini. BY Streptomyces fulvissimus tuotettu valinomysiiniä sisältää D- valiini ja että Bacillus circulansin muodostettu circulin ( D -leusiinin). Myös fungisporiini ( D -fenyylialaniini ja D -valiini), gramisidiini ja tyrosidiini (molemmat D -fenyylialaniini), malformiini C ( D -leusiini ja D -kysteiini), mykobasilliini ( D -asparagiinihappo ja D -glutamiinihappo) ovat peptidiantibiootteja, joilla on D -aminohapot.
Immuunivastetta siklosporiinia erittyy mukaan putkimainen sienet , kuten Tolypocladium inflatum , sisältää D -alaniinia. In isopenisilliini N on D valiini mukana.
Sykloseriini , jota käytetään tuberkuloosin hoitoon ja jolla on suhteellisen yksinkertainen kemiallinen rakenne , on valmistettu streptomyseteistä , kuten Streptomyces garyphalus , D -seriinistä,
D -aminohapot ja D -aminohappoja sisältävät peptidit

Pitkään oletettiin, että vain yksi aminohappo -enantiomeeri, nimittäin L -muoto, on vallitseva luonnossa . D- aminohappoja pidettiin "laboratoriotuotteina" (järjestelmästä riippuvaisina virheinä) ja luokiteltiin "luonnoton isomeereiksi" aina 1960-luvulle asti. Termi "luonnoton aminohapot" löytyy edelleen nykyään D- aminohapoista .

D -aminohappooksidaasit - entsyymit ilman substraattia?
Vuonna 1933, saksalainen lääkäri, kemisti ja myöhemmin Nobelin fysiologian tai lääketieteen Hans Adolf Krebs havaittu entsyymi D - aminohappo-oksidaasia ja kuvattu sen tarkemmin kaksi vuotta myöhemmin. Krebs toteaa, että "ei-luonnossa esiintyvät" D- aminohapot puhdistetun tuoreen sianlihan munuaisen tai maksan läsnä ollessa deaminoituvat merkittävästi nopeammin kuin "luonnolliset" L- isomeerit . Kohdennetulla estämisellä , esimerkiksi 1 -oktanolilla , hän pystyi deaktivoimaan soseen sisältämän L -aminohappooksidaasin ja siten saavuttamaan, että vain D -aminohapot deaminoitiin valikoivasti . Elimissä käytetystä syövästä tai sen uutteista päätettiin kaksi aminohappooksidaasia, jotka olivat L- ja D , -Aminosäureoxidasen, joissa kussakin on valikoivasti L- tai D -aminohappoja substraattina . Krebs oli yllättynyt siitä, että on olemassa entsyymi, jonka substraattina on vain "ei-luonnollisia aineita". Hän kuitenkin huomautti, että Felix Ehrlich vuonna 1914, Edmund Oskar von Lippmann vuonna 1884 ja Sigmund Fraenkel vuonna 1923/24 kuvailivat D -aminohappojen satunnaista esiintymistä luonnossa. D -alaniini, jonka E. Winterstein ja hänen kollegansa vuonna 1913 erottivat boletus -sienistä ( Boletus edulis ) , oli yksi näistä varhaisista ennätyksistä.
D -aminohapot kasveissa
Kasveissa D- aminohapot voidaan havaita sekä vapaassa muodossa että peptidiin sitoutuneessa muodossa. Ne ovat usein muodossa N - malonyyli - tai N - asetyyli - johdannaiset kasvien sisältämät. Esimerkiksi 40% auringonkukan ( Helianthus annuus ) juuren alaniinista on D -kokoonpanossa. D -alaniinia, ja dipeptidi D -Ala- D -Ala löytyy eri heinäkasvien; niin myös riisissä ( Oryza australiensis ). Noin 10% riisin seriinistä on läsnä D -enantiomeerinä. Sen tuottaa itse kasvi seriinirasemaasin avulla. Tätä entsyymiä vastaava geeni on Oryza sativa ssp. Japonica cv. Nipponbare kromosomissa 4. D- aminohappoja on havaittu pienemmissä pitoisuuksissa useissa kasveissa, joita käytetään elintarvikkeena. Näitä ovat esimerkiksi herneet ( Pisum sativum ), valkosipuli, erilaiset kaalit ja hedelmät. Vapaan ja peptidi D -aminohapon toiminta kasveissa on edelleen suurelta osin epäselvä.

Bakteereja ja D -aminohappoja
Ennen vapaan D -mikrobiperäisen alkuperän havaitsemista tunnistettiin sarja yhdisteitä -aminohappoja D -aminohappoja. Esimerkiksi , bentsyylipenisilliini , joka oli muodostunut in muottiin viljelmissä ja oli ensimmäinen penisilliini on löydetty mukaan Alexander Fleming 1928, sisältää D -penisilliiniamiinista (= 3-merkapto- D- valiini) on olennainen osa . Biokemisti Esmond E. Snell huomannut 1943 kokeissa viljelmät ja Streptococcus faecalis ja Lactobacillus casei , että pyridoksiini (vitamiini B- 6 ) kasvuun tarvittavat välttämättömät näiden bakteerikantoja voidaan korvata kokonaan D -alaniinia ravinteena. Hän havaitsi myös, että D -alaniini oli merkittävästi voimakkaampi kuin L -alaniini. Kun se oli sitten mahdollista havaita suuria määriä D -alaniinia on peptidoglykaaneja - nämä ovat biopolymeerit , jotka antavat soluseinä bakteerien niiden vahvuus - se oli selvää, mitä solut tarvitsevat tätä "luonnoton" aminohappo. Sisällyttäminen D -alaniini, ja erityisesti D- glutamaattia, estää entsymaattisen jakautuminen peptidoglykaanien mukaan peptidaasien . Mielenkiintoista on, että juuri tämä "suojaseinä" , joka on valmistettu D- aminohapoista, on hyökkäyskohta β-laktaamiantibiooteille , kuten penisilliinille. Nämä antibiootit estävät D-alaniinitranspeptidaasi- entsyymiä , jota esiintyy vain bakteereissa ja joka katalysoi peptidoglykaanien silloittumista , erityisesti D- alaniinin kautta . Vuonna 1951, Irwin Clyde Gunsalus ja Willis A. Wood eristetty alaniinirasemaasia päässä Streptococcus faecalis , entsyymi, joka katalysoi rasemisointi luonnollisen L -alaniini osaksi isomeeriset D -alaniinia. ALR -geeni, joka koodaa alaniinirasemaasia, on läsnä kaikki bakteerit. Alaniinirasemaasin avulla muodostettu D -alaniini on välttämätön peptidoglykaanien synteesille lähes kaikissa bakteereissa. Lisäksi D -alaniini ja D -glutamiinihappo, tiettyjä jännitteitä ja enterokokkien myös sisältää D -seriini soluseinään. D -seriini muodostaa D -Ala- D -Ser-dipeptidin kanssa D -alaniinia on C-terminaalisessa päässä , joka on vastuussa vastus näiden bakteerikantojen glykopeptidiantibiootit , kuten vankomysiini.
D -aminohapot sienissä
Niin sanottu polytheonamides voitiin havaita vuonna sienet . Nämä ovat peptidi toksiinit , aminohapoista, jotka vuorottelevat välissä D ja L-muodot . Ne syntetisoidaan ilmeisesti ribosomaalisesti L -peptideinä ja sitten translaation jälkeen jokainen toinen aminohappo epimerisoidaan. Tämä tehdään muutamien entsyymien avulla, joiden geenit, jotka ovat ilmeisesti peräisin bakteereista, ovat päässeet sieniin horisontaalisen geenisiirron kautta .
D -aminohapot monisoluisissa soluissa
Dankwart Ackermann ja M. Mohr pystyivät havaitsemaan D - ornitiini maksassa että piikkihain ( acanthias vulgaris ) 1937 . Krebsin löytämä D- aminohappooksidaasi havaittiin kaikissa nisäkkäissä seuraavina vuosina . H. Blaschko ja Joyce Hawkins löysivät ne ensin selkärangattomista vuonna 1951 . Tämän entsyymin toiminta eri organismeissa jäi epäselväksi. 1960 -luvun lopulla arveltiin, että entsyymiä käytettiin ruoansulatuskanavassa hajottamaan gram -positiivisten bakteerien soluseinäkomponentteja, jotka sisältävät suuria määriä D -aminohappoja. Teoria, jonka mukaan D -aminohappooksidaasi toimii vain ulkoisesti toimivien (eksogeenisten) D -aminohappojen hajottamiseksi , oli olemassa 1990 -luvun alkuun asti.
Kun hemolymfassa on Wanzenart Oncopeltus fasciatus oli Auclair ja Patton ensimmäisen kerran 1950 monisoluisten D havaittu alaniini. He käyttivät analyysimenetelmänä kaksiulotteista paperikromatografiaa . Jälkeen eluoiden, ne ruiskutetaan kuivattu kromatogrammeja D amino -oksidaasi, joka deaminoidaan vain D- alaniini on ketocarboxylic happo, joka voidaan helposti havaita kanssa fenyylihydratsiinia . Syynä läsnä D- alaniinia epäiltiin olevan mikrobiflooran, nieleminen ravinnon kautta, ja spontaani rasemoitumisen kautta ikääntyminen .
Biosynteesi on D -seriiniväliosan osoitettiin vuonna 1965, jonka johtama tutkijaryhmä John J. Corrigan at Tufts University School of Medicine in Massachusettsissa . Silkki koi syötetään kanssa radioaktiivisesti leimatun D - glukoosi tuottaa sekä L- ja D- seriini. Myöhemmin D- aminohappoja löytyi myös muista hyönteisistä ja nisäkkäistä.
1962 eristetty italialainen johtama tutkijaryhmä Vittorio Erspamer Etelä-Amerikan sammakko on Physalaemus fuscomaculatus takykiniinin physalaemin . Tämä polypeptidi koostuu kahdestatoista aminohaposta ja alkaa N-päästä katsottuna D- proliinista. Yksikirjaimisessa koodissa järjestys on pEADPNKFYGLM-NH2. Se oli ensimmäinen luonnollinen peptidi, joka löydettiin D -aminohaposta, joka ei ole mikrobiologista alkuperää. Mutta jopa kolme vuotta myöhemmin esimerkiksi amerikkalainen biokemisti Alton Meister kirjoitti standarditeoksessaan Biochemistry of aminohapot, että "tällä hetkellä ei ole vakuuttavaa näyttöä D -aminohappojen esiintymisestä kasvien ja eläinten proteiineissa" . Aluksi Erspamerin löydöstä ei juurikaan kiinnitetty huomiota. Se oli vain 19 vuotta myöhemmin, kun sama työryhmä eristetty dermorfiini vuonna syyläinen maci sammakko ( Phyllomedusa sauvagii ), joka on myös kotoisin Etelä-Amerikasta , että soveltamisalaa löytö hitaasti tunnustettu. N -terminaalista katsottuna seitsemässä aminohaposta koostuvassa dermorfiinissa on D -alaniini kohdassa 2 . D konfiguraatio alaniini on olennaista farmakologista aktiivisuutta. Dermorfiini sitoutuu µ 1 -reseptoriin ja on paljon valikoivampi ja voimakkaampi kuin kehon omat endorfiinit ( dynorfiinit ja enkefaliinit ) ja farmakologisesti laajalle levinnyt kasvismorfiini . Löytö oli ristiriidassa joidenkin paradigmien kanssa, joten Erspamerilla oli huomattavia vaikeuksia löytää lehteä, joka julkaisi työryhmänsä tulokset. Yksi näistä paradigmoista on, että proteiinien biosynteesin aikana organismin DNA koodaa vain 20 kanonista aminohappoa , jotka ovat yksinomaan L -konfiguraatiossa . D -aminohappoja koodaavaa geeniä ei ole . Tämä ristiriita ratkaistiin kymmenen vuotta myöhemmin: Epimeraasien katalysoima stereoselektiivinen translaation jälkeinen modifikaatio on vastuussa D -aminohappojen esiintymisestä eukaryoottisissa peptideissä. Tämä tarkoittaa, että translaation jälkeen tietyn L- aminohapon konfiguraatio muuttuu erityisen endogeenisen entsyymin vaikutuksesta.
D -aminohapot nisäkkäissä
D -aminohappojen biologinen toiminta nisäkkäillä suljettiin pois vuoteen 1992 asti. Analyyttisten mittausmenetelmien, kuten kaasun ja korkean suorituskyvyn nestekromatografian (GC tai HPLC), parantamisen seurauksena 1980-luvulta lähtien tuli mahdolliseksi erottaa D- aminohapot puhtaasti L- peilikuvistaan ja havaita ne tasaisesti pienimmät määrät. Vuonna 1992 Atsushi Hashimoto ja työtovereiden havaittu suhteellisen suuria määriä vapaata D -seriini , että aivoissa on rottien . He havaitsivat noin 0,27 µmol / g aivomassapitoisuuden. Ne määriteltiin L -seriini sisältö on 0,89 umol / g aivoja massa, joka johti D- to- L -suhde oli 0,23. Se oli aiemmin tunnettua, että ulkoisesti (eksogeenisesti) syötetään D -seriinin on tehokas, selektiivinen allosteeristen agonisti on NMDA-reseptorin ( N- metyyli- D- aspartaatti). Suhteellisen korkeiden D -seriinipitoisuuksien lähde , joka myöhemmin havaittiin myös muiden nisäkkäiden, myös ihmisten, aivoissa, jäi aluksi epäselväksi. Spekulaatioita, kuten kohdennettu käyttöönotto rasemisoidun L- seriini elintarvikkeiden ja kulkeutumista veri-aivoesteen aivoihin, päättyi 1999 löytämisen entsyymin seriinin rasemaasia aivoissa rottien Herman Wolosker ja kollegat. Seriinirasemaasi katalysoi seriinin rasemoitumista. Aminohapon rasemaaseja tunnettiin aiemmin vain bakteereissa ja joissakin hyönteisissä. Entsyymi havaittiin gliasoluissa, joissa on verrattain korkeat D -seriinipitoisuudet. Seriinirasemaasin havaitsemisen avulla voitaisiin osoittaa, että tämä arkaainen D -aminohappo -aineenvaihdunta on säilynyt myös nisäkkäillä ja - kuten myöhemmin osoitettiin - sillä on tärkeä tehtävä neurotransmissiossa . Dogmi , että D- aminohappoja ei ole erityisiä tehtäviä vuonna eukaryooteissa oli luovuttava. Nykyään tiedämme, että D -seriinillä on tärkeä rooli lukuisissa keskushermoston prosesseissa , kuten oppimisprosesseissa ja muistitoiminnoissa , mutta myös mielisairauksissa , neuropatioissa ja neurodegeneratiivisissa sairauksissa .
Fysiologinen merkitys
Vapaat D -aminohapot
1990 -luvun loppuun asti oletettiin, että D -aminohapoilla ei ollut fysiologista toimintaa selkärankaisilla. Kun nisäkkäiden aivoissa havaittiin suurempia määriä D -seriiniä ja D -asparagiinihappoa, näiden kahden poikkeuksellisen aminohapon toiminnan tutkimus alkoi. D -aminohappojen fysiologisten vaikutusten tutkimus on verrattain nuori tieteenala, jossa on monia vastaamattomia kysymyksiä.
D -Seriini
On lisäksi gliasoluiksi , D -seriini onmyös todettu hermosolujen (neuronien). Se syntyy L -seriini alle katalyyttinen vaikutus entsyymin seriinin rasemaasia ( EY 5.1.1.18), jotka ovat peräisin näistä soluista ilmaistuna on. Hajoamistakatalysoi D- aminohappooksidaasi (EC 1.4.3.3). D -seriininpitoisuusaivoissa määräytyy näiden kahden kertymis- ja hajoamisprosessin perusteella. D -seriini toimii koagonistina on NMDA-reseptorin , jonka ”luonnollinen” ligandi on aminohappo glysiini. Tällä reseptorilla on suuri merkitys useille fysiologisille mutta myös patologisille prosesseille. D -seriini lisää NMDA -reseptorin aktiivisuutta. Siksi sitä kutsutaan myös " neuromodulaattoriksi ". D -aminohappooksidaasinyliekspressio, joka johtaa D -seriininhajoamisen lisääntymiseen, vähentää näin ollen aktiivisuutta NMDA -reseptorissa. Alhainen NMDA -reseptori liittyy pääasiassa skitsofreniaan . Jopa pienet määrät NMDA -reseptorin antagonisteja voivatlaukaista oireita , kuten kognitiivisia ja fysiologisia häiriöitä, jotka vastaavat skitsofrenian oireita terveillä koehenkilöillä .
Vuonna 2002 suuren kansainvälisen työryhmän havaittu, että vasta löydetty G72 -geeni ( DAOA geeni, D-aminohappo-oksidaasia aktivaattori ) liittyy läheisesti skitsofreniaa. Geenituote on G72 aktivoi D- aminohappo-oksidaasia, joka laskee pitoisuus D -seriini aivoissa. He löysivät vain heikko korrelaatio välillä aktiivisuuden D- aminohappo-oksidaasia ja esiintyminen skitsofrenian. Yhdistelmä D- aminohappo-oksidaasia ja G72 aktivaattori oli kuitenkin voimakkaasti toisiaan ( synergistinen ). Kirjoittajat päättivät, että lopulta vapaan D -seriinin pitoisuudella on olennainen rooli skitsofreniassa. Muut tutkimukset ovat myös osoittaneet geneettisen yhteyden D- aminohappooksidaasin ja skitsofrenian välillä. Työryhmien tulokset, jotka pystyivät osoittamaan, että D -seriinin pitoisuus skitsofreniapotilaiden veriseerumissa ja aivo -selkäydinnesteessä verrattuna terveiden koehenkilöiden ryhmään, vähenevät merkittävästi näiden havaintojen mukaisesti . Lisäksi D- aminohappooksidaasin lisääntynyt ilmentyminen havaittiin kuolleiden skitsofreniapotilaiden aivoissa . Lisäämällä D -seriiniväliosan hoidossa skitsofreniapotilaiden osoitti lupaavia tuloksia kliinisissä kokeissa. Meta-analyysi 18 kliinisissä tutkimuksissa havaittu vähenemistä skitsofrenian oireita. Paraneminen oli kuitenkin vain kohtalaista.
Tieto D- aminohappooksidaasin ja D- aminohappooksidaasin toiminnasta on johtanut erilaisten D- aminohappooksidaasin estäjien kehittämiseen , jotka ovat mahdollisia lääkkeitä skitsofrenian hoitoon. D -aminohappo-oksidaasi-inhibiittorit ovat vielä hyvin varhaisessa kehitysvaiheessa, niin että lääkettä ei tuote tämän vaikuttavan aineen ei ole vielä hyväksytty (kuten 2012).
Tämän aminohapon liiallista pitoisuutta gliasoluissa ja siihen liittyvää eksitotoksisuutta tutkitaan mahdollisena syynä amyotrofiseen lateraaliskleroosiin , joka on hermoston rappeuttava sairaus.
D -asparagiinihappo
Vapaata D -asparagiinihappoa havaittiin ensimmäisen kerran vuonna 1986 amerikkalaisen David S. Dunlopin johtamassa työryhmässä merkittäviä määriä jyrsijöiden aivoissa ja ihmisveressa. He havaitsivat korkeimmat D -aspartaatin pitoisuudet vastasyntyneiden rottien aivopuoliskolla 164 nmol / g . Tämä vastasi 8,4% asparagiinihapon kokonaismäärästä. Tämä pitoisuusarvo ylittää monien välttämättömien L -aminohappojen aivoissa. Aivojen lisäksi verrattain suuria määriä D- aspartaattia voidaan havaita myös käpyrauhasessa , aivolisäkkeessä , lisämunuaisissa ja kiveksissä . Analogisesti D- seriinin kanssa D- aspartaatti muodostuu elimistöön L- aspartaatin entsymaattisella rasemoitumisella , tässä tapauksessa D- aspartaattirasemaasilla (EC 5.1.1.13), ja hajoaminen tapahtuu D-aspartaattioksidaasin (EC 1.4) kautta .3.1). D -aspartaatin pitoisuus pienenee rajusti organismin iän myötä. D -aspartaattirasemaasin suuria aktiivisuuksia havaitaan elimissä, joissa voidaan myös havaita suuria D -asparagiinihapon pitoisuuksia. Aktiivisuus on suurinta aivolisäkkeessä. Aspartaattirasemaasin deaktivointi esimerkiksi retroviruksilla , jotka aiheuttavat nimenomaan toimintahäiriön aspartaattirasemaasia täydentävässä ribonukleiinihapossa (RNA), johtaa D -aspartaatin pitoisuuden merkittävään laskuun . Tämän seurauksena dendriittinen kehitys häiriintyy massiivisesti, mikä puolestaan johtaa voimakkaaseen vaurioon neurogeneesissä hippokampuksessa . Näiden testitulosten perusteella oletetaan, että D- aspartaatti on tärkeä hermosolujen kehityksen säätelijä. D -asparagiinihapon tarkat fysiologiset vaikutukset ovat edelleen suurelta osin epäselviä. Tutkimusalue on hyvin uusi. Esimerkiksi aspartaattirasemaasi kloonattiin vasta nisäkkäissä vuonna 2010 .
D- aminohappoja sisältävät peptidit
Organismin ikääntyessä homokiraalisuuden menetys kasvaa, erityisesti asparagiinihapon rasemoitumisen lisääntymisen vuoksi. Oksidatiivinen stressi ja UV -säteily voivat nopeuttaa tätä menetystä. Rasemoituminen (esim. Asparagiinihapon asparagiinihapon rasemoituminen ) etenee sukkiini -imidivälituotteen muodostumisen vuoksi, mikä vaatii vain vähän aktivointienergiaa erityisen helposti. Tämä proteiinien ei-entsymaattinen in vivo -rasemisaatio on itsenäinen ikääntymisprosessi, joka vaikuttaa ensisijaisesti pitkäikäisiin proteiineihin, kuten kollageeniin dentiinissä tai kiteiseen silmän linssiin. Esimerkiksi 0,14% silmän linssien asparagiinihaposta rasisoituu joka vuosi. 30-vuotiaalla rasmasoituu keskimäärin 4,2% silmän linssien kiteessä olevasta asparagiinihaposta. Lisäksi rasemoituminen vaikuttaa kuitenkin myös muihin toiminnallisiin proteiineihin, kuten entsyymeihin tai lähettimiin . Peptidit, jotka sisältävät D -aminohappoja, ovat merkittävästi stabiilimpia proteaasien aiheuttamalle entsymaattiselle hajoamiselle kuin peptidit, joiden aminohapot ovat läsnä vain L -konfiguraatiossa. Monissa tapauksissa rasemisaatio endogeenisessä proteiinissa johtaa fysiologisiin ongelmiin. Proteiineissa rasemoituminen aiheuttaa toiminnan menetyksen ja proteiinin kertymisen monenlaisiin kudoksiin, joita organismi ei voi enää hajottaa. Rasemisaation lisääntymistä voidaan havaita joissakin kliinisissä kuvissa. On ateroskleroosi , emfyseema , ikänäöstä , kaihi ja rappeutumista ruston ja aivot, rasemisointi asparagiinihapon pidetään asiaa patologinen tekijä.
Vuonna 1988, lisääntynyt semoitumisaste määritettiin ensimmäisen kerran vuonna β-amyloidin on seniiliplakkien aivoista kuolleen potilailla, joilla on Alzheimerin tauti . Erityisesti D -aspartaatti ja D -seriini voitaisiin havaita. Myöhemmin havaittiin, että asparagiinihapon rasemoituminen asemassa 23 johtaa nopeutuneeseen peptidien aggregaatioon, jota pidetään olennaisena osana Alzheimerin taudin patogeneesissä . Toisin kuin rasemoituminen asemassa 23, rasemoituminen asemassa 7 johtaa peptidin aggregaation vähenemiseen. Tärkeä rooli Alzheimerin taudin kehittymisessä johtuu β-amyloidin rasemoitumisprosesseista, jotka johtuvat oletettavasti proteiinin ikääntymisestä ja jotka etenevät samalla tavalla kuin dentiinissä. Rasemisaatio nopeuttaa peptidien aggregaatiota ja vaikeuttaa proteaasien entsymaattista hajoamista.
ominaisuudet
Kemialliset ja fysikaaliset ominaisuudet
Akiraalisessa ympäristössä D- ja L -aminohapot ovat kemiallisilta ja fysikaalisilta ominaisuuksiltaan täysin identtisiä, lukuun ottamatta polarisoidun valon pyörimissuuntaa. Kiraalisessa ympäristössä löytyy merkittäviä eroja. Tämä pätee erityisesti biokemiallisiin prosesseihin, jotka ovat luonnostaan kiraalisia. Käytännön esimerkki tästä on makuero aminohappo -enantiomeerien välillä. L- aminohapoista koostuvat G-proteiiniin kytketyt makureseptorit ovat kiraalinen ympäristö, jonka kanssa enantiomeerit vuorovaikuttavat eri tavalla. Useimpien L -aminohappojen makua kuvataan " katkeraksi ", kun taas D -aminohappojen makua kuvataan yleensä "makeaksi". Äärimmäinen esimerkki on D - tryptofaani ; ylivoimaisesti makeimmassa aminohapossa on 37 kertaa sakkaroosin makeus . Toisaalta L -tryptofaani on katkera aminohappo yhdessä L -tyrosiinin kanssa. Vuorovaikutus muiden reseptorien tai entsyymien kanssa biokemiallisissa prosesseissa voi olla vastaavasti erilainen. Tämä koskee myös erityisesti peptidejä ja proteiineja, jotka sisältävät yhtä tai useampaa D -aminohappoa.
Stereokemiallisesta näkökulmasta D: n sisällyttäminen tai L -aminohapon epimerisaatio proteiiniin aiheuttaa diastereomeerin muodostumisen, joka antaa koko proteiinille täysin uudet kemialliset ja fysikaaliset ominaisuudet. Biokemiallisesti tällä interventiolla primaarirakenteessa on huomattavia vaikutuksia siitä johdetun peptidin sekundaariseen , tertiääriseen ja kvaternaariseen rakenteeseen . Biokemiallinen vaikutus muuttuu suuresti. Näissä kahdessa ääritapauksessa se voi joko kadota kokonaan ( toiminnon menetys ) tai olla täysin uusi, esimerkiksi myrkyllisiä vaikutuksia ( toiminnan lisääntyminen ). Peptidissä, joka muuten koostuu L -aminohapoista, D -aminohapot estävät a -heliksin muodostumisen. Ne ovat "kierukan rikkomista". Vain proteiinit, jotka koostuvat kokonaan D- tai L -aminohapoista, voivat - jos heliksiä muodostavat aminohapot, kuten valiini, glutamiini , isoleusiini, alaniini, metioniini , leusiini, glutamiinihappo tai tryptofaani - ovat läsnä, muodostaa peilikuvan toisistaan. Tämä ei ole mahdollista peptidiseosten kanssa.
toksikologia
Proteinogeenisten aminohappojen D -isomeerit
Tutkimuksissa, joissa tutkittiin aminohappojen laajaa saantia suun kautta - esimerkiksi ravintolisien muodossa - seriiniä ja asparagiinihappoa lukuun ottamatta, kaikki "luonnollisen" L -kokoonpanon aminohapot osoittivat enemmän myrkyllisiä vaikutuksia kuin vastaavat D -enantiomeeri. D -aminohapot ovat luonnollinen osa monenlaisia ruokia. Siellä ne syntyvät pääasiassa rasemoitumisprosessien kautta "luonnollisista" L- aminohapoista. Ruoka, joka on käynyt läpi käymisen prosessi, kuten maitotuotteiden , sisältää lisääntyneitä määriä D- aminohappoja. Emmentaler sisältää noin 0,7 g / kg D- aminohappoja. Jopa lähtöaineessa, lehmänmaidossa , noin 1,5% kaikista aminohapoista on D -kokoonpanossa.
Arvioiden mukaan noin kolmannes ruoan kautta nautituista D- aminohapoista on mikrobiperäisiä . Jotta elintarvikkeiden sisältämät ja proteiineihin kytketyt aminohapot voitaisiin käyttää organismille, proteiinit on hajotettava yksittäisiksi komponenteiksi, vapaiksi aminohapoiksi, ruoansulatuksen aikana. Jos proteiinissa on D -aminohappoja, proteiinin saatavuutta proteolyyttisiin entsyymeihin voidaan rajoittaa huomattavasti. Ihmisen ruoansulatusjärjestelmän entsyymit eivät voi katkaista sidoksia D- ja L -aminohappojen välillä. Hajoaminen yksittäisiksi aminohapoiksi, di- tai tripeptideiksi, mikä on välttämätöntä , jotta organismi voi imeytyä suoliston limakalvojen kautta , vaikeutuu. Suurempia peptidifragmentteja ei voida käyttää ja ne erittyvät ulosteiden mukana . Hyötyosuus , ja siten myös ravintoarvo, sitten vähenee huomattavasti. D- tai tripeptidit, jotka sisältävät D -aminohappoja, voivat - kuten vapaat D -aminohapot - imeytyä peptidikuljettajien kautta . Suuri osa tällä tavalla imeytyneistä D- aminohapoista erittyy jälleen munuaisten kautta. Riippuen elintarvikkeiden saanti ja vastaavat D -aminohapon, jotkut D- amino hapot muutetaan osaksi L amino hapot kautta transaminaation ja siten asetetaan saataville proteiinibiosynteesiin .
"Luonnoton" D- aminohappojen sisällyttäminen bakteerien soluseinään tekee niistä resistenttejä proteaaseille. Tällä proteaasin stabiilisuudella on suuri merkitys myös ihmisille, sillä aikuisen suolistossa on useita satoja grammoja suolistobakteereita , jotka yhdessä suuren määrän proteaaseja ovat välttämättömiä ruoansulatukselle.
Suurin osa ruoan D- aminohapoista tuotetaan valmistuksen aikana. Korkeat lämpötilat ja voimakkaasti happamat tai emäksiset olosuhteet johtavat (osittaiseen) rasemoitumiseen. Esimerkiksi, noin 14%: n asparagiinihapon on perunalastut on , että D- muodossa. Vuonna kahviin se on 17% ja vuonna pekoniviipaletta 13%. Vapaat L- aminohapot rasemoituvat noin kymmenen kertaa hitaammin kuin proteiineihin sitoutuneet. Rasemoitumisaste riippuu myös suuresti itse aminohaposta. Seriini pyrkii rasemoitumaan erityisen helposti hydroksyyliryhmän vuoksi . Gelatiinin tuotannossa tarvittavat rajut olosuhteet - joko hapan tai emäksinen hajotus korkeissa lämpötiloissa - johtavat gelatiinin kollageenin voimakkaaseen rasemoitumiseen, erityisesti asparagiinihapon. Osuus D -aspartaattiliuos koko aspartaatti voi olla hieman yli 30%, kun on kyse kaupallisesti saatavilla gelatiinia.

D -aminohapot eivät sisälly proteiineihin tai peptideihin tai muihin aineenvaihdunnan (makro) molekyyleihin, kun nisäkäsorganismi absorboi ne. Kertymistä kehon kudokseen muuttumattomassa muodossa ei voida havaita. Ravinnon kautta tai infuusiona tallennetaan D -aminohappoja on osittain virtsa erittyy ja osittain kautta nykyisen maksassa ja munuaisissa entsyymi D -Aminosäureoxidase deaminoinnin on "normaali" aineenvaihdunnan tuotteita, keto karboksyylihapot , hapetetaan . Mitä tulee infusoitujen D -aminohappojen myrkyllisyyteen , on enemmän tai vähemmän tahattomasti monen vuoden kokemus, joka viittaa siihen, että D -aminohapot eivät ole haitallisia terveydelle. Tämän lausunnon perusta on parenteraalisen ravinnon ("keinotekoinen ravitsemus") hyvä sietokyky , joka koostui monien vuosien ajan suuriannoksisista aminohapposematemaateista. Nämä infuusioliuokset valmistettiin proteiineista happohydrolyysin avulla - mikä johtaa väistämättä rasemoitumiseen. Raseemista metioniini ( DL -metioniinilla) on komponentti monissa rehun että karjan teollisuudessa . Lypsylehmillä on osoitettu, että yli 75% D- metioniinista muuttuu L- metioniiniksi ja tulee siten biologisesti saataville.
Riippumatta näistä empiirisistä arvoista, testitulokset voidaan nähdä rotan eläinmallissa. Suuret D -seriinin annokset (alueella 0,8 g / painokilo) johtavat akuuttiin tubulaariseen nekroosiin näissä malliorganismeissa , mikä palautuu D -seriinin annon lopettamisen jälkeen . Munuaisten toiminta on täysin palautunut noin kuuden päivän kuluttua. Patologiset muutokset ovat pitkälti samanlaisia kuin lysinoalaniinin aiheuttamat munuaisvauriot . Miksi D -seriini on myrkyllistä munuaisille näinä suurina pitoisuuksina, ei ole vielä selvitetty varmasti. D -seriini voi vähentää pitoisuutta munuaisten glutationin , joka on tarkoitus suojella proksimaalisten tubulusten soluja haitallisilta vaikutuksilta reaktiivisten happilajien (ROS). Entsymaattista jakautuminen D -seriini mukaan D -aminohappo-oksidaasi tuottaa vetyperoksidia kuin sivutuotteena , joka vähentää merkittävästi solunsisäisen glutationin.
Joulukuussa 1989 arvostetussa The Lancet -lehdessä julkaistu kolmen wieniläisen lääkärin viesti aiheutti sensaation . He olivat löytäneet suuria määriä D - proliini maidossa, että ne kuumennettiin on mikroaaltouunissa , joka on ilmeisesti tuotettu rasemisointi L- proliini . Lisäksi he pitivät D -proliinia neurotoksisina , nefro- ja hepatotoksisina ominaisuuksina. Julkaisu oli kirje toimittajille eikä vertaisarvioitu julkaisu tai edes kontrolloitu tutkimus. Kirjoittajat eivät myöskään maininneet testiolosuhteita, joissa tämä rasemoitumisaste saavutettiin. Tästä riippumatta raportti julkaistiin päivä- ja viikoittaisessa lehdistössä dramaattisella sanamuodolla ja varoituksilla mikroaaltolaitteiden käytöstä. Elokuussa 1990 liittovaltion terveysvirasto selvensi tosiasioita, mutta tällä ei juurikaan ollut julkista vaikutusta. Muut tutkijat ovat osoittaneet, että D- proliini on normaali osa päivittäistä ruokaa, joka hajoaa nopeasti ja erittyy nielemisen jälkeen. Siitä huolimatta esimerkiksi elokuussa 1991 ilmestyi aikakauslehti, jonka otsikko oli ”Mikroaallot myrkyttävät hermoja, maksa ja munuaiset” . Samankaltaisia väitteitä löytyy edelleen asiaankuuluvilta verkkosivuilta.
Muiden työryhmien yritykset toistaa Wienin lääkäreiden tulokset aluksi epäonnistuivat. Jopa sen jälkeen, kun maitoa oli keitetty liedellä 30 minuuttia, D- proliinin nousua ei voitu mitata. Testiolosuhteet julkaistiin kaksi vuotta myöhemmin. Lancet -kirjeen kirjoittajat olivat lämmittäneet maidon suljetussa paineastiassa 10 minuutin ajan 174 - 176 ° C: een - lämpötila -alue, jota ei voida saavuttaa tavallisissa kotitalouksien maidon lämmitysastioissa. Lausunnossaan D- proliinin neurotoksisuudesta Lancet Letterin kirjoittajat viittasivat kokeisiin vuodelta 1978, joissa poikasille injektoitiin ainetta intraventrikulaarisesti eli suoraan aivokammioon . Myöhemmät tutkimukset D- proliinin toksisuudesta rotilla osoittivat, että yhdiste on vaaraton jopa suurina pitoisuuksina.
Todellinen vaara kuumennettaessa maitoa mikroaaltouunilla - erityisesti pienille lapsille - on pullon sisällön epätasainen kuumeneminen, mikä johtaa usein kliinisesti merkittäviin palovammoihin.
Ei -proteinogeenisten aminohappojen D -isomeerit
Ei-proteinogeenisten aminohappojen D- isomeerien toksisuudesta ei voida tehdä yleisiä lausuntoja. Se on hyvin yksilöllistä aminohaposta aminohapoksi. Mielenkiintoista on, että jotkut D -aminohappoja sisältävät yhdisteet ovat huomattavasti vähemmän myrkyllisiä kuin niiden L -isomeerit. Esimerkkejä ovat sykloseriini ja penisillamiini . Esimerkiksi, joka on LD 50 -arvo , että suun kautta rasemaatin D - ja L -penisilliiniamiinista malli organismin rotalla 365 mg / kg. Puhtaalle D- penisillamiinille ei kuitenkaan ole merkkejä toksisuudesta edes 1200 mg / kg annoksella.
D -peptidejä
Yleiset lausunnot D -peptidien toksikologisista ominaisuuksista eivät ole mahdollisia. Herkkyys proteaaseille on merkittävästi pienempi ja immunogeeninen potentiaali on merkittävästi pienempi kuin vastaavilla L -peptideillä.
analyysi
Klassiset toimenpiteet
Polarimetrin voidaan käyttää määrittämään optinen kiertokulma aminohapon liuos, josta sisältö D ja L enantiomeerit voidaan laskea. Tähän tarvitaan kuitenkin standardoituja olosuhteita (ennen kaikkea pitoisuus, lämpötila ja liuotin). Lisäksi menetelmä soveltuu vain yksittäisille aminohapoille eikä eri aminohappojen seoksille. 1960- ja 1980 -luvuilla ioninvaihtokromatografiaa käytettiin myös johdannaisten aminohappojen erottamiseen. Analysoitavat aminohapot muutettiin diastereomeerisiksi dipeptideiksi L- aminohappojen kanssa ennen erottamista . Entsymaattiset menetelmät, jotka perustuvat reaktioon tiettyjen entsyymien, kuten L- ja D -aminohappooksidaasin kanssa, kuuluvat klassisiin menetelmiin aminohappojen enantiomeerien määrittämiseksi. Kapillaarielektroforeesi soveltuu muun muassa ei -kromatografiseksi menetelmäksi D -aminohappojen analysointiin .
Kromatografinen prosessi
Kvantitatiiviset analyysit, jopa monimutkaisista aminohapposeoksista, voidaan suorittaa kromatografisten menetelmien avulla . Ensin seoksen yksittäiset komponentit erotetaan kiinteässä vaiheessa ja mitataan sitten ilmaisimella. UV- tai massaspektrometrejä käytetään pääasiassa ilmaisimina , ja liekki -ionisaatioilmaisimia käytetään myös kaasukromatografiassa . Lähtöseoksen erottamiseen kiinteässä vaiheessa käytetään kahta eri strategiaa. Yksinkertaisimmassa tapauksessa kaksi enantiomeeriä erotetaan kiraaliseen kiinteään faasiin, jonka kanssa kaksi isomeeriä vuorovaikutuksessa eri asteissa ja eluoituvat siten eri nopeuksilla . Erottaminen on mahdollista vain akiraalisessa kiinteässä faasissa, jos enantiomeerit muutetaan diastereomeereiksi. Kaasukromatografia (GC) ja korkean suorituskyvyn nestekromatografia (HPLC) ovat vakiinnuttaneet asemansa analyysimenetelminä . Enantiomeerinen puhtaus on D- aminohappoja, voidaan myös analysoida ohutkerroskromatografisesti .
Vain erityisten kromatografisten menetelmien kehittäminen mahdollisti D- aminohappojen havaitsemisen ja kvantifioinnin ylempien organismien elimissä.
Kaasukromatografia
Aminohappoja ei voida haihduttaa ilman hajoamista. Kaasukromatografiassa tapahtuvaa erottamista ja analysointia varten ne on muutettava yhdisteiksi, jotka voidaan höyrystää ilman hajoamista. Tätä tarkoitusta varten aminohapoille suoritetaan yleensä kaksivaiheinen johdannaisprosessi . Esimerkiksi karboksiryhmä voidaan esteröidä etanolilla ensimmäisessä vaiheessa ja sitten toisessa vaiheessa aminoryhmä voidaan muuntaa trifluorietikkahappoanhydridillä, jolloin saadaan trifluoriasetyylijohdannainen (TFA). Prosessissa muodostuvan aminohapon N -TFA / O -etyylijohdannainen voidaan haihduttaa hajoamatta kaasukromatografissa ja erottaa kiraaliseen kiinteään faasiin. Johdannainen kiraalisilla reagensseilla lisää rasemoitumisen riskiä ja että reaktiokumppaneilla on erilaiset reaktiokinetiikat. Molemmat voivat väärentää mittaustuloksen.
Korkean suorituskyvyn nestekromatografia
HPLC: ssä kaasukromatografiaan verrattuna vallitseva on johdannainen kiraalisilla reagensseilla ja ei-kiraalisten kiinteiden faasien, esimerkiksi RP-18 , käyttö. Esimerkiksi, L - N -acetylcysteine käytetään yhdessä ftaalidialdehydi johdannaisen . Tuloksena olevalla diastereomeeriparilla (D - L ja L - L) on erilaiset kemialliset ja fysikaaliset ominaisuudet, mikä tarkoittaa, että se voidaan erottaa tavanomaisella pylväällä ja sitten havaita.
synteesi
Useimmat proteinogeeniset L- aminohapot tuotetaan käymällä . Tämä mikrobiologinen prosessi ei sovellu varten D -aminohapoista. Erilaisia tuotantoprosesseja on kehitetty vastaamaan D -aminohappojen kasvavaan kysyntään .
Klassiset kemialliset synteesit, kuten Strecker -synteesi , toimittavat aina aminohappojen rasemaatit. Näistä seoksista, yksittäisten aminohappojen joko erotetaan vievää (voi resoluutio ) tai lisäämällä L -aminohapon entsymaattisesti käyttäen L - Aminosäuredesaminasen että ketocarboxylic hapon, joka voidaan suhteellisen helposti erottaa.
D- aminohapposynteesi substituoitujen hydantoiinien kautta on tyylikkäämpi . Hydantoiineja voidaan valmistaa teollisessa mittakaavassa käyttämällä Bucherer-Bergs-reaktiota (kutsutaan myös Bucherer-Bergs-hydantoiinisynteesiksi ) aldehydeistä, kaliumsyanidista ja ammoniumkarbonaatista . Muodostunut aminohappo määräytyy käytetyn aldehydin valinnan perusteella. Tällä tavalla tuotettu hydantoiini voidaan muuntaa edelleen D- aminohapoksi niin sanotussa hydantoinaasiprosessissa . Tämän usean entsyymin prosessin on kehittänyt Degussa (nyt Evonik Degussa ) ja se koostuu kolmesta reaktiovaiheesta. Ensimmäinen, raseeminen hydantoiinijohdannainen on alle katalyyttinen vaikutus D - hydantoinase ja N- karbamoyyli- D hydrolysoidaan aminohappo. Toisessa vaiheessa N -karbamoyyli- D- aminohappo on edelleen hydrolysoidaan enantiomeerisesti puhtaan aminohapon kanssa apuna D carbamoylase . Kolmannessa vaiheessa hydantoiinijohdannaisen reagoimaton enantiomeeri rasemisoidaan kemiallisesti tai entsymaattisesti. Kemiallinen rasemoituminen tapahtuu pH -arvoilla> 8, ja sitä voidaan nopeuttaa merkittävästi lisäämällä rasemaasia. Verrattuna muihin menetelmiin, hydantoinaasiprosessi tuottaa enantiomeerisesti puhtaita aminohappoja rasemaatista alkaen teoreettisilla saannoilla jopa 100%.
käyttää
D -aminohappojen maailmanlaajuinen kysyntä on kasvanut jatkuvasti viime vuosina. Vuonna 2017 markkinoille ennustetaan noin 3,7 miljardia dollaria.
D -aminohapot voidaan löydetty tärkeä rakennuspalikoita, esimerkiksi makeutusaineita , hyönteismyrkyt , kosmetiikka ja, ennen kaikkea, on suuri määrä peptidin lääkkeitä , jotka ovat merkittävä kasvun ajuri markkinoiden kehittäminen.
Penisilliinien ( esim. Amoksisilliini ) ja kefalosporiinien ( esim. Kefakloori ) synteesiin tarvitaan vuosittain useita tuhansia tonneja D -4 -hydroksifenyyliglysiiniä ja D -fenyyliglysiiniä .
D- aminohapot eivät ainoastaan lisää bakteerien soluseinien stabiilisuutta proteolyyttistä hajoamista vastaan, vaan myös kohdennettu liittäminen lääkkeisiin lisää niiden stabiilisuutta, erityisesti suun kautta otettuna . Muutos järjestelyn funktionaalisten ryhmien ( konformaatiosta ) on edelleen vapaus suunnittelussa molekyylirakenteen molekyylirakenteen, joka voi johtaa parempiin aktiivisen ainesosan ominaisuudet. Gonadoreliini estäjä setroreliksi , joka on GnRH-analogia käytetään in lisääntymis- lääketieteessä , koostuu esimerkiksi, kymmenen aminohappoa, joista viisi ovat D- konfiguraatiossa. Cetrorelix on rakennettu täysin synteettisesti yksittäisistä aminohapoista. Muut GnRH-analogien, kuten leuproreliini , busereliini , degareliksi , histreliini , nafareliini tai abareliksi myös sisältää ainakin yhden D- aminohapon.
Hoitoon erektiohäiriön käytetään tadalafiili , joka tunnetaan paremmin tuotenimellä Cialis on, synteesissä D rakennettu tryptofaani. Antidiabeettisia nateglinidi , ryhmästä glinides , on valmistettu D- fenyylialaniini ja cis -4-isopropyyli-sykloheksaani-karboksyylihappoa. Fenyylialaniinia on käytetty masennuslääkkeenä 1970 -luvulta lähtien . Halpaa rasemaattia käytetään lääkkeenä. Merkittävä osa masennuslääkkeistä ja analgeettisista vaikutuksista tulee D- fenyylialaniinista, joka L- fenyylialaniiniin verrattuna ei metaboloidu mielialaa parantavaksi L- tyrosiiniksi, L- DOPA: ksi tai norepinefriiniksi , vaan estää ensisijaisesti enkefalinaasientsyymiä . Kun enkefalinaasi estetään, veren enkefaliinipitoisuus kasvaa, mikä aiheuttaa kipua lievittävää vaikutusta, joka voidaan myös havaita . Prosessin myöhemmässä vaiheessa D- fenyylialaniini metaboloituu pääasiassa fenyylietyyliamiiniksi .
Hyönteismyrkky fluvalinaatit ryhmästä pyretroidit , joka on hyväksytty muun muassa torjumiseksi varroaa punkki , on valmistettu D- valiini.
D -alaniini on makeutusaine alitame .
jatkokäsittelyä
- Ryuichi Konno, Hans Brückner, Antimo D'Aniello, George Fisher, Noriko Fujii, Hiroshi Homma: D -aminohapot: uusi raja aminohappojen ja proteiinitutkimuksessa - käytännön menetelmät ja protokollat. Nova Science Publishers, 2007, ISBN 1-60021-075-9 , 629 s.
- Loredano Pollegioni, Stefano Servi (toim.): Luonnoton aminohappo. Humana Press, 2011, ISBN 1-61779-330-2 , 409 s.
- Gyula Pályi, Luciano Caglioti, Claudia Zucchi (toim.): Advances in BioChirality. Elsevier, 1999, ISBN 0-08-043404-5 ( rajoitettu esikatselu Google-teoshaussa).
nettilinkit
- Aminohappojen D- ja L -muodot
- Hanka Symmank: Bakteeripeptidisyntaasien toiminnallinen ja rakenteellinen karakterisointi. Biologian, kemian ja farmasian laitos, Berliinin vapaa yliopisto, toukokuu 2002
Yksilöllisiä todisteita
- ^ A b Hans-Dieter Belitz , Werner Grosch , Peter Schieberle : Ruokakemian oppikirja. 5. painos, Springer Verlag, 2001. ISBN 3-540-41096-1 ( rajoitettu esikatselu Googlen teoshaussa ).
- ↑ a b c d Uwe Meierhenrich : Aminohapot ja elämän epäsymmetria: kiinni muodostelmassa. Springer, 2008, ISBN 3-540-76885-8 , s. 53–54 ( rajoitettu esikatselu Googlen teoshaussa ).
- ↑ VS Lamzin, Z. Dauter, KS Wilson: Kuinka luonto käsittelee stereoisomeerejä. Julkaisussa: Nykyinen mielipide rakennebiologiasta. Osa 5, numero 6, joulukuu 1995, s.830-836, PMID 8749373 . (Arvostelu).
- ↑ SA Fuchs, R. Berger et ai.: D-aminohapot keskushermostossa terveydelle ja sairauksille. Julkaisussa: Molecular Genetics and Metabolism. Osa 85, numero 3, heinäkuu 2005, s. 168-180, doi: 10.1016 / j.ymgme.2005.03.003 . PMID 15979028 . (Arvostelu).
- ↑ GF Joyce, GM Visser et ai.: Kiraalinen valinta oligo (G): n poly (C) -ohjatussa synteesissä. Julkaisussa: Nature. Vuosikerta 310, numero 5978, 1984 16.- 22.8 . , S. 602-604 , PMID 6462250 .
- ↑ VV Avetisov, VI Goldanskii: Homochiraliteetti ja stereospesifinen aktiivisuus: evoluution näkökohdat. Julkaisussa: Bio Systems. Osa 25, numero 3, 1991, s.141-149, PMID 1912384 .
- ↑ N. Fujii, T. Saito: Homochirality ja elämä. Julkaisussa: Chemical record. Osa 4, numero 5, 2004, s. 267-278, doi: 10.1002 / tcr.20020 . PMID 15543607 . (Arvostelu).
- ^ WA Bonner: Kokeellinen näyttö beetahajoamisesta kiraalisuuden lähteenä enantiomeerianalyysillä. Julkaisussa: Elämän alkuperä. Osa 14, numerot 1-4, 1984, s. 383-390 , PMID 11536584 . (Arvostelu).
- ^ WA Bonner: Pariteetin rikkominen ja biomolekulaarisen homokiraalisuuden kehitys. Julkaisussa: Kiraalisuus. Osa 12, numero 3, maaliskuu 2000, s.114-126 , doi : 10.1002 / (SICI) 1520-636X (2000) 12: 3 <114 :: AID-CHIR3> 3.0.CO; 2-N . PMID 10689289 . (Arvostelu).
- ↑ JR Cronin, S.Pizzarello: Enantiomeeriset ylimäärät meteoriittisissa aminohapoissa. Julkaisussa: Science. Vuosikerta 275, numero 5302, helmikuu 1997, s. 951-955, PMID 9020072 .
- ↑ S. Pizzarello, M. Zolensky, KA Turk: Nonracemic isovaline in the Murchison meteoriite: kiraalinen jakautuminen ja mineraaliliitto. Julkaisussa: Geochimica et Cosmochimica Acta. Vuosikerta 67, numero 8, 2003, s.1589-1595. doi: 10.1016 / S0016-7037 (02) 01283-8 .
- ↑ P. Schmitt-Kopplin , Z. Gabelica et ai.: Maan ulkopuolisen orgaanisen aineen suuri molekyylinen monimuotoisuus Murchisonin meteoriitissa paljastui 40 vuotta sen putoamisen jälkeen. Julkaisussa: PNAS. Vuosikerta 107, numero 7, helmikuu 2010, s. 2763-2768, doi: 10.1073 / pnas.0912157107 . PMID 20160129 . PMC 2840304 (ilmainen koko teksti).
- ↑ DP Glavin, JP Dworkin: L-isovaliini-aminohapon rikastaminen muuttamalla vesipitoisia CI- ja CM-meteoriittikantoja. Julkaisussa: PNAS. Vuosikerta 106, numero 14, huhtikuu 2009, s. 5487-5492, doi: 10.1073 / pnas.0811618106 . PMID 19289826 . PMC 2667035 (ilmainen koko teksti).
- ↑ PW Lucas, JH Hough et ai.: UV -pyöreä polarisaatio tähtienmuodostusalueilla: homokiraalisuuden alkuperä? Julkaisussa: Elämän alkuperä ja biosfäärin kehitys. Vuosikerta 35, numero 1, helmikuu 2005, s.29-60, PMID 15889649 .
- ↑ a b T. Carell : ( Sivu ei ole enää saatavilla , etsi verkkoarkistoista : Luento Stereokemia. ) Luku 9: Rasemisaatiot LMU München, s.150 .
- ↑ Elizabeth R. Neswald: Termodynamiikka kulttuurisena taistelukentänä: entropian kiehtovuuden historiasta, 1850-1915. Rombach, 2003, ISBN 3-7930-9448-0 , s.
- ↑ AS Kekulé: Voi kuinka hyvä, että kukaan ei tiedä ... In: Tagesspiegel. 12. tammikuuta 2011.
- ↑ T. Ogino, H. Ogino: Application oikeuslääketieteelliset hammaslääketieteen asparagiinihapon rasemoitumiselta unerupted ja ylimääräisten hampaiden. Julkaisussa: Hammaslääketieteellisen tutkimuksen lehti. Vuosikerta 67, numero 10, lokakuu 1988, s. 1319-1322, PMID 3170888 .
- ↑ T. Ogino, H. Ogino, B. Nagy: soveltaminen asparagiinihappo rasemisoitumista oikeuslääketieteelliset hammaslääketieteen: post mortem nimeäminen ikä kuollessa. Julkaisussa: Forensic science international. Voi. 29, Numbers 3-4, 1985, s. 259-267, PMID 4076954 .
- ^ S. Ohtanin, T. Yamamoto: strategia arvioimiseksi kronologinen ikä käyttäen asparagiinihapon rasemisaation menetelmä viitaten erityisesti korrelaatiokerroin välillä D / L-suhteet ja ikä. Julkaisussa: Journal of forensic Sciences. Vuosikerta 50, numero 5, 2005, s.1020-1027, PMID 16225206 . (Arvostelu).
- ↑ JL Bada, B. Herrmann et ai.: Aminohappojen rasemoituminen luussa ja Saksan keisarin Lothar I : n kiehuminen. In: Applied Geochemistry. Osa 4, numero 3, 1989, s. 325-327, doi: 10.1016 / 0883-2927 (89) 90036-X .
- ↑ a b Chris McManus: Oikea käsi, vasen käsi - epäsymmetrian alkuperä aivoissa, elimissä, atomeissa ja kulttuureissa. Harvard University Press, 2004, ISBN 0-674-01613-0 , s. 130 ( rajoitettu esikatselu Googlen teoshaussa ).
- ↑ PM Masters, M.Friedman: Aminohappojen rasemoituminen alkalilla käsitellyissä ruokaproteiineissa. Julkaisussa: Journal of Agriculture and food chemistry. Vuosikerta 27, numero 3, 1979 toukokuu-kesäkuu, s.507-511, PMID 447924 .
- ↑ JL Bada: Aminohappojen rasemoitumisen kinetiikka pH: n funktiona. Julkaisussa: Journal of the American Chemical Society. Nide 94, numero 4, helmikuu 1972, s. 1371-1373, PMID 5060280 .
- ↑ H. Frank, W. Woiwode et ai.: Proteiiniaminohappojen happaman katalysoidun rasemoitumisen nopeuden määrittäminen. Julkaisussa: Liebigs Ann Chem., Numero 3, 1981, s. 354-365. doi: 10.1002 / jlac.198119810303 .
- ↑ T. Geiger, S. Clarke: Deamidaatio, isomerointi ja rasemoituminen peptideissä olevissa asparaginyyli- ja aspartyylitähteissä. Sukkinimidiin liittyvät reaktiot, jotka edistävät proteiinien hajoamista. Julkaisussa: The Journal ofological chemistry. Osa 262, numero 2, tammikuu 1987, s. 785-794 , PMID 3805008 .
- ↑ a b c d e f g Thorsten Erbe: Aminohappoisomeerien kvantifiointi elintarvikkeissa käyttämällä kiraalista kaasukromatografiaa-massaspektrometriaa D-aminohappojen merkityksen ja muodostumismekanismin suhteen. Väitös, Justus Liebigin yliopisto Giessen, 1999.
- ↑ A.Paquet, M.Ching -Yung: Rasemisaation arviointi alkalilla käsitellyillä ravintoproteiineilla käyttäen korkean suorituskyvyn nestekromatografiaa. Julkaisussa: Ravitsemustutkimus. Osa 9, numero 9, 1989, s. 1053-1065. doi: 10.1016 / S0271-5317 (89) 80066-1 .
- ↑ a b c M. Friedman: D-aminohappojen kemia, ravitsemus ja mikrobiologia. Julkaisussa: Journal of Agriculture and food chemistry. Vuosikerta 47, numero 9, syyskuu 1999, s. 3457-3479, PMID 10552672 . (Arvostelu).
- ^ JP Richard, TL Amyes: Protonisiirto hiilellä. Julkaisussa: Nykyinen mielipide kemiallisesta biologiasta. Osa 5, numero 6, joulukuu 2001, s. 626-633, PMID 11738171 . (Arvostelu).
- ↑ JP Richard, TL Amyes: Kahtaisionisuuden tärkeydestä: dekarboksylaation entsymaattinen katalyysi ja kationisen hiilen deprotonoituminen. Julkaisussa: Bioorganic Chemistry. Osa 32, numero 5, lokakuu 2004, s. 354-366, doi: 10.1016 / j.bioorg.2004.05.002 . PMID 15381401 . (Arvostelu).
- ↑ a b c d Daniel Björn Stein: Epimerisaatioalueiden substraattispesifisyys ja toimivuus ei -ribosomaalisessa peptidisynteesissä. Väitös, Philipps University Marburg, 2006, s.29.
- ↑ S. Glavas, ME Tanner: Glutamaattirasemaasin aktiiviset kohdat. Julkaisussa: Biokemia. Osa 40, numero 21, toukokuu 2001, s. 6199-6204, PMID 11371180 .
- ↑ LM Fisher, JG Belasco et ai.: Proliinrasemaasin energia: siirtymätilan fraktiointitekijät kahdelle protonille, jotka osallistuvat katalyyttisiin vaiheisiin. Julkaisussa: Biokemia. Osa 25, numero 9, toukokuu 1986, s. 2543-2551, PMID 3521738 .
- ↑ Geoffrey Zubay: Elämän alkuperä: maan päällä ja kosmossa . Academic Press, 2000, ISBN 0-12-781910-X , s. 296 ( rajoitettu esikatselu Google-teoshaussa).
- ↑ a b c J. J. Corrigan: D-aminohapot eläimissä. Julkaisussa: Science. Osa 164, numero 3876, huhtikuu 1969, s.142-149, PMID 5774186 .
- ↑ E. Abderhalden : Fermentointitutkimus. Nide 16-17, S.Hirzel, 1942, s.301.
- ↑ HA -syöpä: Tutkimukset aminohappojen aineenvaihdunnasta eläimen kehossa. Julkaisussa: Hoppe-Seyler's fysiologisen kemian päiväkirja. Vuosikerta 217, 1933, s.1191.
- ↑ a b H. A. Krebs: Aminohappojen metabolia: Aminohappojen deaminointi. Julkaisussa: The Biochemical journal. Osa 29, numero 7, heinäkuu 1935, s.1620-1644, PMID 16745832 . PMC 1266672 (ilmainen koko teksti).
- ↑ a b H. Blaschko, J. Hawkins: D-aminohappooksidaasi nilviäisten maksassa. Julkaisussa: The Biochemical journal. Osa 52, numero 2, lokakuu 1952, s.306-310 , PMID 13018226 . PMC 1197987 (ilmainen koko teksti).
- ↑ F. Ehrlich : Hiivan epäsymmetrinen ja symmetrinen vaikutus luonnossa esiintyvien aminohappojen raseemisiin yhdisteisiin. Julkaisussa: Biochem Z. 63, 1914, s. 379-401.
- ↑ EO von Lippmann : Leusiinin ja tyrosiinin esiintymisestä juurikasmelassissa. Julkaisussa: Ber Dtsch Chem Ges. Volume 17, 1994, s. 2835-2840. doi: 10.1002 / cber.188401702243 .
- ^ S. Fraenkel, H. Gallia, A. Liebster, S. Rosen: Tietoja kaseiinin pitkäaikaisesta tryptisestä hajoamisesta. Julkaisussa: Biochem Z. Volume 145, 1924, s. 225-241.
- ↑ E. Winterstein, C. Reuter ja R. Korolew: Tietoja joidenkin sienien kemiallisesta koostumuksesta ja autolyysin aikana esiintyvistä tuotteista. Julkaisussa: Landw Versuchsstat. LXXIX - LXX, 1913, s.541-562.
- ↑ JH Birkinshaw, H. Raistrick, G. Smith: Studies in biokemian mikro-organismien: fumaryylidiketopiperatsiini-dl-alaniini (fumaromono-dl-alanide), aineenvaihduntatuote Penicillium resticulosum sp.nov. Julkaisussa: The Biochemical journal. Vuosikerta 36, numerot 10-12, joulukuu 1942, s. 829-835, PMID 16747516 . PMC 1266878 (ilmainen koko teksti).
- ↑ T. Robinson: D-aminohapot korkeammissa kasveissa. Julkaisussa: Biotieteet. Osa 19, numero 8, lokakuu 1976, s. 1097-1102 , PMID 792607 . (Arvostelu).
- ↑ JL Frahn, RJ Illman: D-alaniinin ja D-alanyyli-D-alaniinin esiintyminen Phalaris tuberosassa. Julkaisussa: Phytochem Volume 14, 1975, s. 1464-1465. doi: 10.1016 / S0031-9422 (00) 98674-6 .
- ↑ Y. Gogami, K. Ito et ai.: D-seriinin esiintyminen riisissä ja riisin seriinirasemaasin karakterisointi. Julkaisussa: Phytochemistry. Nide 70, numero 3, helmikuu 2009, s. 380-387, doi: 10.1016 / j.phytochem.2009.01.003 . PMID 19249065 .
- ↑ T.Ogawa, M.Fukuda, K.Sasaoka: N-malonyyli-D-alaniinin esiintyminen herneiden taimissa . Julkaisussa: Biochimica et Biophysica Acta . Osa 297, numero 1, tammikuu 1973, s.60-69 , PMID 4144329 .
- ↑ H. Brückner, S. Haasmann, A. Friedrich: D-aminohappojen kvantifiointi ihmisen virtsassa käyttämällä GC-MS: ää ja HPLC: tä. Julkaisussa: Amino Acids. Osa 6, 1994, s. 205-211. doi: 10.1007 / BF00805848 .
- ↑ EE Snell, BM Guirard: Jotkut pyridoksiinin, alaniinin ja glysiinin väliset suhteet niiden vaikutuksessa tiettyihin maitohappobakteereihin. Julkaisussa: PNAS. Osa 29, numero 2, 1943, s. 66-73, PMID 16588604 . PMC 1078561 (ilmainen koko teksti).
- ↑ J. Olivard, EE Snell: B6 -vitamiinianalogien kasvu ja entsymaattiset aktiivisuudet. I. D-alaniinisynteesi. Julkaisussa: The Journal ofological chemistry. Osa 213, numero 1, maaliskuu 1955, s.203-214, PMID 14353919 . PMC 1078561 (ilmainen koko teksti).
- ↑ EE Snell: B6 -vitamiiniryhmä: VII. Joidenkin mikro -organismien B6 -vitamiinin korvaaminen d ( -) - alaniinilla ja tunnistamattomalla kaseiinitekijällä. Julkaisussa: J Biol Chem. Volume 158, 1945, s. 497-503.
- ↑ Albert Gossauer: Biomolekyylien rakenne ja reaktiivisuus. John Wiley & Sons, 2003, ISBN 3-906390-29-2 , s. 347 ( rajoitettu esikatselu Googlen teoshaussa ).
- ^ WA Wood, IC Gunsalus: D-alaniinin muodostuminen; rasemase Streptococcus faecaliksessa. Julkaisussa: The Journal ofological chemistry. Osa 190, numero 1, toukokuu 1951, s.403-416, PMID 14841188 .
- ↑ J. Ju, H. Misono, K. Ohnishi: Bakteeristen alaniinis rasemaasien suunnattu kehitys, joilla on korkeampi ilmentymistaso. Julkaisussa: Journal of bioscience and bioengineering. Osa 100, numero 3, syyskuu 2005, s. 246-254, doi: 10.1263 / jbb.100.246 . PMID 16243272 .
- ↑ RJ Thompson, HG Bouwer et ai.: Listeria monocytogenes -kannan patogeenisyys ja immunogeenisyys, joka vaatii D-alaniinia kasvuun. Julkaisussa: Infektio ja immuniteetti. Vuosikerta 66, numero 8, elokuu 1998, s. 3552-3561, PMID 9673233 . PMC 108386 (ilmainen koko teksti).
- ↑ D.Bilot-Klein, L.Gutmann et ai.: Peptidoglykaanin esiasteiden muuttaminen on yhteinen piirre alhaisen tason vankomysiiniresistentille VANB-tyypin Enterococcus D366: lle ja luonnollisesti glykopeptidille resistentille lajille Lactobacillus casei, Pediococcus pentosaceus, Leuconostoc mesenteroides ja Enterococcus gallinarum. Julkaisussa: Journal of bakteriology. Vuosikerta 176, numero 8, huhtikuu 1994, s. 2398-2405, PMID 8157610 . PMC 205365 (ilmainen koko teksti).
- ↑ PE Reynolds, HA Snaith et ai.: Peptidoglykaanin esiasteiden analyysi vankomysiiniresistentissä Enterococcus gallinarum BM4174: ssä. Julkaisussa: The Biochemical journal. Vuosikerta 301, heinäkuu 1994, s. 5-8, PMID 8037690 . PMC 1137133 (ilmainen koko teksti).
- ↑ CA Arias, M. Martín-Martinez et ai.: VanT: n karakterisointi ja mallinnus: uusi, kalvoon sitoutunut, seriininen rasemaasi vankomysiiniresistentistä Enterococcus gallinarum BM4174: stä. Julkaisussa: Molecular microbiology. Osa 31, numero 6, maaliskuu 1999, s. 1653-1664, PMID 10209740 .
- ↑ a b Norma Christine Stäbler: Tutkimukset D-aminohappojen muodostumisesta Corynebacterium glutamicumin kanssa. Väitös, Heinrich Heinen yliopisto Düsseldorf, 2010, s.7.
- ↑ MF Freeman, C. Gurgui et ai.: Metagenome Mining paljastaa polyteonamideja posttranslationally Modified Ribosomal Peptides. Julkaisussa: Science. [sähköinen julkaisu ennen tulostusta] Syyskuu 2012, doi: 10.1126 / science.1226121 . PMID 22983711 .
- ↑ T.Hamada, S.Matsunaga et ai.: Polytheonamidi B: n, erittäin sytotoksisen ei -ribosomaalisen polypeptidin liuosrakenne meren sienestä. Julkaisussa: Journal of the American Chemical Society. Osa 132, numero 37, syyskuu 2010, s.12941-12945, doi: 10.1021 / ja104616z . PMID 20795624 .
- ↑ D. Ackermann , M. Mohr: Tietoja hain (Acanthias vulgaris) maksan typpipitoisista ainesosista. Julkaisussa: Z Biol. Nide 98, numero 37, 1937, s.26.
- ^ LR Lyle, JW Jutila: D-aminohappooksidaasin induktio sukusoluttomien hiirten munuaisissa. Julkaisussa: Journal of bakteriology. Vuosikerta 96, numero 3, syyskuu 1968, s.606-608, PMID 4389707 . PMC 252348 (ilmainen koko teksti).
- ↑ JL Auclair, RL Patton: D-alaniinin esiintymisestä maitokukkaron, Oncopeltus fasciatuksen, hemolymfassa. Julkaisussa: Revue canadienne de biologie. Osa 9, numero 1, huhtikuu 1950, s.3-8 , PMID 15417891 .
- ↑ a b Gianluca Molla, Luciano Piubelli et ai: D-aminohappojen entsymaattinen havaitseminen. Julkaisussa: Loredano Pollegioni, Stefano Servi (toim.): Luonnonvastaiset aminohapot. Vuosikerta 794, 2012, ISBN 978-1-61779-330-1 , s.273-289. doi : 10.1007 / 978-1-61779-331-8_18 .
- ↑ NG Srinivasan, JJ Corrigan, A.Meister: D-seriinin biosynteesi silkkiäistoukassa, Bombyx mori. (PDF; 665 kB) julkaisussa: The Journal ofological chemistry. Vuosikerta 240, helmikuu 1965, s. 796-800, PMID 14275137 .
- ↑ JJ Corrigan, NG Srinivasan: Tiettyjen D-aminohappojen esiintyminen hyönteisissä. Julkaisussa: Biokemia. Osa 5, numero 4, huhtikuu 1966, s. 1185-1190, PMID 5958195 .
- ↑ Y. Nagata, K. Yamamoto et ai.: Vapaan D-alaniinin, D-proliinin ja D-seriinin läsnäolo hiirissä. Julkaisussa: Biochimica et Biophysica Acta . Vuosikerta 1115, numero 3, tammikuu 1992, s. 208-211, PMID 1346751 .
- ↑ P.Melchiorri, L.Negri : Dermorfiinipeptidiperhe. Julkaisussa: Yleinen farmakologia. Vuosikerta 27, numero 7, lokakuu 1996, s. 1099-1107 , PMID 8981054 . (Arvostelu).
- ↑ A. Anastasi, V. Erspamer, JM Cei: n eristäminen ja aminohapposekvenssi physalaemin, tärkein aktiivinen polypeptidi ihon Physalaemus fuscumaculatus. Julkaisussa: Biokemian ja biofysiikan arkistot. Nide 108, marraskuu 1964, s. 341-348 , PMID 14240587 .
- ↑ Rebecca Jo Jackway: Biologisesti aktiiviset peptidit Australian sammakkoeläimiltä. Väitöskirja, Adelaiden yliopisto, 2008, s.165.
- ↑ kirjaimellisesti: Tällä hetkellä ei ole vakuuttavaa näyttöä D-aminohappojen esiintymisestä kasvien ja eläinten proteiineissa. Alton Meister: Aminohappojen biokemia Academic Press, 1965.
- ↑ M. Broccardo, V. Erspamer et ai.: Farmakologiset tiedot Demorfiinit, uuden luokan opioidin peptidien sammakkoeläinten ihon. Julkaisussa: British Journal of Pharmaology. Osa 73, numero 3, heinäkuu 1981, s. 625-631, PMID 7195758 . PMC 2071698 (ilmainen koko teksti).
- ^ V. Erspamer, P. Melchiorri et ai.: Deltorfiinit: perheen luonnossa esiintyviä peptidejä, joilla on korkea affiniteetti ja selektiivisyys delta opioidien sitoutumiskohdista. Julkaisussa: PNAS. Vuosikerta 86, numero 13, heinäkuu 1989, s. 5188-5192, PMID 2544892 . PMC 297583 (ilmainen koko teksti).
- ↑ M.Amiche, A.Delfour, P.Nicolas: Sammakon ihon opioidipeptidit. Julkaisussa: Pierre Jollès (Toim.): D-aminohapot monisoluisten organismien eritettyjen peptidien sekvensseissä. Springer, 1998, ISBN 3-7643-5814-9 , s. 57-72 ( rajoitettu esikatselu Googlen teoshaussa ).
- ↑ LH Lazarus, M. Attila: Ruma ja myrkyllinen rupikonna pitää ihossaan kallisarvoista jalokiveä. Julkaisussa: Edistyminen neurobiologiassa. Osa 41, numero 4, lokakuu 1993, s. 473-507, PMID 8210414 . (Arvostelu).
- ^ G. Kreil: Peptidit, jotka sisältävät D-aminohappoa sammakoista ja nilviäisistä. Julkaisussa: The Journal ofological chemistry. Vuosikerta 269, numero 15, huhtikuu 1994, s. 10967-10970, PMID 8157620 . (Arvostelu).
- ↑ SD Heck, WS Faraci et ai.: Translaation jälkeinen aminohappojen epimerisaatio: entsyymikatalysoitu aminohappotähteiden isomerointi peptidiketjuissa. Julkaisussa: PNAS. Osa 93, numero 9, huhtikuu 1996, s. 4036-4039, PMID 8633012 . PMC 39482 (ilmainen koko teksti).
- ↑ R.Liardon, R.Jost: vapaiden ja proteiineihin sitoutuneiden aminohappojen rasemoituminen vahvassa mineraalihapossa. Julkaisussa: International journal of peptide and protein research. Osa 18, numero 5, marraskuu 1981, s. 500-505, PMID 7341532 .
- ↑ H. Brückner, T. Westhauser, H. Godel: Nestekromatografia määrittäminen D- ja L-aminohappojen johdannainen o-ftaalidialdehydin ja N-isobutyryyli-L-kysteiini. Sovellukset, jotka viittaavat peptidisten antibioottien, toksiinien, lääkkeiden ja farmaseuttisesti käytettyjen aminohappojen analyysiin. Julkaisussa: Journal of chromatography. A. Nide 711, numero 1, syyskuu 1995, s. 201-215, PMID 7496491 .
- ↑ RH Buck, K. Krummen: Enantiomeeristen aminohappojen ja aminoalkoholien korkean suorituskyvyn nestekromatografinen määritys sen jälkeen, kun se on johdettu o-ftaalialdehydillä ja erilaisilla kiraalisilla merkaptaaneilla. Käyttö peptidihydrolysaateille. Julkaisussa: Journal of chromatography. Vuosikerta 387, tammikuu 1987, s. 255-265, PMID 3558624 .
- ^ A.Hashimoto, T.Nishikawa et ai.: Vapaan D-seriinin esiintyminen rotan aivoissa. Julkaisussa: FEBS -kirjaimet. Vuosikerta 296, numero 1, tammikuu 1992, s. 33-36, PMID 1730289 .
- ↑ a b N. W. Kleckner, R. Dingledine: Glysiinin vaatimus Xenopus-munasoluissa ilmenneiden NMDA-reseptorien aktivoinnissa. Julkaisussa: Science. Vuosikerta 241, numero 4867, elokuu 1988, s. 835-837, PMID 2841759 .
- ↑ a b H. Wolosker, S. Blackshaw, SH Snyder: Seriininen rasemaasi: gliaali Syntetisoiva entsyymi D-seriini glutamaatti-N-metyyli-D-aspartaatin neurotransmission säätelemiseksi. Julkaisussa: PNAS. Vuosikerta 96, numero 23, marraskuu 1999, s. 13409-13414, PMID 10557334 . PMC 23961 (ilmainen koko teksti).
- ↑ H. Wolosker, E. Dumin et ai.: D-aminohapot aivoissa: D-seriini neurotransmissiossa ja neurodegeneraatiossa. Julkaisussa: FEBS journal. Vuosikerta 275, numero 14, heinäkuu 2008, s.3514-3526 , doi: 10.1111 / j.1742-4658.2008.06515.x . PMID 18564180 . (Arvostelu).
- ↑ S. Sacchi, M. Bernasconi et ai.: PLG72 säätelee solunsisäisiä D-seriinitasoja vuorovaikutuksensa kautta D-aminohappooksidaasin kanssa: vaikutus skitsofreniaherkkyyteen. Julkaisussa: The Journal ofological chemistry. Vuosikerta 283, numero 32, 2008, s. 22244-22256, doi: 10.1074 / jbc.M709153200 . PMID 18544534 .
- ↑ HJ Ryu, JE Kim et ai.: D-seriinin ja seriinin rasemaasin mahdolliset roolit kokeellisessa ajallisen lohkon epilepsiassa. Julkaisussa: Journal of neuroscience research. Vuosikerta 88, numero 11, 2010, s. 2469-2482, doi: 10.1002 / jnr . 22415 . PMID 20623543 .
- ^ SA Fuchs, R. Berger, TJ de Koning: D-serine: oikea vai väärä isoformi? Julkaisussa: Brain research. Vuosikerta 1401, heinäkuu 2011, s. 104-117, doi: 10.1016 / j.brainres.2011.05.039 . PMID 21676380 . (Arvostelu).
- ↑ Julia Scharlau: Tutkimukset nuorten kroonisen kannabinoidihoidon vaikutuksista skitsofrenian hiirimalliin. (PDF; 827 kB) Väitöskirja, Friedrich-Wilhelms-Universität Bonn, 2012, s.16.
- ↑ E. Kartvelishvily, M. Shleper et ai.: Neuroniperäinen D-seriinin vapautuminen tarjoaa uuden keinon aktivoida N-metyyli-D-aspartaattireseptoreita. Julkaisussa: The Journal ofological chemistry. Vuosikerta 281, numero 20, toukokuu 2006, s. 14151-14162, doi: 10.1074 / jbc.M512927200 . PMID 16551623 .
- ↑ K. Miya, R. Inoue et ai.: Seriininen rasemaasi on pääasiassa lokalisoitu hiiren aivojen neuroneihin. Julkaisussa: The Journal of comparative neurology. Osa 510, numero 6, lokakuu 2008, s.641-654, doi: 10.1002 / cne.21822 . PMID 18698599 .
- ↑ L. Pollegioni, S. Sacchi: Neuromodulaattorin D-seriinin metabolia. Julkaisussa: Cellular and molecular science Sciences. Nide 67, numero 14, heinäkuu 2010, s. 2387-2404, doi: 10.1007 / s00018-010-0307-9 . PMID 20195697 . (Arvostelu).
- ↑ JT Kantrowitz, DC Javitt: N-metyyli-d-aspartaatti (NMDA) -reseptorin toimintahäiriö tai toimintahäiriö: viimeinen yhteinen polku skitsofrenian tiellä? Julkaisussa: Brain research bulletin. Osa 83, numero 3–4, syyskuu 2010, s. 108–121, doi: 10.1016 / j.brainresbull.2010.04.006 . PMID 20417696 . PMC 2941541 (ilmainen koko teksti). (Arvostelu).
- ↑ JT Coyle: Glutamaatti ja skitsofrenia: dopamiinihypoteesin ulkopuolella. Julkaisussa: Cellular and molecular neurobiology. Osa 26, numerot 4-6, 2006 heinä-elokuu, s. 365-384, doi: 10.1007 / s10571-006-9062-8 . PMID 16773445 . (Arvostelu).
- ↑ I. Chumakov, M. Blumenfeld et ai.: Geneettiset ja fysiologiset tiedot, jotka viittaavat uuteen ihmisen geeniin G72 ja D-aminohappooksidaasin geeniin skitsofreniassa. Julkaisussa: PNAS. Osa 99, numero 21, lokakuu 2002, s. 13675-13680, doi: 10.1073 / pnas.182412499 . PMID 12364586 . PMC 129739 (ilmainen koko teksti).
- ^ A. Corvin, KA McGhee et ai.: Todisteita assosiaatiosta ja epistaasista DAOA / G30- ja D-aminohappooksidaasilokkeissa irlantilaisessa skitsofrenianäytteessä. Julkaisussa: American journal of medical genetics. Osa 144B, numero 7, lokakuu 2007, s.949-953, doi: 10.1002 / ajmg.b.30452 . PMID 17492767 .
- ↑ T.Ohnuma, N.Shibata et ai.: Glysiiniin ja seriiniin liittyvien geenien assosiaatioanalyysi japanilaisessa skitsofreniapotilaiden populaatiossa. Julkaisussa: Edistyminen neuropsykofarmakologiassa ja biologisessa psykiatriassa. Vuosikerta 33, numero 3, huhtikuu 2009, s.511-518, doi: 10.1016 / j.pnpbp.2009.02.004 . PMID 19223009 .
- ↑ K.Hashimoto, T.Fukushima et ai.: D-seriinipitoisuuden lasku skitsofreniapotilailla: näyttöä skitsofrenian N-metyyli-D-aspartaattireseptorin hypofunktion hypoteesin tueksi. Julkaisussa: Yleisen psykiatrian arkistot. Osa 60, numero 6, kesäkuu 2003, s. 572-576, doi: 10.1001 / archpsyc.60.6.572 . PMID 12796220 .
- ↑ I. Bendikov, C. Nadri et ai.: CSF ja postmortem-aivotutkimus D-seriinin metabolisista parametreista skitsofreniassa. Julkaisussa: Skitsofreniatutkimus. Nide 90, numero 1–3, helmikuu 2007, s. 41–51, doi: 10.1016 / j.schres.2006.10.010 . PMID 17156977 .
- ↑ K. Hashimoto, G. Engberg et ai.: D-seriinin ja seriinin kokonaissuhteen pieneneminen huumeita käyttämättömien skitsofreniapotilaiden aivo-selkäydinnesteessä. Julkaisussa: Edistyminen neuropsykofarmakologiassa ja biologisessa psykiatriassa. Osa 29, numero 5, kesäkuu 2005, s. 767-769, doi: 10.1016 / j.pnpbp.2005.04.023 . PMID 15939521 .
- ↑ L. Verrall, M. Walker et ai.: D-aminohappooksidaasi ja seriinirasemaasi ihmisen aivoissa: normaali jakautuminen ja muuttunut ilmentyminen skitsofreniassa. Julkaisussa: European Journal of neuroscience. Osa 26, numero 6, syyskuu 2007, s.1657-1669 , doi: 10.1111 / j.1460-9568.2007.05769.x . PMID 17880399 . PMC 2121142 (ilmainen koko teksti).
- ↑ L.Verrall, PW Burnet et ai.: D-aminohappooksidaasin neurobiologia ja sen osallistuminen skitsofreniaan. Julkaisussa: Molecular psychiatry. Osa 15, numero 2, helmikuu 2010, s.122-137 , doi: 10.1038 / mp.2009.99 . PMID 19786963 . PMC 2811712 (ilmainen koko teksti). (Arvostelu).
- ↑ R. Kapoor, KS Lim et ai.: Alustava näyttö skitsofrenian ja NMDA-glysiinikohdan reseptoriligandin metabolisten entsyymien, d-aminohappooksidaasin (DAAO) ja kinureniiniaminotransferaasi-1: n (KAT-1) välisestä yhteydestä. Julkaisussa: Brain research. Nide 1106, numero 1, elokuu 2006, s. 205-210, doi: 10.1016 / j.brainres.2006.05.082 . PMID 16828464 .
- ↑ C. Madeira, ME Freitas et ai.: Lisääntynyt aivojen D-aminohappooksidaasin (DAAO) aktiivisuus skitsofreniassa. Julkaisussa: Skitsofreniatutkimus. Osa 101, numero 1-3, huhtikuu 2008, s. 76-83, doi: 10.1016 / j.schres.2008.02.002 . PMID 18378121 .
- ^ JT Coyle, G. Tsai, DC Goff: Ionotrooppiset glutamaattireseptorit terapeuttisina kohteina skitsofreniassa. Julkaisussa: Nykyiset lääkekohteet. Osa 1, numero 2, huhtikuu 2002, s. 183-189, PMID 12769626 . (Arvostelu).
- ↑ G. Tsai, P. Yang et ai.: D-seriini lisättiin psykoosilääkkeisiin skitsofrenian hoitoon. Julkaisussa: Biological psychiatry. Vuosikerta 44, numero 11, joulukuu 1998, s. 1081-1089, PMID 9836012 .
- ^ HJ Tuominen, J. Tiihonen, K. Wahlbeck: Glutamatergiset lääkkeet skitsofreniaan. Julkaisussa: Cochrane -tietokanta järjestelmällisistä arvioista (online). Numero 2, 2006, S. CD003730, doi: 10.1002 / 14651858.CD003730.pub2 . PMID 16625590 . (Arvostelu).
- ↑ DV Ferraris, T. Tsukamoto: Viimeaikaiset edistysaskeleet D-aminohappooksidaasin estäjien löytämisessä ja niiden terapeuttisessa hyödyllisyydessä skitsofreniassa. Julkaisussa: Nykyinen lääkemuotoilu. Osa 17, numero 2, 2011, s. 103-111, PMID 21361869 . (Arvostelu).
- ↑ CA Strick, C. Li et ai.: NMDA-reseptoritoiminnan modulointi estämällä D-aminohappooksidaasia jyrsijän aivoissa. Julkaisussa: Neuropharmacology. Osa 61, numero 5-6, 2011 loka-marraskuu, s. 1001-1015, doi: 10.1016 / j.neuropharm.2011.06.029 . PMID 21763704 .
- ↑ T. Sparey, P. Abeywickrema et ai.: Löytyminen fusedin pyrroli karboksyylihappojen uusina, voimakas D-aminohappo-oksidaasia (DAO) estäjät. Julkaisussa: Bioorgaanisen ja lääketieteellisen kemian kirjeet. Osa 18, numero 11, kesäkuu 2008, s. 3386-3391, doi: 10.1016 / j.bmcl.2008.04.020 . PMID 18455394 .
- ↑ Berry JF, Ferraris DV, Duvall B, et ai. : 1-hydroksi-1H-bentso [d] imidatsol-2 (3H) -onien synteesi ja SAR D-aminohappooksidaasin estäjinä . Julkaisussa: ACS Med Chem Lett . 3, nro 10, 2012, s. 839-843. doi : 10,1021 / ml 300212a . PMID 23243487 .
- ↑ Sacchi S, Rosini E, Pollegioni L, Molla G: D-aminohappooksidaasin estäjät skitsofreniahoidon uutena lääkeryhmänä . Julkaisussa: Curr. Pharm. Des. . 2012. PMID 23116391 .
- ↑ Paul P, de Belleroche J: D-aminohappojen rooli amyotrofisessa lateraaliskleroosin patogeneesissä: katsaus . Julkaisussa: Amino Acids . 43, nro 5, 2012, s. 1823-1831. doi : 10.1007 / s00726-012-1385-9 . PMID 22890612 .
- ↑ Sasabe J, Chiba T, Yamada M, et ai. : D-seriini on keskeinen glutamaattitoksisuuden määrittävä tekijä amyotrofisessa lateraaliskleroosissa . Julkaisussa: EMBO J .. 26, nro 18, 2007, s. 4149-4159. doi : 10.1038 / sj.emboj.7601840 . PMID 17762863 . PMC 2230675 (ilmainen koko teksti).
- ↑ DS Dunlop ja muut Neidle A: Vapaan D-asparagiinihapon esiintyminen jyrsijöillä ja ihmisillä. Julkaisussa: Biokemiallinen ja biofyysinen tutkimusviestintä. Osa 141, numero 1, marraskuu 1986, s.27-32 , PMID 3801000 .
- ↑ H.Wolosker, A.D'Aniello, SH Snyder: D-aspartaatin sijoitus hermosoluissa ja endokriinisissä kudoksissa: ontogeneesi, biosynteesi ja vapautuminen. Julkaisussa: Neuroscience. Vuosikerta 100, numero 1, 2000, s. 183-189, PMID 10996468 .
- ↑ M. Katane, H. Homma: D-aspartaatti oksidaasi: ainoa catabolic vaikuttavan entsyymin vapaa D-aspartaatti nisäkkäillä. Julkaisussa: Chemistry & biodiversity. Osa 7, numero 6, kesäkuu 2010, s. 1435-1449, doi: 10.1002 / cbdv.200900250 . PMID 20564562 . (Arvostelu).
- ↑ a b H. Ohide, Y. Miyoshi et ai.: D-aminohappojen metabolia nisäkkäissä: biosynteesi, hajoaminen ja metabolisen tutkimuksen analyyttiset näkökohdat. Julkaisussa: Journal of chromatography. B Nide 879, numero 29, marraskuu 2011, s. 3162-3168, doi: 10.1016 / j.jchromb.2011.06.028 . PMID 21757409 . (Arvostelu).
- ↑ a b P. M. Kim, X. Duan et ai.: Aspartaattirasemaasi, joka tuottaa neuronaalista D-aspartaattia, säätelee aikuisten neurogeneesiä. Julkaisussa: PNAS. Osa 107, numero 7, helmikuu 2010, s. 3175-3179, doi: 10.1073 / pnas.0914706107 . PMID 20133766 . PMC 2840285 (ilmainen koko teksti).
- ↑ Y. Mori, K. Aki et ai.: UV -B -säteilytys tehostaa aspartyylitähteiden rasemoitumista ja isomerointia ja Np -karboksimetyyllysiinin (CML) tuotantoa ihon keratiinissa. Julkaisussa: Journal of chromatography B. Volume 879, number 29, November 2011, s.3303-3309, doi: 10.1016 / j.jchromb.2011.05.010 . PMID 21636332 .
- ↑ N. Fujii, Y. Kaji et ai.: Aminohappojen homokiraalisuuden romahtaminen eri kudosten proteiineissa ikääntymisen aikana. Julkaisussa: Chemistry & biodiversity. Osa 7, numero 6, kesäkuu 2010, s.1389-1397, doi: 10.1002 / cbdv.200900337 . PMID 20564552 . (Arvostelu).
- ↑ N. Fujii: D-aminohappo ikääntyneissä kudoksissa. Julkaisussa: Biological & farmasiatiedote. Vuosikerta 28, numero 9, syyskuu 2005, s. 1585-1589, PMID 16141520 . (Arvostelu).
- ↑ Graham C.Barrett, Donald Trevor Elmore: aminohapot ja peptidit. Cambridge University Press, 1998, ISBN 0-521-46292-4 , s. 15-16 ( rajoitettu esikatselu Google-teoshaussa).
- ^ S.Ritz -Timme , MJ Collins: Asparagiinihapon rasemoituminen ihmisen proteiineissa. Julkaisussa: Ikääntymistutkimukset. Osa 1, numero 1, helmikuu 2002, s.43-59, PMID 12039448 . (Arvostelu).
- ↑ H. Mori, K. Ishii et ai.: Rasemisaatio: sen biologinen merkitys Alzheimerin taudin neuropatogeneesissä. Julkaisussa: Tohoku journal of experimental medicine. Vuosikerta 174, numero 3, marraskuu 1994, s. 251-262, PMID 7761990 .
- ^ R.Shapira, GE Austin, SS Mirra: Neuritinen plakin amyloidi Alzheimerin taudissa on erittäin rasemoitunut. Julkaisussa: Journal of neurokemia. Vuosikerta 50, numero 1, tammikuu 1988, s.69-74, PMID 3121789 .
- ↑ AE Raw, JD Lowenson u.: Rakenteelliset muutokset beeta-amyloidipohjaproteiinin peptidirungossa voivat vaikuttaa sen saostumiseen ja vakauteen Alzheimerin taudissa. Julkaisussa: The Journal ofological chemistry. Vuosikerta 268, numero 5, helmikuu 1993, s. 3072-3083, PMID 8428986 .
- ↑ a b T. Tomiyama, S. Asano et ai.: Asp23 -tähteen rasemoituminen vaikuttaa Alzheimerin amyloidi -beeta -proteiinianalogien aggregaatio -ominaisuuksiin. Julkaisussa: The Journal ofological chemistry. Vuosikerta 269, numero 14, huhtikuu 1994, s. 10205-10208, PMID 8144598 .
- ^ Patrick R.Hof, Charles V.Mobbs: Käsikirja ikääntymisen neurotieteestä. Academic Press, 2009, ISBN 0-12-374898-4 , s.41 ( rajoitettu esikatselu Google-teoshaussa).
- ↑ ML Moro, MJ Collins, E.Cappellini: Alzheimerin tauti ja amyloidi-beeta-peptidin kertyminen aivoihin: ikääntyminen? Julkaisussa: Biochemical Society tapahtumat. Osa 38, numero 2, huhtikuu 2010, s. 539-544, doi: 10.1042 / BST0380539 . PMID 20298218 . (Arvostelu).
- ^ Günter Westphal, Gerhard Gerber, Bodo Lipke: Proteiinit - ravitsevat ja toiminnalliset ominaisuudet. Springer, 2003 ISBN 3-540-00232-4 , s. 125 ( rajoitettu esikatselu Googlen teoshaussa ).
- ^ Gerhard G. Habermehl , Peter E. Hammann ja muut: Luonnollisten aineiden kemia. 3. painos, Springer, 2008, ISBN 3-540-73732-4 , s. 252 ( rajoitettu esikatselu Googlen teoshaussa ).
- ↑ NJ Benevenga, RD Steele: Aminohappojen liiallisen kulutuksen haittavaikutukset. Julkaisussa: Ravitsemuksen vuosikatsaus. Osa 4, 1984, s. 157-181, doi: 10.1146 / annurev.nu.04.070184.001105 . PMID 6235826 . (Arvostelu).
- ↑ J. Zagon, L.-I. Dehne, K.-W. Bögl: D-aminohapot organismeissa ja elintarvikkeissa. Julkaisussa: Nutr Res. Volume 14, 1994, s. 445-463.
- ↑ Werner Baltes , Reinhard Matissek : Lebensmittelchemie 7th edition, Springer, 2011, ISBN 3-642-16538-9 , s. 164 ( rajoitettu esikatselu Googlen teoshaussa ).
- ↑ W. Leuchtenberger, K. Huthmacher, K. Drauz: Aminohappojen ja johdannaisten biotekninen tuotanto: nykytila ja näkymät. Julkaisussa: Applied Microbiology and Biotechnology . Osa 69, numero 1, marraskuu 2005, s. 1-8, doi: 10.1007 / s00253-005-0155-y . PMID 16195792 . (Arvostelu).
- ^ FH Leibach, V. Ganapathy: Peptidikuljettajat suolessa ja munuaisissa. Julkaisussa: Ravitsemuksen vuosikatsaus. Osa 16, 1996, s. 99-119, doi: 10.1146 / annurev.nu.16.070196.000531 . PMID 8839921 . (Arvostelu).
- ↑ a b c M. Friedman: D-aminohappojen alkuperä, mikrobiologia, ravitsemus ja farmakologia. Julkaisussa: Chemistry & biodiversity. Osa 7, numero 6, 2010, s.1491-1530, doi: 10.1002 / cbdv.200900225 . PMID 20564567 . (Arvostelu).
- ^ W. Heine, K. Wutzke, U. Drescher: D-aminohappojen käyttö imeväisillä mitattuna 15N-merkkiaineella. Julkaisussa: Kliininen ravitsemus. Osa 2, numero 1, huhtikuu 1983, s.31-35 , PMID 16829405 .
- ↑ M.Friedman, R.Liardon : Aminohappotähteiden rasemisaatiokinetiikka alkalilla käsitellyissä soijapapuproteiineissa. Julkaisussa: J Agric Food Chem. Volume 33, 1985, s. 666-672.
- ^ JC Crawhall, DF Elliott: Huomautus seriinin rasemoitumisesta. Julkaisussa: The Biochemical journal. Osa 48, numero 2, helmikuu 1951, s.237-238 , PMID 14820833 . PMC 1275510 (ilmainen koko teksti).
- ↑ M. Lüpke, H. Brückner: Kaasukromatografinen arviointi aminohappojen epimerisaatiosta gelatiinin valmistuksen ja käsittelyn aikana. Julkaisussa: Journal for food research and research A. Vuosikerta 206, numero 5, 1998, s. 323–328. doi: 10.1007 / s002170050266 .
- ↑ Ravitsemusraportti 1996. German Society for Nutrition , 1996, ISBN 3-921606-33-0 , S. 149.
- ^ A b c Johannes Friedrich Diehl : Kemia elintarvikkeissa. John Wiley & Sons, 2012, ISBN 3-527-66084-4 , s. 95 ( rajoitettu esikatselu Googlen teoshaussa ).
- ↑ H.Lapierre, G.Holtrop et ai.: Onko lypsylehmälle D-metioniinin hyötyosuutta? Julkaisussa: Journal of milk science. Vuosikerta 95, numero 1, tammikuu 2012, s.353-362 , doi: 10.3168 / jds.2011-4553 . PMID 22192214 .
- ^ WH Fishman, C.Artom: Serine -vamma. Julkaisussa: J Biol Chem. Volume 145, 1942, s. 345-346.
- ^ RP Morehead, C. Artom, WH Fishman: Seriinin nefrotoksinen vaikutus. Julkaisussa: Proceedings. Amerikan kliinisen tutkimuksen liitto. Osa 2, 1945, s.81 , PMID 20275626 .
- ↑ FA Carone, CE Ganote: D-seriinin munuaistoksisuus. Proteiinian, glukosurian ja aminoasidurian luonne akuutissa tubulaarisessa nekroosissa. Julkaisussa: Patology Archives. Osa 99, numero 12, joulukuu 1975, s. 658-662, PMID 1203037 .
- ↑ RE Williams, EA Lock: D-seriinin aiheuttama munuaistoksisuus: mahdollinen vuorovaikutus tyrosiiniaineenvaihdunnan kanssa. Julkaisussa: Toxicology. Osa 201, numero 1-3, syyskuu 2004, s.231-238, doi: 10.1016 / j.tox.2004.05.001 . PMID 15297036 .
- ^ DR Peterson, FA Carone: Munuaisten uudistuminen d-seriinin aiheuttaman akuutin tubulaarisen nekroosin jälkeen. Julkaisussa: Anatomical record. Vuosikerta 193, numero 3, maaliskuu 1979, s.383-388, doi: 10.1002 / ar.1091930305 . PMID 426302 .
- ↑ CE Ganote, DR Peterson, FA Carone: D-seriinin aiheuttaman munuaistoksisuuden luonne. Julkaisussa: The American Journal of patology. Osa 77, numero 2, marraskuu 1974, s. 269-282, PMID 4447130 . PMC 1910915 (ilmainen koko teksti).
- ↑ MS Pilone, L. Pollegioni: D-aminohappooksidaasi teollisena biokatalyyttinä. Julkaisussa: Biokatalyysi ja biotransformaatio. Osa 20, numero 3, 2002, s.145-159. doi: 10.1080 / 10242420290020679 .
- ↑ AW Krug, K. Völker et ai.: Miksi D-seriinin nefrotoksinen ja alfa-aminoisovoihappo suojaavat? ( Memento of alkuperäisen tammikuusta 16, 2016 Internet Archive ) Info: arkisto yhteys oli lisätään automaattisesti, ei ole vielä tarkastettu. Tarkista alkuperäinen ja arkistolinkki ohjeiden mukaisesti ja poista tämä ilmoitus. Julkaisussa: American Journal of Physiology - Munuaisfysiologia. Osa 293, numero 1, 2007, s. F382-F390, doi: 10.1152 / ajprenal.00441.2006 . PMID 17429029 .
- ↑ G. Lubec, C. Wolf, B. Bartosch: Aminohapon isomerointi ja mikroaaltoaltistus. Julkaisussa: Lancet. Vuosikerta 334, numero 8676, joulukuu 1989, s. 1392-1393, PMID 2574327 .
- ^ Karl S. Kruszelnicki: Mikroaallot vahingoittavat ruokaa. Julkaisussa: ABC abcscience. 23. maaliskuuta 2006
- ^ W. Segal: Maidon lämmitys mikroaaltouunilla. Julkaisussa: Lancet. Vuosikerta 335, numero 8687, helmikuu 1990, s. 470, PMID 1968186 .
- ↑ Mikroaalloilla säteilytetyn veden vaikutus kasveihin. Haettu 24. elokuuta 2012.
- ↑ Vaaralliset mikroaallot. 24. lokakuuta 2008, käytetty 28. syyskuuta 2012.
- ↑ P. Fritz, LI Dehne, J. Zagon, KW Bögl: Kysymyksessä aminohappojen isomeroinnista mikroaaltokentällä: Tulokset mallikokeesta standardiliuoksilla. Julkaisussa: Journal of Nutritional Science. Osa 31, numero 3, 1992, s.219-224.
- ↑ LI Dehne, P.Fritz: Aminohappojen isomerointi mikroaaltokuumennuksella? Julkaisussa: Federal Health Gazette. Nide 35, 1992, s. 463-464.
- ↑ P.Sieber, P.Eberhardt, PU Gallmann: Maidon lämpökäsittely kotimaisissa mikroaaltouunissa. Julkaisussa: Int Dairy Journal. Osa 6, 1996, s. 231-246, doi: 10.1016 / 0958-6946 (95) 00009-7 .
- ↑ J. Zagon, L. Dehne, K.-W. Bögl: Aminohappojen isomerointi ruoassa. Osa I: Aminohappo -isomeroinnin mekanismit ja jakautuminen organismeissa ja elintarvikkeissa. Julkaisussa: Ravitsemuskatsaus. Nide 38, 1991, s. 275-278 ja 324-328.
- ↑ A.Cherkin, JL Davis, MW Garman: D-Proline: stereospesifisyys ja natriumkloridin riippuvuus tappavasta kouristustoiminnasta poikasessa. Julkaisussa: Farmakologia, biokemia ja käyttäytyminen. Osa 8, numero 5, toukokuu 1978, s. 623-625, PMID 674269 .
- ^ A. Schieber, H. Brückner et ai.: Evaluation of D-aminohappo-tasojen lisääntymiseen rotan kaasukromatografia-valitun ionin seurantaa massaspektrometria: ei näyttöä subakuutin toksisuuden suun kautta syötetään D-proliinia ja D-asparagiinihappo. Julkaisussa: Journal of chromatography. Vuosikerta 691, numero 1, maaliskuu 1997, s.1-12 , PMID 9140753 .
- ^ SN Ali, G.O'Toole, M. Tyler: Maitopullo palaa. Julkaisussa: The Journal of burn care & rehabilitation. Osa 25, numero 5, 2004, s. 461-462 , PMID 15353942 .
- ^ IA Jaffe, K. Altman, P.Merryman: Penisillamiinin antipyridoksiinivaikutus ihmisessä. Julkaisussa: The Journal of Clinical Investigation. Osa 43, lokakuu 1964, s. 1869-1873, doi: 10.1172 / JCI105060 . PMID 14236210 . PMC 289631 (ilmainen koko teksti).
- ↑ TN Schumacher, LM Mayr et ai.: D-peptidiligandien tunnistaminen peilikuvafaaginäytön avulla. Julkaisussa: Science. Vuosikerta 271, numero 5257, maaliskuu 1996, s. 1854-1857, PMID 8596952 .
- ↑ Katja Wiesehan: Alzheimerin amyloidi-β-peptidin (Aβ) spesifisen ligandin tunnistaminen ja karakterisointi. (PDF; 11,1 Mt) Väitös, University of Bayreuth, 2003, s.21.
- ↑ JM Manning, S.Moore: D- ja L-aminohappojen määrittäminen ioninvaihtokromatografialla LD- ja LL-dipeptideinä. Julkaisussa: The Journal ofological chemistry. Vuosikerta 243, numero 21, marraskuu 1968, s. 5591-5597, PMID 5699053 .
- ↑ K. Soda: D-aminohappojen ja D-aminohappooksidaasiaktiivisuuden mikrodeterminaatio 3, metyyli-2-bentsotiatsolonihydratsonihydrokloridilla. Julkaisussa: Analytical biokemia. Osa 25, numero 1, lokakuu 1968, s.228-235, PMID 4387536 .
- ↑ doi: 10.1002 / ardp.19863190515 .
- ↑ DL Kirschner, TK Green: D-aminohappojen erottaminen ja herkkä havaitseminen biologisissa matriiseissa. Julkaisussa: Journal of separation science. Osa 32, numero 13, heinäkuu 2009, s. 2305-2318, doi: 10.1002 / jssc.200900101 . PMID 19569111 . (Arvostelu).
- ↑ K. Hamase, A. Morikawa et ai.: Analyysi pienistä määristä D-aminohappoja ja niiden fysiologisten toimintojen tutkimus nisäkkäillä. Julkaisussa: Analytical sciences. Vuosikerta 25, numero 8, elokuu 2009, s. 961-968, PMID 19667471 . (Arvostelu).
- ↑ Clarissa Dorothee Marzini: Alfa-aminohappojen kvantitatiivisen enantiomeerianalyysin rajat. (PDF; 1,7 Mt) Väitöskirja, Eberhard-Karls-Universität Tübingen, 2007, s. 20–21.
- ↑ N. Nimura, T. Kinoshita: O-ftaalidialdehydi N-asetyyli-L-kysteiinin kiraalisen johdannaisen reagenssia nestekromatografia optinen resoluutio aminohapon enantiomeerien ja on sovellus tavanomaisen aminohapon analyysi. Julkaisussa: Journal of Chromatography A. Volume 352, 1986, s. 169-177. doi: 10.1016 / S0021-9673 (01) 83377-X .
- ↑ Birgit Geueke: Rhodococcus opacusin ja Arthrobacter protophormiaen uudet aminohappooksidaasit: Biokemiallisen karakterisoinnin, kloonauksen ja ilmentymisen tutkimukset. (PDF; 9,6 MB) Väitös, Heinrich Heinen yliopisto Düsseldorf, 2002, s.1.
- ↑ E. Takahashi, M. Furui et ai.: D-lysiinin tuotanto L-lysiinistä peräkkäisellä kemiallisella rasemoitumisella ja mikrobien epäsymmetrisellä hajoamisella. Julkaisussa: Applied Microbiology and Biotechnology . Nide 47, numero 4, huhtikuu 1997, s. 347-351, PMID 9163947 .
- ↑ K. Isobe, H. Tamauchi et ai.: Yksinkertainen entsymaattinen menetelmä monenlaisten D-aminohappojen tuottamiseksi käyttämällä Rhodococcus sp. AIU Z-35-1. Julkaisussa: Entsyymitutkimus. Vuosikerta 2010, 2010, s. 567210, doi: 10.4061 / 2010/567210 . PMID 21048866 . PMC 2962901 (ilmainen koko teksti).
- ↑ Kerstin Ragnitz: Hydantoinaasin ja LN -karbamoylaasin immobilisaatio ja stabilointi Arthrobacter aurescens DSM 3747: stä (PDF; 997 kB) Väitöskirja, Stuttgartin yliopisto, 2000, s.4 .
- ↑ Maailmanlaajuiset D-aminohappomarkkinat saavuttavat 3,7 miljardia dollaria vuoteen 2017 mennessä Global Industry Analysts, Inc : n uuden raportin mukaan. At: prweb.com, 25. elokuuta 2011.
- ↑ S. Martínez-Rodríguez, AI Martínez-Gómez et ai.: D-aminohappojen luonnollinen esiintyminen ja teolliset sovellukset: yleiskatsaus. Julkaisussa: Chemistry & biodiversity. Osa 7, numero 6, kesäkuu 2010, s.1531-1548, doi: 10.1002 / cbdv.200900245 . PMID 20564568 . (Arvostelu).
- ↑ a b Markus Werner: D-karbamoylaasin kloonaus Arthrobacter crystallopoietes DSM 20117. Väitöskirja, Stuttgartin yliopisto, 2001.
- ↑ B. Kutscher, M. Bernd: Kemia ja molekyylibiologia uusien LHRH -antagonistien etsinnässä. Julkaisussa: Angew Chem. Volume 109, numero 20, 1997, s. 2240-2254, doi: 10.1002 / ange.19971092005 .
- ↑ T.Beckers, M. Bernd et ai.: GnRH-reseptorin lineaaristen ja syklisoitujen peptidiantagonistien rakenne-toiminta-tutkimukset. Julkaisussa: Biokemiallinen ja biofyysinen tutkimusviestintä. Vuosikerta 289, numero 3, joulukuu 2001, s. 653-663, doi: 10.1006 / bbrc.2001.5939 . PMID 11726197 .
- ↑ Alaa A.-M. Abdel-Aziz, Yousif A.Asiri ja muut: Tadalafil. ( Memento of alkuperäisen joulukuusta 24 2012 in Internet Archive ) Info: arkisto yhteys oli lisätään automaattisesti, ja vielä tarkastettu. Tarkista alkuperäinen ja arkistolinkki ohjeiden mukaisesti ja poista tämä ilmoitus. (PDF; 4,4 Mt) julkaisussa: Harry G. Brittain (Toim.): Profiles of Drug Substances, Excipients and Related Methodology. Academic Press, 2011, ISBN 0-12-387702-4 , s. 287–329 ( rajoitettu esikatselu Google-teoshaussa).
- ↑ E. Fischer, B. Heller et ai.: Masennuksen hoito fenyylialaniinilla. Alustava huomautus. Julkaisussa: drug research. Osa 25, numero 1, tammikuu 1975, s.132 , PMID 1173765 .
- ^ S. Ehrenpreis: D-fenyylialaniini ja muut enkefalinaasin estäjät farmakologisina aineina: vaikutuksia joihinkin tärkeisiin terapeuttisiin sovelluksiin. Julkaisussa: Aine- ja alkoholitoimet / väärinkäyttö. Osa 3, numero 4, 1982, s.231-239 , PMID 6301083 .
- ↑ Mitchell Bebel Stargrove, Jonathan Treasure, Dwight L.McKee: Yrtti, ravinteet ja lääkkeet . Elsevier Health Sciences, 2008, ISBN 0-323-02964-7 , s. 682 ( rajoitettu esikatselu Googlen teoshaussa ).
- ^ Fenyylialaniinit. University of Maryland Medical Center, käytetty 21. syyskuuta 2012.
- ^ DL Williams: Eläinlääketieteellinen lähestymistapa eurooppalaiseen mehiläiseen (Apis mellifera) julkaisussa: Veterinary journal. Osa 160, numero 1, heinäkuu 2000, s. 61-73 , doi: 10.1053 / tvjl.2000.0474 . PMID 10950136 . (Arvostelu).