Hiilimonoksidi
| Rakenteellinen kaava | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
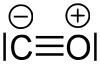
| ||||||||||||||||||||||
| Yleistä | ||||||||||||||||||||||
| Sukunimi | Hiilimonoksidi | |||||||||||||||||||||
| muut nimet |
|
|||||||||||||||||||||
| Molekyylikaava | CO | |||||||||||||||||||||
| Lyhyt kuvaus |
väritön ja hajuton kaasu |
|||||||||||||||||||||
| Ulkoiset tunnisteet / tietokannat | ||||||||||||||||||||||
| ||||||||||||||||||||||
| ominaisuudet | ||||||||||||||||||||||
| Moolimassa | 28,01 g mol - 1 | |||||||||||||||||||||
| Fyysinen tila |
kaasumainen |
|||||||||||||||||||||
| tiheys |
1,25 kg m −3 (0 ° C, 1013 mbar) |
|||||||||||||||||||||
| Sulamispiste |
-205,07 ° C |
|||||||||||||||||||||
| kiehumispiste |
−191,5 ° C |
|||||||||||||||||||||
| liukoisuus |
30 mg l -1 vedessä (20 ° C) |
|||||||||||||||||||||
| Dipolin hetki | ||||||||||||||||||||||
| turvallisuusohjeet | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
DFG / Sveitsi: 30 ml m −3 tai 35 mg m −3 |
|||||||||||||||||||||
| Toksikologiset tiedot | ||||||||||||||||||||||
| Termodynaamiset ominaisuudet | ||||||||||||||||||||||
| ΔH f 0 | ||||||||||||||||||||||
| SI -yksiköitä käytetään mahdollisuuksien mukaan ja tavanomaisesti . Ellei toisin mainita, annetut tiedot koskevat vakio -olosuhteita . | ||||||||||||||||||||||
Hiilimonoksidi (tekninen kieli hiilimonoksidi , yleisesti hiilimonoksidi ) on hiilen ja hapen kemiallinen yhdiste , jolla on empiirinen kaava CO. Hiilimonoksidi on väritön, hajuton, mauton ja myrkyllinen kaasu. Se johtuu muun muassa hiilipitoisten aineiden epätäydellisestä palamisesta ja riittämättömästä hapen saannista. Muodollisesti, kaasu on anhydridi ja muurahaishapon , mutta se ei juurikaan liukene veteen.
Hiilimonoksidi on syttyvää ja palaa hapella sinisessä, läpinäkyvässä liekissä muodostaen hiilidioksidia . Se on erittäin reaktiivinen korkeissa lämpötiloissa ja reagoi eri siirtymämetallien kanssa muodostaen metallikarbonyylejä . Hiilimonoksidi reagoi kanssa rikki , jolloin muodostuu karbonyylisulfidia , emäksellä hydroksidit ja formiaatit , ja halogeenit, kuten fluori tai kloori se reagoi muodostaen karboksyylihappohalogenidien, kuten karboksyylihappofluoridia tai fosgeenin . Hiilimonoksidi reagoi kanssa atsoyhdisteet muodostamiseksi isosyanaattien ja ammoniakin kanssa muodostaa myrkyllisiä formamidia . Synteesikaasun osana se reagoi Fischer-Tropsch-synteesissä muodostaen erilaisia hiilivetyjä ja niiden hapetustuotteita . Sitä käytetään myös metanolin ja isobutanolin synteesiin . Kaupunkikaasun osana sitä käytettiin Saksassa polttoaineena ja valaisevana kaasuna 1900 -luvun jälkipuoliskoon saakka .
Kaasu on myrkyllistä, koska se sitoutuu hemoglobiiniin voimakkaammin kuin happi ja estää siten hapen kulkeutumisen veren läpi. Hiilimonoksidimyrkytys on usein osa prosessia savun hengittämisen ja kaivoksen taudin jälkeen myrkyllisten kaasujen kaivos- ; se voi olla kohtalokas lyhyessä ajassa.
nimikkeistö
Peruutetussa saksalaisessa standardissa DIN 32640 "Kemialliset alkuaineet ja yksinkertaiset epäorgaaniset yhdisteet - nimet ja symbolit" joulukuussa 1986 suositellaan oikeinkirjoitusta "hiilimonoksidi" ja "oo", koska epäorgaanisen kemian nimikkeistöä koskevien IUPAC -sääntöjen mukaan etuliitteisten kreikkalaisten numeroiden vokaaleja ei voi jättää pois.
Sitä vastoin IUPAC -nimikkeistön vuoden 1990 painoksessa käytetään kirjoitusasua ”hiilimonoksidi”. Monikertaisten etuliitteiden käytöstä sanotaan: ”Moninkertaisten etuliitteiden viimeiset vokaalit eivät jää pois, ellei pakottavia kielellisiä syitä ole. Monoksidi on yksi tällainen poikkeus. "
tarina
Jo 1000 eaa Chr. Käytettiin sulatus metalli malmien , vähentää vaikutus hiilimonoksidin ns Rennöfen käyttää, mutta tietämättä kaasun laadusta. Kreikkalaiset ja roomalaiset käyttivät sitä teloituksiin . 1200 -luvun lopulla Arnaldus de Villanova kuvasi puun polttamisesta syntyvän kaasun myrkyllisyyttä; tarkoitettiin hiilimonoksidia. 1600 -luvun alussa Johan Baptista van Helmont kokeili kaasua nimeltä gas carbonum , hiilidioksidin ja hiilimonoksidin seosta .
Vuonna 1776, ranskalainen kemisti Joseph de Lassone tuotettu hiilimonoksidi kuumentamalla sinkkioksidia kanssa koksia . Hän oletti virheellisesti, että se oli vetyä. Joseph Priestley valmisti hiilimonoksidia vuonna 1799 johtamalla hiilidioksidia kuuman raudan päälle. William Cruickshank käytti samaa menettelyä vuonna 1800. Hän ehdotti CO: n oikeaa koostumusta. Claude Bernard tutki myrkyllisiä ominaisuuksia koirille noin vuonna 1846.
Valokaasujen kysyntä kasvoi 1800 -luvun alussa . Englannin hiilikaasuteollisuus alkoi kehittää prosesseja hiilen kaasuttamiseen tällä hetkellä . Kemianteollisuuden korkeapaineprosessien kehittyessä 1900-luvun alussa hiilimonoksidia sisältävien synteesikaasujen kysyntä kasvoi jyrkästi. Laaja hiilen kaasutus saavutettiin kehittämällä Winkler-generaattori , Lurgin painekaasutin ja myöhemmin Koppers-Totzek-reaktori .
Natsien aikana teloituksissa käytettiin hiilimonoksidia. In Action T4 , yli 70000 mielenterveyden ja fyysisiä vammoja systemaattisesti murhataan hiilimonoksidia 1940-1945 Saksassa.
Esiintyminen
Ilmakehän tapahtumat

Hiilimonoksidin keskimääräinen pitoisuus maan ilmakehässä on noin 90 miljardisosaa tilavuusosasta (englanninkielinen termi miljardiosa on miljardia osaa ; kun tilavuusosaa lisätään "v", tämä apuyksikkö lyhennetään yleensä "ppbv" "). Tunnelma on noin 400 mega tonnia (Mt) vuonna yhteensä . Vuonna pohjoisella pallonpuoliskolla , keskimääräinen pitoisuus on nykyään 140 ppbv ennen teollistumisen se oli noin 90 ppbv. Vuonna eteläisellä pallonpuoliskolla , keskimääräinen pitoisuus pysyi sen luonnollista tasolla 50 ppbv.
Satelliittimittari Terran Measurements Of Pollution In The Troposphere (MOPITT) loi ensimmäisen maailmanlaajuisen kartan alemman ilmakehän CO -pitoisuudesta. Liitteenä oleva MOPITT -luku esittää keskimääräisen CO -pitoisuuden huhti-, touko- ja kesäkuussa vuosina 2000-2004.
Hiilimonoksidin keskimääräinen käyttöikä ilmakehässä on noin kaksi kuukautta. Tärkein reaktio on se , että ilmakehässä on hydroksyyliradikaaleja , jotka hapetavat 2300 Mt (2000–2800 Mt) hiilimonoksidia hiilidioksidiksi vuosittain. Maapallot aiheuttavat noin 300 Mt (200–600 Mt) hiilidioksidin hapettumista vuosittain. Hapettumisnopeus riippuu hydroksyyliradikaalien pitoisuudesta, joka kasvaa voimakkaamman auringon säteilyn ja korkeamman vesihöyrypitoisuuden vuoksi. Tropiikissa elinikä on noin kuukausi, lauhkeilla ja pohjoisilla leveysasteilla se vaihtelee kahdesta kuukaudesta kesällä yli vuoteen talvella. Keskimääräinen ilmakehän elinikä olisi noin vuosi, jotta pohjoisen ja eteläisen pallonpuoliskon väliset hiilimonoksidipitoisuudet saadaan tasapainotettua. Suuremmat ihmisen aiheuttamat päästöt pohjoisella pallonpuoliskolla johtavat siksi merkittävään eroon pallonpuoliskojen välillä. Sääolosuhteiden, kuten Intian monsuunin ja pääkaupunkiseudun päästöjen , vuoksi pitoisuuksissa on huomattavia eroja alueellisesti, esimerkiksi Itä -Aasiassa .
Maailmassa ilmakehään vapautuu tai muodostuu vuosittain noin 2500 megatonnia (2000–2900 Mt) hiilimonoksidia. Noin puolet tästä johtuu fossiilisten polttoaineiden tai biomassan epätäydellisestä polttamisesta , mukaan lukien metsä- ja pensaspalot. Toinen suuri osa muodostuu vain ilmakehässä hapettamalla hiilivetyjä , kuten metaania tai muita haihtuvia orgaanisia yhdisteitä . Kaikkiaan noin 60% hiilimonoksidista on ihmisen aiheuttamaa, loput ovat luonnollista alkuperää.
Maailmanlaajuisia päästöasteita koskevat tiedot perustuvat arvioihin ja niihin liittyy epävarmuustekijöitä. Liikenteen hiilimonoksidipäästöt ovat 500 Mt (300–600 Mt), kiinteät järjestelmät energian tuottamiseksi fossiilisista polttoaineista päästtävät 100 Mt (80–200 Mt) ja biomassan polttaminen 600 Mt (300–800 Mt). Metaanin hapetus tuottaa 600 Mt (400–800 Mt), muiden haihtuvien orgaanisten yhdisteiden hajoaminen 500 Mt (300–700 Mt). Muut biogeeniset lähteet vapauttavat vuosittain noin 200 Mt (100–400 Mt), noin 30 Mt maaperää ja valtameret noin 10 Mt.
Maaperä voi olla sekä hiilimonoksidin lähteitä että nieluja. In kuivilla alueilla , maaperä hiilimonoksidia, oletettavasti kautta abioottisten hajoamisen orgaanisen aineen vaikutuksen alaisena valon ja korkeita lämpötiloja. Kuivien alueiden ulkopuolella vallitseva hajoaminen tapahtuu prokaryooteilla maaperän happi- ja vesipitoisuudesta riippuen joko pelkistämällä metaaniksi ( metaaninmuodostaja ) tai hapettamalla hiilidioksidiksi.
Valtameret ovat ylikyllästettyjä hiilimonoksidilla . Vuonna Atlantin valtameren , pitoisuus on noin kymmenen ja neljäkymmentä kertaa ilmakehän tasapainopitoisuus, jossa biologisista lähteistä oletetaan olevan vastuussa. Valtameret ovat siis ilmakehän hiilimonoksidin lähde, jonka osuuden arvioidaan olevan 5–29% palamisen yhteydessä vapautuvasta määrästä.
Havaijin tulivuorien kaasuista mitattiin 3700 ppm ( miljoonasosaa ) hiilimonoksidin pitoisuutta . Tulivuorilla ei ole merkitystä maailmanlaajuisessa tasapainossa.
Tärkein infrapuna-absorptio bändi hiilimonoksidia on klo aaltoluvulla on 2143 cm -1 ( aallonpituus noin 4,67 um ), ja näin ollen kaukana spektrin enintään maapallon infrapunasäteilyä , joka on aaltoluvulla noin 1000 cm -1 (10 µm). Hiilimonoksidilla on siten vähäinen vaikutus kasvihuoneilmiöön suoran imeytymisen kautta . Vuonna troposfäärin , hapettuminen hiilivetyjä, kuten metaania hiilidioksidiksi myös tapahtuu hydroksyyliradikaaleja. Metaanin hapetus tuottaa myös hiilimonoksidia välituotteena. Hiilimonoksidin vaikutus kasvihuoneilmiöön liittyy sen merkitykseen näiden hydroksyyliradikaalien nieluina, jotka eivät siksi ole enää käytettävissä välittömien kasvihuonekaasujen , kuten metaanin, muuntamiseen . Myös metanoli , ilmakehän toiseksi runsaimman orgaanisen kaasun mukainen metaani, jota esiintyy 0,1-10 ppbv: n pitoisuuksina , on merkittävä ilmakehän lähde hiilimonoksidille, jossa suurin osa metanolista päästetään kasveista.
In kaupunkiympäristössä , käsittelemätön auton pakokaasujen voi aiheuttaa arvojen välillä 100 ja 200 ppm. Pitoisuus hiilimonoksidin laimentamattoman pakokaasun auto ilman katalysaattoria on noin 7000 ppm. Ajoneuvoissa, joissa on kolmitie katalysaattori ja oikein asetettu lambda-anturiohjaus , hiilimonoksidia käytetään ihanteellisesti typen oksidien vähentämiseen , jolloin se itse hapetetaan hiilidioksidiksi. Korkeiden pakokaasulämpötilojen ja siihen liittyvän Boudouardin tasapainon säätämisen vuoksi bensiinimoottorilla varustettujen henkilöautojen pakokaasut sisältävät aina tietyn määrän hiilimonoksidia. Raja-arvo on 1000 ppm on määritetty , että päästöstandardit Euro 5 ja 6 , ajoneuvoihin, joissa on dieselmoottoreiden raja-arvo on 500 ppm. Yhdysvalloissa yli puolet troposfäärin hiilimonoksidipäästöistä vuonna 2002 johtui ajoneuvojen käytöstä, noin 61 117 miljoonasta tonnista. Suurkaupunkialueilla ajoneuvojen pakokaasu aiheutti noin 75% kaikista hiilimonoksidipäästöistä. Näiden liikkuvien lähteiden hiilimonoksidipäästöt ovat vähentyneet noin 5% vuodessa 1990 -luvun alusta lähtien.
Hiilimonoksidi, typpioksidit ja haihtuvat hiilivetyyhdisteet ovat edeltäjämolekyylejä otsonin (O 3 ) muodostumiselle troposfäärissä. Otsonin muodostuminen tapahtuu hapettamalla typpimonoksidi (NO) typpidioksidiksi (NO 2 ) peroksiradikaaleilla , joita muodostuu esimerkiksi hiilimonoksidin hapetuksen aikana. Nämä reagoivat hyvin nopeasti olemassa olevan typpimonoksidin kanssa muodostaen typpidioksidia. Otsonia syntyy kautta fotolyysin typpidioksidia.
Hiilimonoksidin jakautuminen, lähteet ja nielu eroavat troposfäärin ja stratosfäärin välillä . Stratosfäärissä ydinreaktiot muodostavat jatkuvasti hiili -isotoopin 14 C , esimerkiksi kun typpi -isotooppi 14 N, joka on ylivoimaisesti yleisin typpi -isotooppi , osuu neutroniin. Jos neutroni otetaan talteen ja protoni erotetaan, 14 N -ytimestä tulee 14 C -ydin. Syntynyt hiili hapetetaan ensin hiilimonoksidiksi. Viipymisaika hiilimonoksidin stratosfäärissä riippuu, muun muassa, on konsentraatio hydroksyyliradikaaleja , jolla se hapettuu hiilidioksidiksi.
Esiintyminen rakennuksissa
In asuinrakennusten , normaali konsentraatio on 0,5-5 ppm, ja pitoisuuden ollessa enintään 15 ppm läheisyydessä kaasupolttimia . Hiilimonoksidin tiheys on 96,5% ilman tiheydestä , joten se on hieman kevyempi. Jos savupiipun vetoa on riittävästi , muodostunut hiilimonoksidi nousee nopeasti lämpimän pakokaasun mukana savupiipun läpi, jos hiili palaa epätäydellisesti. Jos puulämmitteisen savupiipun veto on huono , hiilimonoksidi voi päästä huoneilmaan ja johtaa myrkytykseen. Pakokaasun takaisinvirtaukseen tai sen riittämättömään poistamiseen on monia syitä. Esimerkiksi tuuli, vanhentuneet tai huonosti säädetyt ja huolletut kattilat, kytketty vetokaappi tai päällä oleva keskuspölynimurijärjestelmä voivat aiheuttaa vastapainetta, mikä voi johtaa savukaasujen takaisinvirtaukseen. Vuotavat savupiiput ja uunit, väärin mitoitetut savupiiput tai savi- tai savupiiput, jotka ovat tukossa esimerkiksi ampiaisten tai lintujen pesien kautta , voivat estää riittävän pakokaasun poistamisen. Muista lähteistä hiilimonoksidin olo- ovat grillit puuhiilellä, puu tulipalot, tai toimintaa säteilylämmittimet poltetaan kanssa propaania . Kohlenstoffmonoxidquellen voi olla myös kaasuliesi , puupelletteistä peräisin olevat päästöt pellettien polttoaineissa, autojen pakokaasut liitteenä olevista autotalleista ja käyttö polttomoottorikäyttöisillä ilmastuslaitteilla ja generaattoreilla.
Tupakansavu sisältää huomattavia määriä hiilimonoksidia. Kymmenen savustettua savuketta lisää noin 22 ppm hiilimonoksidin pitoisuutta tuulettamattomassa, 30 m³: n huoneessa.
Maan ulkopuoliset tapahtumat
Hiilimonoksidi on myös laajalti in avaruusolento tilaa, ulkopuolella maan ja sen ilmakehään. Se on luotu siellä, kun paljon harvinaisempia hiili hiilidioksidi reagoi kanssa atomien ja molekyylien vety , jolloin muodostuu vettä ja hiilimonoksidia. On olemassa myös useita muita muodostumisen reaktioita, kuten reaktio hiilen kationien hydroksyyliradikaalien muodostamiseksi hiilimonoksidia ja protoni .
Hiilimonoksidi on havaittu , että photosphere on Sun ja tunnelmia Venus , Mars , Jupiter , Saturnus , Titan , Uranus, ja Neptune . Hiilimonoksidipitoisuus Venusian ilmakehässä on noin 50 ppm, Marsin ilmakehässä mitattiin 700 ppm. On ulompi aurinkokunnan , hiilimonoksidi on toiseksi yleisin komponentti on äärimmäisen ohut ilmapiiri planetoidiksi Pluto . Hiilimonoksidia on havaittu myös eksoplaneettojen ilmakehässä .
Giotto -avaruusalus mitasi Halleyn komeetan kaasupäästöissä 10% hiilimonoksidia. Hiilimonoksidia havaittiin myös muiden komeettojen, kuten Hyakutake , Hale-Bopp ja Schwassmann-Wachmann 1, päästöissä . Nämä havainnot johtivat siihen johtopäätökseen, että hiilimonoksidi oli tärkeä hiilen lähde aurinkokunnan muodostumisen aikana. In esihistoriasta aurinkokunnan, enemmän monimutkaisia orgaanisia molekyylejä, kuten hiilivedyt ja rasvahapot muodostettu hiilimonoksidin ja vedyn kautta Fischer-Tropsch-tyypin reaktiot , jotka voivat liittyä elämän alkuperää.
Tärkeä päästöjen rivi tähtienvälisten hiilimonoksidin esiintyvien on molekyyli- pilviä on klo aallonpituus on 2,6 mm, ja se on enimmäkseen viritetään törmäykset vedyllä molekyylejä. Hiilimonoksidin infrapuna- ja radiovalvontaa molekyylipilvissä käytetään siksi tähtienvälisen vetypitoisuuden epäsuoraan määrittämiseen. Oletetaan, että hiilimonoksidin ja vedyn suhde on vakio. Rotational siirtymät hiilimonoksidin ovat tehokas mekanismi lämpöenergian muuttamiseksi mikroaaltouuni ja infrapunasäteilyn ja ovat yksi tärkeä jäähdytys mekanismeja molekyyli pilviä. Nämä energiahäviöt helpottavat olosuhteita molekyylipilven painovoiman romahtamiselle molekyylipilven riittävän tiheillä alueilla , mikä voi johtaa tähtien muodostumiseen . Vedyn läsnäolon indikaattorina hiilimonoksidi on yksi tutkituimmista tähtienvälisistä molekyyleistä. Mittaamalla hiilimonoksidin kiertosiirtymien punaista siirtymää voidaan määrittää sen jakautuminen ja kinematiikka galaktisen päiväntasaajan tasossa .
Poiminta ja esittely
Hiilimonoksidia voidaan saada lukuisista hiilipitoisista raaka -aineista, kuten B. voidaan tuottaa maakaasua , biokaasua , kevyttä bensiiniä , raskaita öljyjä , hiiltä tai biomassaa . Jos raaka -aine on hiili tai koksi, ensimmäinen generaattorikaasu (sisältää noin 25% CO: ta N 2: n lisäksi ), vesikaasu (CO: H 2 noin 1: 1) tai synteesikaasu (CO: H 2 noin 1: 2) syntyy, joka puhdistetaan ja käsitellään. Raaka -aineena oleva metaani johtaa halkeilevaan kaasuun (CO: H 2 noin 1: 3). Tärkeimpiä teollisia prosesseja ovat hiilen kaasutus , höyryä reformointi ja osittaista hapetusta hiilivetyjen.
Hiilen kaasutus
Hiilen kaasutus tapahtuu niin sanotuissa generaattoreissa, jotka voivat tuottaa generaattorikaasua, vesikaasua tai synteesikaasua prosessin ohjauksesta riippuen. Käytetyt generaattorityypit ovat erilaisia ja eroavat muun muassa kivihiilen syöttötyypistä, kuonan poistosta, käytetyistä hiileistä ja niiden raekokoista . Lisäksi napauttamalla generaattori , kiinteän arinan generaattori ja pyörivä arina generaattori , The Winkler generaattori , Lurgi paine kaasuttimen ja Koppers-Totzek reaktoria käytetään , viimeiset kolme pääasiassa käytetään tuotantoon synteesikaasun. Kaasujen lisäksi savua tuottavissa generaattoreissa saadaan myös tervaa ja hiilivetyillä rikastettuja kaasuja.
Veden ja synteesikaasun tuotanto
Koksi kaasutetaan korkeassa lämpötilassa saattamalla se reagoimaan vesihöyryn ja ilman tai edullisesti hapen kanssa. Kaasun koostumus voidaan määrittää prosessinhallinnan avulla. Ilman (kuplajakso tai yksinkertaisesti "kuplat") ja vesihöyryn (kaasujakso tai "kaasut") vuorotellen syntyy vesikaasua, jolloin käytetään vain vesihöyryn reaktion aikana syntynyttä kaasua. Ilman käyttö palvelee koksin kuumaa puhallusta hehkulamppuun , jolloin saadaan tarvittava energia endotermiseen vesikaasureaktioon. Jos generaattoreita käytetään jatkuvasti ilman tai hapen ja veden kanssa, synteesikaasu on päätuote.
Järjestelmän energiasisällön muutos, entalpia , ilmaistaan symbolilla , jolloin endotermiset reaktiot ovat sopimuksen mukaan positiivisia. Eksponentti nolla tarkoittaa vakio -olosuhteita (100 kPa ja 25 ° C). Kun taas entalpia osoittaa, onko prosessi on eksoterminen tai endoterminen muutos on Gibbsin energian aikana kemiallinen reaktio on ratkaiseva kriteeri, onko muuntaminen aineiden mukana todella tapahtuu vapaaehtoisesti.
Pääreaktio on endoterminen heterogeeninen vesikaasureaktio:
Tämä liittyy hiilen eksotermiseen palamiseen:
Mukana on myös muita reaktioita. Tärkeimmät ovat Boudouardin tasapaino
ja homogeeninen vesikaasureaktio ( vesikaasun siirtoreaktio )
Generaattorikaasun tuotanto
Generaattorikaasu syntyy koksin epätäydellisellä palamisella. Tätä varten ilma johdetaan hiilikerroksen läpi ja poltetaan aluksi hiilidioksidiksi ylimääräisessä ilmassa. Hiilidioksidi reagoi sitten hiilen kanssa muodostaen hiilimonoksidia korkeissa lämpötiloissa. Generaattorikaasun koostumus on noin 70% typpeä, 25% hiilimonoksidia ja 4% hiilidioksidia. Kaasu sisältää myös vetyä, metaania ja happea.
Höyryuudistus
Hiilimonoksidia, voidaan valmistaa käsittelemällä maakaasua tai valoa öljy tuotetaan vesihöyryä jakeet, esimerkiksi metaani mukaan
tai yleensä sen jälkeen
Höyryreformoinnin päätuote on vety. Endoterminen reaktio tapahtuu nikkelikatalyyttien läsnä ollessa 700 - 1100 ° C: n lämpötiloissa. Reaktio on palautuva .
Hiilivetyjen osittainen hapettuminen
Kanssa osittaisen hapetuksen , lähtöaine, esimerkiksi raskasta polttoöljyä, hapetetaan rajoitettu määrä happea, jolloin muodostuu vetyä ja hiilimonoksidia. Terminen ja katalyyttinen osittainen hapetus erotetaan toisistaan. Tapauksessa termisen osittaisen hapetuksen, reaktion lämpötila on noin 1200 ° C, katalyyttisissä prosesseissa, riippuen katalyytin, noin 800-900 ° C:
Laboratorioasteikko

Laboratoriossa voidaan tuottaa tasainen hiilimonoksidivirta tiputtamalla muurahaishappoa lämpimään, väkevään rikki- tai fosforihappoon :
Koska hiilimonoksidi on erittäin myrkyllistä, ylimäärä on kerättävä erityisillä absorboijilla tai poltettava liekkilaitteella . Erityistä varovaisuutta on noudatettava käytettäessä hiilimonoksidin ja ilman seoksia, koska ne voivat reagoida räjähdysmäisesti . On myös mahdollista muuttaa hiilimonoksidi katalyyttisesti kupari (II) oksidilla tai hopkaliitilla hiilidioksidiksi.
Hiilimonoksidin erottaminen
Jos tuotteeksi halutaan puhtaita kaasuja, edellä kuvattu kaasuseos on erotettava. Monissa sovelluksissa sitä vastoin tarvitaan synteesikaasua suoraan; tässä tapauksessa vain hiilimonoksidin ja vedyn välistä suhdetta on säädettävä tarpeen mukaan. Hiilimonoksidi voidaan erottaa seuraavilla tavoilla:
- Käännettävä kompleksointi kupari-alumiinisuoloilla korotetussa paineessa; alennetussa paineessa hiilimonoksidi vapautuu jälleen.
- Kondensaatio alhaisissa lämpötiloissa
- Paineen heilahduksen adsorptio
- Puoliläpäisevät kalvot
ominaisuudet
Fyysiset ominaisuudet
Hiilimonoksidi on väritön ja hajuton kaasu, jonka moolimassa on 28,01 g / mol. 1,25 kg / m³: n tiheys on lähes sama kuin ilman. Kiehumispiste -191 ° C ja sulamispiste -205 ° C ovat lähellä isoelektronisen (katso alla) typen arvoja, jonka kiehumispiste on -196 ° C ja sulamispiste -210 ° C.
Kolminkertainen kohta , jossa kolme vaihetta kiinteiden, nestemäisten ja kaasumaisten ovat tasapainossa on lämpötilassa -205,0 ° C ja paineessa 0,154 bar . Kriittinen lämpötila on -140,2 ° C: ssa, kriittinen paine on 35,0 bar, kriittinen tiheys on 0,301 g / cm.
Jäähtyessään, hiilimonoksidi aluksi muodostaa kiinteän aineen, epäjärjestyksessä, kuusikulmainen β-vaihe, joka, kun jäähdytettiin edelleen alle 61,6 K, muuttuu järjestetyn α-vaihe, joka on kidekuution järjestelmä on tilaa ryhmä P 2 1 3 (space ryhmä nro 198) kiteytyi. Yli 52 000 baarin suurissa paineissa muodostuu kiinteitä, vaaleita, kellertäviä tai punaisia, metastabiileja polykarbonyylifaaseja, joiden tarkkaa rakennetta ei vielä tunneta.
Hiili ja happi ovat erittäin tiukasti sidoksissa toisiinsa hiilimonoksidimolekyylissä. Dissosiaatio energia on hieman suurempi kuin hyvin inertin dityppioksidin molekyyli , joka on isoelektronisia hiilen hiilimonoksidia , ja on 1070,3 kJ / mol. Typpimolekyylin N 2 jakamiseen tarvitaan vain 946 kJ / mol.
Massaan liittyvä lämpöarvo on 10,1 MJ / kg, mikä on noin viisi kertaa vähemmän kuin metaanilla. Tilavuuslämpöarvo ja bruttolämpöarvo ovat 12 636 kJ / m³, joten ne ovat vetyalueella. Syttymislämpötila on 605 ° C Sytytys alue on 12,5-75 tilavuus-% hiilimonoksidia ilmassa.
Molekyyliominaisuudet
Sidos pituus välillä hiili- ja happiatomien on 106 pm kiinteässä faasissa ja 112,8 pm kaasufaasissa. Kahden annetun atomin välinen etäisyys on noin 20 pm pienempi, jos ne on kytketty kaksoissidoksella yksittäisen sidoksen sijasta .
Saat kolmoissidoksen , etäisyys on vielä kaksikymmentäkaksi pienempi kuin kaksoissidoksen. Hiili-happisidos , joka on noin 10 μm lyhyempi kuin orgaanisen karbonyyliyhdisteen hiili-happi-kaksoissidos , esimerkiksi formaldehydin tapauksessa , osoittaa siten kolmoissidoksen.
Molekyylirakenne kuvataan parhaiten käyttämällä molekyyliradan teoriaa . Niiden sääntöjen mukaan syntyvien molekyylien orbitaalien määrä on yhtä suuri kuin mukana olevien atomien kiertoradat . Hiilimonoksidin kahdeksan molekyylin orbitaalit muodostuvat neljästä hiilen ja hapen atomiradalla. Miehitetty molekyyliorbitaali korkeimman energian (HOMO) muodostaa antibonding σ s * kiertoradan. Vasta -sitoutuvilla orbitaaleilla suurin todennäköisyys, että elektronit sijaitsevat, ei ole mukana olevien ytimien välissä. Tämän seurauksena positiivisesti varautuneiden atomiytimien torjuminen ei ole suojattu. Molekyylin orbitaaleja kutsutaan siksi vasta -aineiksi. Käyttämättömät pienimmän energian molekyylipallot (LUMO) ovat vastakkaisia π x, y * -orbitaaleja .
Perustilassa molekyyli on singletti , mikä tarkoittaa, että molekyylissä ei ole parittomia elektroneja. Lewisin rakennekaavassa positiivinen muodollinen varaus esiintyy happiatomissa ja negatiivinen muodollinen varaus hiiliatomissa:
Koska sitoutumiskumppaneiden välillä on suuri elektronegatiivisuusero 1, tämä muodollinen varaus on jälleen tasapainossa ja hiilimonoksidi on siten lähes ei-polaarinen. Sen dipolimomentti on vain μ = 0,10980 D , jolloin dipolimomentti on suunnattu siten, että happiatomi kantaa positiivisen varauksen.
Kemiallisia ominaisuuksia
Muodostumista hiilimonoksidia elementit on eksoterminen ja sijaitsee disproportionaatiolla tasapainossa , jossa hiili- ja hiilidioksidia. Koska tämä tasapaino on melkein mittaamattoman hidas huoneenlämmössä , hiilimonoksidi voidaan eristää epäsuotuisasta tasapainotilasta huolimatta - hiilimonoksidi on metastabiili . Korkeammissa lämpötiloissa tasapaino siirtyy hiilimonoksidin hyväksi ( LeChatelierin periaate ). Tätä käytetään esimerkiksi raudan tuotannossa masuuniprosessissa , jossa kaasumainen hiilimonoksidi on paljon tehokkaampi pelkistin kuin kiinteä koksi . Teollisissa prosesseissa hiilimonoksidi voi myrkyttää katalyyttejä, koska se sitoutuu voimakkaasti aktiivisiin metallikeskuksiin, kuten nikkeli- tai rautaatomeihin, ja estää niitä muiden reagoivien aineiden varalta.
Hiilimonoksidi on hyvä ja edullinen pelkistin, ja sitä käytetään tässä toiminnassa monin tavoin. Hapetusvoima on kuitenkin vain heikko. In organometallikemiassa , hiilimonoksidi on yksihampainen ligandi , joka on usein käytetty , ja kemia Metallikarbonyylit on hyvin tutkittu. Se on yksi voimakkaista kenttäligandeista ja on isoelektroninen typelle (N 2 ) sekä syanidi (CN - ) ja nitrosyyli (NO + ) -ioneille . Vahva metalli-ligandiside luodaan kehittämällä synergisesti vahvistavia edestakaisin sidoksia. Hiilimonoksidi on vahva σ -luovuttaja ja π -vastaanottaja . Se siirtyy kompleksien alkyylimetallisidoksissa muodostaen asyyliryhmiä .
Jossa aromaatit , kuten bentseeni , hiilimonoksidi reagoi kloorin kanssa alumiinikloridia tai kupari (I) kloridia katalyysiin Gattermann-Koch reaktio , jolloin muodostuu bentsaldehydiä . Hiilimonoksidi reagoi voimakkaiden pelkistävien aineiden, kuten metallikaliumin, kanssa muodostaen heksahydroksibentseenin kaliumsuolan tai dihydroksiasetyleenin kaliumsuolan .
käyttää
Hiilimonoksidia käytetään usein kemianteollisuudessa yhdessä vedyn kanssa synteesikaasuna . Joissain sovelluksissa, kuitenkin, puhdasta hiilimonoksidia tarvitaan myös, esimerkiksi tuotantoa varten Metallikarbonyylit kuten nikkelitetrakarbonyylin tai rautapentakarbonyylin , sillä karbonylointeihin tai tuotannon ruoanlaittoon happojen . Tuotannon fosgeenin , etikkahappoa ja etikkahappoanhydridiä ja tuotannon metyyliformiaattia ja muurahaishappoa myös edellyttää puhdasta hiilimonoksidia.
Puhdasta hiilimonoksidia saadaan pääasiassa synteesikaasusta fysikaalisten tai kemiallisten erotusprosessien avulla. Fyysinen erottaminen tapahtuu osittaisella kondensaatiolla ja sitä seuraavalla tislauksella Linde -prosessin mukaisesti tai kalvon läpäisevyydellä . Mukaan adsorptio kanssa kompleksin muodostumista, hiilimonoksidi voidaan erottaa muista komponenteista synteesikaasun avulla kupari (I) suolaliuoksia.
Kemianteollisuudessa käytettävä hiilimonoksidi tuotetaan enimmäkseen paikan päällä ja käsitellään edelleen itse. On myös mahdollisuus toimittaa säiliöaluksella tai kaasupulloissa . Kemiallisten kohteiden verkottamiseksi jakelu putkistojen kautta on mahdollista. Tällaisten putkilinjojen rakentamishankkeita, kuten Bayer AG: n CO -putkea , kritisoidaan usein ja ne voivat johtaa pitkiin hallinnollisiin riita -asioihin.
Synteesikaasureaktiot
Metanolin tuotanto
Metanoli on orgaaninen peruskemikaali ja laajamittainen laajamittainen alkoholi . Tuotanto hiilimonoksidista ja vedystä tapahtuu seuraavan bruttoyhtälön mukaisesti:
Vuonna 2008 maailmanlaajuinen metanolin kulutus oli 45 miljoonaa tonnia. Nykyään metanolia tuotetaan teollisessa mittakaavassa synteesikaasusta matala- tai keskipaineprosessissa. Tuloksena oleva raaka metanoli on osittain saastunut sivutuotteilla. Jos raakaa metanolia käytetään polttoaineena energiasektorilla, raa'an metanolin puhtaus on riittävä. Kemianteollisuuden jatkokäsittelyä varten metanoli on käsiteltävä tislaamalla. Matalalla kiehuvat komponentit, kuten dimetyylieetteri, erotetaan matalalla kiehuvaan pylvääseen. Korkeammalla kiehuvat jakeet erotetaan pohjiksi seuraavassa tislausvaiheessa korkealla kiehuvassa pylväässä, ja metanolia poistetaan ylhäältä.
Fischer-Tropsch-synteesi
Fischer-Tropsch-synteesissä hiilimonoksidi-vetyseos muunnetaan heterogeenisen katalyysin avulla . Katalyytit perustuvat siirtymämetalleihin koboltti , rauta , nikkeli ja ruteniumi ; kantajina käytetään huokoisia metallioksideja, joilla on suuret erityispinnat, kuten piimaa , alumiinioksidi , zeoliitit ja titaanidioksidi .
Kaasuseos muuttuu hiilivedyiksi , kuten parafiiniksi , olefiineiksi ja alkoholeiksi kertymisreaktiossa . Lopputuotteita ovat bensiini ( synteettinen bensiini ), diesel , lämmitysöljy ja kemianteollisuuden raaka -aineet. Reaktio tapahtuu jopa ilmakehän paineessa ja 160-200 ° C: n lämpötilassa; prosessista riippuen käytetään teknisesti korkeampia paineita ja lämpötiloja. Synteesi etenee seuraavan reaktiokaavion mukaisesti:
- ( Alkaanit )
- (n ≥ 2, alkeenit )
- ( Alkoholit )
Jokainen kilogramma polttoainetta tuottaa noin 1,25 kiloa vettä, jonka tuotantoon käytetään noin puolet vedystä. Tyypillinen Fischer-Tropsch-tuote sisältää noin 10–15% nestekaasuja ( propaania ja butaania ), 50% bensiiniä, 28% kerosiinia (dieselöljyä), 6% pehmeää parafiinia (löysä parafiini) ja 2% kovia parafiineja. Prosessi on tärkeä suuren mittakaavan tuotantoon bensiinin ja öljyt päässä hiiltä , maakaasua tai biomassasta .
Hydroformylaatio
Yhdessä vedyn kanssa hiilimonoksidia käytetään olefiinien hydroformylointiin . Tuloksena olevat tuotteet ovat pääasiassa aldehydejä , lähinnä metallikarbonyylihydridejä, joita käytetään katalyytteinä homogeenisissa tai heterogeenisissä reaktioissa.
Teknisesti tärkeä hydroformyloinnin tuote ja sitä seuraava hydraus on 2-etyyliheksanoli . Pehmittimen di- n- oktyyliftalaattia voidaan valmistaa 2-etyyliheksanolista ja ftaalihappoanhydridistä .
Reagoi orgaanisten molekyylien ja veden kanssa
Muurahaishappo ja sen johdannaiset
Puhdasta hiilimonoksidia käytetään muurahaishapon valmistukseen vedestä ja metanolista metyyliformiaativaiheen kautta . Katalyyttinä käytetään natriummetoksidia . Ensimmäisessä vaiheessa kulutettu metanoli vapautuu uudelleen hydrolyysillä toisessa vaiheessa . Ensimmäinen tämän tyyppinen laitos otettiin käyttöön vuonna 1981 ja tuotti 100 000 tonnia vuodessa. Vuonna 2012 BASF : n maailmanlaajuinen tuotantokapasiteetti tätä prosessia käyttäen oli 255 000 tonnia vuodessa.
Kanssa natriumhydroksidia , natrium- formaatti on saatu, jota käytetään raaka-aineena tuotannossa oksaalihapon .
Monsanto ja Tennessee Eastman -kokeet
Reagoimalla hiilimonoksidi metanolin kanssa käyttämällä rodiumkarbonyyliseoksia , etikkahappoa saadaan Monsanto -prosessissa . Tämä jalostetaan edelleen vinyyli- ja selluloosa -asetaatiksi sekä kemianteollisuuden välituotteiksi.
Etikkahappoanhydridi on muodostettu läpi karbonylointi ja metyyliasetaatin , että Tennessee-Eastman prosessi .
Toista kemia
Hiilimonoksidia käytetään karbonylointireaktioihin orgaanisessa synteesissä. Reppe -kemian ymmärretään tarkoittavan työskentelyä asetyleenin kanssa korotetussa paineessa, jolloin metallikarbonyyliä ja vetykarbonyyliä käytetään katalyytteinä. Tärkeä reaktio on hydrokarboksylaatio , jossa asetyleeniä käytetään hiilimonoksidin ja veden tai alkoholin kanssa akryylihapon ja akryylihappoesterien tuottamiseksi:
Keittohapot
Tertiääriset karboksyylihapot , niin kutsutut Koch-hapot, muodostuvat hiilimonoksidin Koch-reaktiosta alkoholien tai alkeenien ja veden kanssa happokatalyysissä korkeissa paineissa ja korkeissa lämpötiloissa.
Kemianteollisuus tuottaa noin 150 000 tonnia ruokahappoja vuodessa. Jotkut Koch-hapot, joita tuotetaan usein teollisesti, ovat pivaliinihappo , 2,2-dimetyylivoihappo ja 2,2-dimetyylipentaanihappo .
Metallikarbonyylit
Hiilimonoksidi reagoi siirtymämetallien kanssa muodostaen metallikarbonyylejä . Nämä ovat monimutkaisia yhdisteitä , joissa hiilimonoksidi toimii ligandina . Näissä yhdisteissä esiintyy metalleja, joiden hapetusluku on nolla. Ludwig Mond onnistui syntetisoimaan ensimmäisen homoleptisen metallikarbonyylikompleksin, nikkeli -tetrakarbonyylin , jo vuonna 1890. Seuraavina vuosina hän onnistui syntetisoimaan useita muita metallikarbonyylejä, kuten rauta -pentakarbonyyliä , dikoboltti -oktakarbonyyliä ja molybdeeniheksakarbonyyliä . Monilla organometallikemian aloilla kemistit käyttävät metallikarbonyylejä avainkomponenteina, esimerkiksi kemiallisten sidosten ja organometallikompleksien kohdennetun synteesin tutkimiseksi.
Metallikarbonyyliä käytetään myös orgaanisessa synteesissä ja katalysaattoreina tai katalyytin esiasteina kemianteollisuudessa . Hiilimonoksidi ligandi voidaan korvata muilla, räätälöityjä ligandit, kuten vesiliukoiset tris (natrium meta sulfonaattofenyyli) fosfaanin , ja näin erityisesti sovitettu vaatimusten teknisistä menetelmistä, kuten Ruhrchemie / Rhône-Poulenc prosessi .
Fosgeenin tuotanto
Fosgeeni on valmistettu hiilimonoksidista ja klooria alle katalyyttisen vaikutuksen aktivoitua hiiltä :
Fosgeeni on tärkeä lähtöaine metyleenidi-isosyanaattien ja tolueeni-2,4-di-isosyanaatin valmistuksessa . Se reagoi diolien kanssa polykondensaation kanssa muodostaen polykarbonaatteja .
Pelkistävä aine
Että masuunin se toimii pelkistimen varten rautamalmin mukaisesti brutto kaava:
Hiilimonoksidia ei lisätä kaasuna, vaan se syntyy masuunissa koksin palamisen ja sitä seuranneen Boudouard -reaktion seurauksena sekä kuuman koksin reaktiossa veden kanssa vapauttaen hiilimonoksidia ja vetyä. Pelkistämällä rautamalmeja ja rautaa sisältävien oksidien mangaania , piitä ja fosforia hiilimonoksidi hapetetaan dioksidiksi.
Pelkistetyn raudan absorboi hiiltä hiilimonoksidin ja tulee Fe 3 C, ns sementiittiä , joka aiheuttaa sulamispiste putoamisen 1538 ° C: sta noin 1300-1400 ° C: ssa
Masuunin ylävirtaan kuumat masuunit , jotka kerääntyvät kaasun hiilimonoksidiin, palavat:
Kuun prosessi ja karbonyylirauta
Kuu prosessi käyttää hiilimonoksidin puhdistamiseksi metalli nikkeli muodostumista ja hajoaminen nikkelitetrakarbonyylin on kemiallinen liikenteen reaktio . Prosessin kehitti Ludwig Mond vuonna 1890 . Menetelmä soveltuu puhtaan nikkelimetallin valmistamiseen nikkelioksideista. Ensimmäisessä vaiheessa oksidit pelkistetään metalliksi vedyllä ja muutetaan sitten haihtuvaksi metallikarbonyylinikkelitetrakarbonyyliksi 40 - 60 ° C: ssa hiilimonoksidin kanssa . Tämä voidaan tislata pois muista malmin ainesosista. 150 - 300 ° C: n lämpötiloissa metallikarbonyyli hajoaa jälleen puhtaaseen metalliin ja hiilimonoksidiin. Tähän liittyvää prosessia voidaan käyttää karbonyyliraudan valmistamiseen rautapentakarbonyylistä .
Ruokateknologia
Lihaa ja kalaa käsiteltäessä voidaan saavuttaa voimakas punaisen lihan väri pienellä hiilimonoksidipitoisuudella. Hiilimonoksidin ja myoglobiinin sitoutuminen luo kirsikanpunaisen karboksimyoglobiinikompleksin . Tämä simuloi visuaalisesti raikkautta, jota ei enää ole . Baselin kantonin laboratorio on jo osoittanut nitriitin käytön tonnikalassa korvikkeena . Hiilimonoksidi suojakaasupakkauksen osana ei ole sallittua Euroopan unionissa.
Muut käyttötarkoitukset
Adsorboitua hiilimonoksidia käytetään monin tavoin heterogeenisten koskettimien ja muiden pintojen karakterisoinnissa . Lisäksi määritetään dispersio ja aktiivisen metallin keskusten kautta kemisorptio , tutkimukset adsorboituneen hiilimonoksidia käyttäen pinta-herkkiä menetelmiä käytetään teollisuuden ja perustutkimuksen on puolijohde tekniikka , polttokenno ja materiaalien tutkimukseen . In orgaanisen kemian tutkimuksessa hiilimonoksidin ligandien avulla infrapunaspektroskopialla tarjoaa monenlaisia tietoja, esimerkiksi noin sitoutumisen moodit hiilimonoksidin, monimutkainen geometria ja kompleksin varausta. Heteroleptisten metallikarbonyylien tapauksessa infrapunaspektroskopia antaa myös tietoa ligandin trans -hiilimonoksidiin ominaisuuksista ja sitoutumisolosuhteista .
In turkistarhoilla , hiilimonoksidia ja hiilidioksidia käytetään tukahduttaa minkki , niin että turkin on vaurioitunut niin vähän kuin mahdollista.
Kaupunki kaasu , joka on tuotettu aikana koksauksessa on kivihiilen , koostui noin 9-10% hiilimonoksidia. Koksaamalla saatiin noin 350 m³ raakakaasua kivihiilitonnia kohti . Kaasun pesun jälkeen se varastoitiin kaasumittariin ja haistettiin difosfaanilla ennen sen vapauttamista kaasuverkkoon. Kaupunkikaasua käytettiin alun perin katuvalaistukseen kaasulampujen avulla , joten nimi valovoima tulee . Noin vuodesta 1910 lähtien sitä käytettiin ruoanlaittoon ja lämmitykseen yksityiskodeissa. 1970-luvulla kaupungin kaasu korvattiin suurelta osin myrkyttömällä maakaasulla .
Natsien aikana hiilimonoksidia käytettiin ensimmäistä kertaa toiminnan T4 joukkomurhissa eutanasian ja "arvottoman elämän tappamisen" yhteydessä, jossa murhattiin pääasiassa mielisairaita ihmisiä. Joillakin natsien tuhoamisleireillä, esimerkiksi Majdanekin keskitysleirillä , hiilimonoksidia käytettiin myöhemmin joukkomurhiin kaasukammioissa tai kaasuautoissa (joko polttomoottorin pakokaasujen osana tai paineistettujen kaasupullojen puhtaana CO: na).
myrkyllisyys
Yleistä

Hiilimonoksidi on vaarallinen hengitysmyrkky, koska se imeytyy helposti keuhkojen läpi. Koska kaasu on väritöntä, hajutonta, mautonta ja ärsyttämätöntä , se on tuskin havaittavissa. Yksilöllinen toleranssi vaihtelee. Vuosien varrella on tapahtunut toistuvia näyttäviä onnettomuuksia hiilimonoksidiin, kuten Balvanon rautatieonnettomuus (1944) tai Kelloggin kaivosonnettomuus (1972), joista osa johti satojen kuolemantapauksiin.
Kun se on tullut verenkiertoon keuhkojen kautta, se sitoutuu hemoglobiinin keskusrautatomiin ja estää siten hapen kuljetuksen veressä, mikä voi johtaa kuolemaan tukehtumisesta . Lievän myrkytyksen oireita ovat päänsärky , huimaus ja flunssan kaltaiset oireet. Suuremmat annokset ovat merkittävästi myrkyllisiä keskushermostolle ja sydämelle. Hiilimonoksidi aiheuttaa yli puolet kaikista kuolemaan johtaneista myrkytyksistä maailmassa. Vuonna Yhdysvalloissa , vuosina 1979 ja 1988, yli 56000 ihmistä kuoli häkämyrkytyksen, jossa on yli 25000 tapausta itsemurha myrkytys, tutkimuksen mukaan . Yli 15 000 tapausta liittyi tulipaloon ja yli 11 000 tapausta oli tapaturmaisia, ei-palokuolemia. Autojen pakokaasujen tahattomien myrkytysten määrä vähenee jyrkästi kolmitiekatalysaattorien laajan käytön vuoksi . Siitä huolimatta Yhdysvalloissa tapahtunut hiilimonoksidimyrkytys ilman tulipaloa johti noin 15 000 sairaalahoitoon ja 500 kuolemaan vuonna 2011. Saksassa on ollut velvollisuus ilmoittaa hiilimonoksidimyrkytyksestä 1. elokuuta 1990 lähtien. Tästä päivästä 31. joulukuuta 2008 Federal Institute for Risk Assessment sai yli 57 000 lääketieteellistä raporttia myrkytyksestä tai epäillyistä tapauksista, eli noin 3000 vuodessa.
vaikutus
Hiilimonoksidilla peitetyn hemoglobiinin prosenttiosuutta veressä lyhennetään myös nimellä COHb (hiilimonoksidi -hemoglobiini) . Vanhempien tutkimusten mukaan terveille aikuisille ei ole vaaraa , vaikka altistuminen jatkuisi kahdeksan tuntia päivässä pitoisuuksilla jopa 115 ppm ; on olemassa vain pitoisuus on 4% COHb tupakoimattomilla ja 7,6% tupakoitsijoita . Viimeaikaiset tutkimukset osoittavat kuitenkin, että riskiryhmissä, joilla on sydän- ja verisuonitauteja , 2,7% tai enemmän stressitasot voivat lisätä taudin oireita. Jos krooninen altistus on suurempi kuin 150–300 ppm, esiintyy huimausta, uneliaisuutta, pahoinvointia ja oksentelua. Katso akuutin tappavan kaasun määrät ( LC 50 ) infokentästä (yllä). Kuurous lisääntyy jopa 50%, kun se altistuu hiilidioksidille. Muut lähteet, jotka viittaavat uudempiin tutkimuksiin, olettavat kuitenkin, että 2–5% COHb -arvot johtavat jo ensimmäisiin oireisiin. Esimerkiksi 2% COHb häiritsee ajattelua tuskin havaittavasti . Kun COHb -arvot ovat alle 20%, väsymystä, päänsärkyä , sydämentykytystä ja näköhäiriöitä esiintyy. Oireita, kuten uneliaisuutta , huimausta ja lihasheikkoutta tunnetaan alueella 20-30% . 30–50% COHb: tä esiintyy pahoinvointia , oksentelua , keskittymishäiriöitä , korvien soimista , tajunnan menetystä ja verenkierron romahtamista . Iho muuttuu vaaleanpunaiseksi. Kun COHb -arvo on 50%, esiintyy syvää tajuttomuutta, johon liittyy kouristuksia ja hengitysvaikeuksia. Silloin on olemassa vakava hengenvaara. Kuolema tapahtuu, kun COHb -pitoisuus on 60-70%. Noin 85% hengitetystä hiilimonoksidista sitoutuu vereen, loput 15% sitoutuu myoglobiiniin kirsikanpunaisena karboksymoglobiinina .
Yksilölliseen hiilimonoksidinsietoon vaikuttavat eri tekijät, kuten suoritettu aktiivisuus, hengitysnopeus , aiemmat vauriot tai sairaudet ( verenkierto , anemia tai sirppisoluanemia ). Muita tekijöitä ovat ilmanpaine tai perusaineenvaihdunta .
Hiilimonoksidi sitoutuu noin 250-325 kertaa enemmän punasolujen pigmentti hemoglobiini kuin happi , klo Kohlenstoffmonoxidanteil 0,1% hengitys ilmassa niin noin puoli punaisten verisolujen on poistettu käytöstä. Hiilimonoksidin myrkyllistä vaikutusta heikentää hemoglobiinin hemen proteiiniympäristö , joten hiilimonoksidi sitoutuu esteettömään hemiin noin 26 000 kertaa voimakkaammin kuin happi. Syyksi oletetaan, että entsyymitaskussa ei ole tarpeeksi tilaa hiilimonoksidin suosiman lineaarisen Fe - CO -geometrian sallimiseksi, mutta dioksigeenin suosima kulmakoordinaatio ei ole estetty. Kun ilmanpitoisuus on noin 0,5 tilavuusprosenttia, kuolema tapahtuu muutamassa minuutissa. Hiilimonoksidin eliminaation puoliintumisaika verestä on 2-6,5 tuntia riippuen imeytyneen hiilimonoksidin määrästä ja henkilön ilmanvaihtonopeudesta.
Seurauksena oleva vahinko
Akuutin myrkytyksen lisäksi on seurauksena vahinkoja. Hiilimonoksidilla on vakavia kielteisiä vaikutuksia sikiön kehitykseen. Pitkäaikainen altistuminen alhaisille hiilimonoksidipitoisuuksille voi johtaa masennukseen . Keskimäärin yli 100 ppm: n altistumista pidetään terveydelle vaarallisena. Työhygieenistä raja-arvo (HTP - aiemmin: MAK-arvo) on 30 ppm. Hiilimonoksidi voi lyhentää elinikää sydämen vaurioitumisen vuoksi. Ammatillinen hiilimonoksidimyrkytys on tunnustettu ammattitaudiksi . Liittovaltion työ- ja sosiaaliministeriön raporttien mukaan vuosina 2005–2008 raportoitiin vuosittain noin 126 hiilimonoksidin aiheuttamaa sairautta.
Diagnoosi
Sitomalla hiilimonoksidin hemoglobiiniin tavanomaiset pulssioksimetrit huijataan ja osoittavat virheellisesti korkeat happisaturaatiot. Uudemmilla 7-aallonpituisilla pulssioksimetreillä voidaan kuitenkin myös havaita CO-kyllästetty fraktio hemoglobiinista. Hiilimonoksidimyrkytyksen ulkoiset merkit ovat kirsikanpunaiset limakalvot . Uusimpien tutkimusten mukaan, joissa on paljon tapauksia (231 potilasta), tätä kliinistä merkkiä esiintyy harvoin, erityisesti lievemmissä myrkytysmuodoissa. Väri johtuu syvänpunaisesta hemoglobiinin hiilimonoksidin varauksensiirtokompleksista . Lisäksi ruumiin kuoleman jälkeen ilmestyvät kuolleet täplät (eläimet) voidaan myös värjätä kirkkaan punaiseksi tällä mekanismilla ja siten ilmaista hiilimonoksidimyrkytys.
hoito
Potilaat, joilla on vakava hiilimonoksidimyrkytys, intuboidaan ja tuuletetaan yleensä positiivisella vuorovesipaineella ( PEEP ) ja 100% hapella . Merkittävästi lisääntyneen hapensaannin vuoksi hemoglobiini syrjäyttää hiilimonoksidin. Hyperbaric hapetus voidaan harkita.
Puoli-elämän , jolla lisääntynyt CO-pitoisuus veressä (CO- Hb -arvo) putoaa uloshengityksen raitista ilmaa on noin 3-8 tuntia. Puoliintumisaikaa voidaan lyhentää pakotetulla happihoidolla (hyperventilaatio puhtaalla hapella orotrakeaalisen intubaation avulla) jopa 45 minuuttiin.
Biologinen merkitys
henkilö
Ihmisillä hiilimonoksidilla päällystetyn hemoglobiinin COHb -osuus veressä on laskimoverissä 0,7-1,1%, josta noin 0,5% tuotetaan endogeenisesti . Lisääntynyt hiilimonoksidin taso soluissa, kanssa johtaa jopa 1000-kertaisesti lisääntynyttä vapautumista ja glykoproteiinin erytropoietiinin (EPO) .
Lähettäjän aine
Entsyymi hemioksygenaasi rakentaa hemin yhdisteitä, pääasiassa hemoglobiinin peräisin, vapauttaa hiilimonoksidia. Tämä entsyymi ja guanylaattisyklaasi , jota hiilimonoksidi säätelee, voitaisiin havaita ihmisen aivojen haistokeskuksessa ja hajusipulissa . Tämän, hiilimonoksidi voisi olla kaasumainen messenger aine (katso gasotransmitter ) ja hajuaistin. Aktivoitu guanylaattisyklaasi vapauttaa toissijaisen lähettäjä -aineen cGMP: n . Hiilimonoksidin, cGMP: n ja cAMP: n lisäksi typpioksidia pidetään myös toisena viestinvälittäjänä . Sekä typpeä ja hiilimonoksidia, kuten erittäin pienen molekyylipainon vesiliukoisia kaasuja, voi tunkeutua biomembraanien hyvin nopeasti ja suhteellisen esteettömän ja sen vuoksi toimia välittäjäaineiden lähetyksessä tietoja ensisijainen tai sensorinen , että toissijainen tai pitkäaikainen muisti kautta limbinen järjestelmä .
Tulehdusta estäviä ominaisuuksia
Hiilimonoksidilla on tulehdusta ehkäisevä vaikutus krooniseen suoliston tulehdukseen, mikä selittää aiemmin hämmentävän tosiasian, että tupakoitsijat kehittävät paljon vähemmän haavaista paksusuolitulehdusta kuin tupakoimattomat. Jopa keuhkosiirtojen jälkeen hiilimonoksidin pieni annoshengitys estää iskemian tai reperfuusion aiheuttamat vauriot . Jos elinsiirtoon tarkoitettuja munuaisia pidetään liuoksessa, joka sisältää hiilimonoksidia pieninä pitoisuuksina, muutoin havaittu vapaan hemin lisääntyminen ja sytokromi P450: n väheneminen estyvät ja solua vahingoittava lipidiperoksidaatio vähenee. Hiilimonoksidin myönteisiä vaikutuksia on kuvattu myös septisen sokin , suolitukoksen (ileuksen) ja ateroskleroosin eläinmalleissa . Naisilla, joilla on raskausajan hypertensio ja raskausmyrkytys (preeklampsia) , hiilimonoksidipitoisuus uloshengitetyssä ilmassa pienenee. Tupakoivilla naisilla on pienempi riski sairastua preeklampsiaan. Lääkkeitä, jotka voivat kuljettaa ja vapauttaa hallittuja määriä hiilimonoksidia, kehitetään.
Anaerobinen hengitys arkeassa
Metaanin muodostumista ( metanogeneesin ), hiilimonoksidia käytetään muutaman arkkien kuin substraattina varten anaerobinen hengitys . Methanothermobacter thermoautotrophicus ja Methanosarcina barkeri muodossa kolmen molekyylin CO 2 ja yhden molekyylin metaani neljästä molekyyleistä CO , mukaan:
Myös Methanosarcina -asetivoraanit voivat käyttää CO: ta substraattina, jolloin muodostuu yhdensuuntainen asetaatti ja formiaatti . Tämäntyyppinen acetogenesis vuonna metanogeenien kutsutaan carboxidotrophic acetogenesis .
Energian ja hiililähteen hiilimonoksidin lähde hyödyntäen bakteereja
| Fysiologinen ryhmä (kaikki eivät voi kasvaa hiilidioksidilla, vihreä: aerobinen, punainen: anaerobinen) | tutkittu edustaja | Reaktioyhtälö |
|---|---|---|
| Karboksidotrofiset bakteerit | Oligotropha carboxidovorans | 2 CO + O 2 → 2 CO 2 |
| Vetygeeniset bakteerit | Carboxydothermus hydroformaani | CO + H 2 O → CO 2 + H 2 |
| Asetogeeniset bakteerit |
Moorella thermoacetica (aiemmin tunnettu nimellä Clostridium thermoaceticum ) |
4 CO + 2 H 2 O → CH 3 COOH + 2 CO 2 |
| Valotrofiset bakteerit |
Rhodospirillum rubrum (vertaa Winogradskyn saraketta ) |
CO + H 2 O → CO 2 + H 2 |
| Sulfidogeeniset bakteerit | Desulfovibrio vulgaris | 4 CO + H 2 SO 4 → 4 CO 2 + H 2 S |
Harvat bakteerit voivat käyttää hiilimonoksidia substraattina. He käyttävät tätä orgaanisten yhdisteiden muodostamiseen ( hiilidioksidin assimilaatio ) ja energian tuottamiseen. Aerobisesti elävät carboxidobacteria ovat bakteerit, jotka käyttävät hiili hiilimonoksidia . Ne ovat fakultatiivisesti kemolitoautotrofisia , mikä tarkoittaa, että ne elävät epäorgaanisten aineiden hapettumisesta. Karboksidobakteerit hapettavat hiilimonoksidia hapen läsnä ollessa hiilidioksidiksi seuraavasti:
Vaihtoehtoisesti jotkut lajit voivat myös käyttää nitraattia (NO 3 - ) hapen sijasta ( denitrifikaatio ), tämä tehdään ilman happea ( anaerobinen ). Hyvin tutkittu aerobinen CO-hapetin on Oligotropha carboxidovorans . Karboksidobakteerit siis ehkäisevät ilmakehän ilmansaasteita CO: lla.
On myös useita tiukasti anaerobisia kemolitotrofeja, jotka hapettavat CO: ta ilman happea. Näin tapahtuu Carboxydothermus -hydroformaanien kanssa seuraavasti:
Molempien tyyppien keskeinen entsyymi on hiilimonoksididehydrogenaasi (CODH). Aerobinen CODH sisältää kuparia ja molybdeenia , kun taas anaerobisten bakteerien CODH käyttää rautaa ja nikkeliä .
todiste
Tunnetaan useita erilaisia hiilimonoksidiantureita. Ne perustuvat optokemialliseen havaitsemiseen, infrapuna- tai lämmönjohtavuuden mittauksiin , lämpövaikutusmittauksiin , sähkökemiallisiin prosesseihin tai puolijohdekohtaisesti . Yksinkertaisimmassa rakenteessa on optokemiallisia antureita, jotka ilmaisevat kemikaalin värin muutoksen, kun se joutuu kosketuksiin hiilimonoksidin kanssa. Anturit ovat yksinkertaisia ja edullisia, mutta hiilimonoksidin näyttö on laadukkaampaa. Metallikarbonyylien muodostuminen toimii optokemiallisena näyttönä. Hiilimonoksidipitoisuuden tarkempi mittaus on mahdollista sähkökemiallisilla antureilla tai puolijohteisiin perustuvilla antureilla. Hajauttamattomat infrapuna -anturit ovat yleisiä . Nykyään markkinoilla on kannettavia ja kiinteitä elektronisia antureita ( kaasuvaroituslaitteita ), joiden avulla voidaan havaita huoneilmassa oleva hiilimonoksidi, joka on alueella 20–2000 ppm. Hälytys tapahtuu yleensä keskittymisaikatoiminnon perusteella, jotta esimerkiksi tupakansavun aiheuttamat väärät hälytykset vältetään mahdollisuuksien mukaan.
Diiodopentoxide I 2 O 5 käytetään myös havaita täsmällisesti reagenssi , joka on kvantitatiivisesti alennetaan alkuai- jodin I 2 on U-putken korkeammissa lämpötiloissa (n. 80-160 ° C), kun läsnä on hiilimonoksidia , samanaikaisesti muodostumisen ja hiilidioksidi CO 2 :
Värinmuutos soveltuu myös koeputkien havaitsemiseen . CO-pitoisuus kaasun voidaan määrittää mukaan taka- titraamalla jodin kanssa tiosulfaatin S 2 O 3 2- ( jodometrisesti ). Alfred Ditte tutki tätä prosessia dijodipentoksidilla jo vuonna 1870. Vetyllä - jopa suurempina pitoisuuksina - on vain hyvin vähäinen vaikutus tämän menetelmän havaintotarkkuuteen. Muunnetun hiilidioksidin samanaikainen kvantitatiivinen määritys (johtavuus tai bariumhydroksidiliuoksen saostaminen ) tekee mittauksesta erittäin tarkan.
Hiilimonoksidin reagoi vesipitoisella palladium suolaliuokset jopa huoneenlämpötilassa . Tässä prosessissa Pd 2+ -suolat pelkistetään metalliseksi palladiumiksi ja hiilimonoksidi hapetetaan hiilidioksidiksi. Hienoksi jaetun metallisen palladiumin saostuminen värittää näyteliuoksen tummaksi ja osoittaa siten hiilimonoksidia.
kirjallisuus
- AF Holleman , E.Wiberg , N.Wiberg : Epäorgaanisen kemian oppikirja . 102 painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s.896-900.
- S1 suuntaviiva työn vaikutuksen alaisena hiilimonoksidin (hiilimonoksidi) ja Saksan Society for Occupational Medicine and Environmental Medicine. In: AWMF verkossa (vuodesta 2011)
- Louis Lewin : Hiilidioksidimyrkytyksen historia. Julkaisussa: Sudhoffs Archiv 3, 1910, s. 1–35.
nettilinkit
Yksilöllisiä todisteita
- ↑ b c d e f g h i j k l m n o p q r Merkintä hiilimonoksidi on GESTIS aine tietokanta IFA , pääsee 8. tammikuuta, 2021 mennessä. (JavaScript vaaditaan)
- ↑ a b David R. Lide (toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, Dipole Moments, s.9-53.
- ↑ Merkintä hiilimonoksidin että luokitusten ja merkintöjen luetteloon on Euroopan kemikaaliviraston (ECHA), pääsee 1. helmikuuta 2016. Valmistajien ja jälleenmyyjien voi laajentaa yhdenmukaistettuun luokitukseen ja merkintöihin .
- ↑ Sveitsin tapaturmavakuutusrahasto (Suva): Raja-arvot-nykyiset MAK- ja BAT-arvot (haku 630-08-0 tai hiilimonoksidi ), saatavana 2. marraskuuta 2015.
- ↑ CO: n termodynaamiset tiedot. National Institute for Standards and Technology, maaliskuu 2013, arkistoitu alkuperäisestä 2. helmikuuta 2015 ; Käytössä 16. elokuuta 2014 .
- ^ IUPAC: Epäorgaanisen kemian nimikkeistö. Saksan painos suosituksista 1990. VCH, Weinheim 1994, ISBN 3-527-25713-6 , s.76 .
- ↑ Ivan Blumenthal: Häkämyrkytys. Julkaisussa: Journal of the Royal Society of Medicine. Vuosikerta 94, nro 6, kesäkuu 2001, s. 270-272, PMC 1281520 (ilmainen koko teksti).
- ↑ John Hrastar: nestemäinen maakaasu Yhdysvalloissa: historia. Mcfarland & Co Inc., 2014, ISBN 978-0-7864-7859-0 , s.32 .
- ^ RE Schofield: Valaistunut Joseph Priestley. A Study of His Life and Work 1773-1804.Pennsylvania State University Press, 2004, ISBN 978-0-271-03625-0 , s.103 .
- ^ Guy H.Neild: William Cruickshank (FRS - 1802): kliininen kemisti. (PDF; 1.7 MB) Haettu 26. heinäkuuta 2014 .
- ^ Henry Friedlander: Natsien kansanmurhan alkuperä: Eutanasiasta lopulliseen ratkaisuun . University of North Carolina Press, 1997, ISBN 978-0-8078-4675-9 , s. 123 .
- ↑ a b c M. AK Khalil, RA Rasmussen: The Global Cycle of Carbon Monox: Trends and Mass Balance . Julkaisussa: Chemosphere . nauha 20 , 1990, s. 227-242 (englanti).
- ↑ a b c d M. AK Khalil, JP Pinto, MJ Shearer: Ilmakehän hiilimonoksidi . Julkaisussa: Chemosphere: Global Change Science . nauha 1 , s. xi - xiii (englanti).
- ↑ a b Terra täyttää viisi vuotta: miten Terra seuraa saastumista. Julkaisussa: earthobservatory.nasa.gov. 11. maaliskuuta 2011, käytetty 8. tammikuuta 2015 .
- ↑ a b c d e Integrated Science Assessment for Carbon Monoxid. EPO, 2010, käytetty 29. elokuuta 2014 .
- ↑ Sachin D.Ghude, G.Beig: Satelliitti havaitsi troposfäärin typpidioksidin (NO2) ja hiilimonoksidin (CO) alueellisen jakautumisen Intian mantereella. (PDF) Haettu 21. syyskuuta 2014 (englanti).
- ^ O. Badr, SD Probert: Altaat ja ympäristövaikutukset ilmakehän hiilimonoksidille. Julkaisussa: Applied Energy. Osa 50, 1995, s. 339-372.
- ↑ W. Seiler, C. Junge: Hiilimonoksidi ilmakehässä. Julkaisussa: Journal of Geophysical Research. Osa 75, 1970, s. 2217-2226, doi: 10.1029 / JC075i012p02217 .
- ↑ JW Swinnerton, VJ Linnenbom, RA Lamontagne: The Ocean: A Natural Source of Carbon Monoxid. Julkaisussa: Science. Osa 167, 1970, s. 984-986, doi: 10.1126 / science.167.3920.984 .
- ↑ Detlev Möller: Ilma: kemia, fysiikka, biologia, puhtaus, laki. Verlag de Gruyter, 2003, ISBN 3-11-016431-0 , s.18 .
- ↑ JC McConnell, MB McElroy, SC Wofsy: Natural Sources of Atmospheric CO. Julkaisussa: Nature. Osa 233, 1971, s. 187-188, doi: 10.1038 / 233187a0 .
- ↑ Integroitu tieteellinen arviointi hiilimonoksidille. US Environmental Protection Agency, tammikuu 2010, luettu 16. elokuuta 2014 .
- ^ Robert C. MacDonald, Ray Fall: Merkittävien metanolipäästöjen havaitseminen kasveista ilmakehään. Julkaisussa: Atmospheric Environment. Osa A. Yleiset aiheet. Nide 27, nro 11, 1993, s. 1709-1713, doi: 10.1016 / 0960-1686 (93) 90233-O .
- ^ Siegfried Fred Singer: Muuttuva globaali ympäristö . Reidel Publishing Company , Dordrecht 1975, ISBN 90-277-0385-X , s. 90 ( rajoitettu esikatselu Google -teoshaussa).
- ↑ a b Tom Gosink: Mitä hiilimonoksiditasot tarkoittavat? Julkaisussa: Alaska Science Forum. Geofysiikan instituutti, Alaskan yliopisto Fairbanks, 28. tammikuuta 1983, arkistoitu alkuperäisestä 25. joulukuuta 2008 ; Haettu 1. joulukuuta 2007 .
- ↑ Dusan Gruden: Ympäristönsuojelu autoteollisuudessa: moottori, polttoaineet, kierrätys Kovakantinen. Vieweg + Teubner Verlag, 2008, ISBN 978-3-8348-0404-4 , s.127 .
- ↑ Kevyiden ajoneuvojen saastepäästöjen vähentäminen. Julkaisussa: Euroopan parlamentin ja neuvoston asetus (EY) N: o 715/2007, annettu 20. kesäkuuta 2007, moottoriajoneuvojen tyyppihyväksynnästä kevyiden henkilö- ja hyötyajoneuvojen (Euro 5 ja Euro 6) päästöjen osalta ja pääsy ajoneuvojen korjaus- ja huoltotietoihin. Euroopan unioni, 29. maaliskuuta 2013, käytetty 11. elokuuta 2014 .
- ↑ Katja Petzold: Typpioksidien, otsonin ja hiilimonoksidin ilmastosta troposfäärissä: MOZAIC -aineiston analyysi. Raportit Forschungszentrum Jülichiltä , 4327, ISSN 0944-2952 , s.6 .
- ↑ Horst Fischer, Heiko Bozem, Jos Lelieveld: Otsonin fotokemiallinen tuotanto troposfäärissä. Max Planck Institute for Chemistry, 2011, käytetty 29. elokuuta 2014 .
- ↑ B.Weinstock, H.Niki: Hiilimonoksiditasapaino luonnossa. Julkaisussa: Science. Osa 176, 1972, s. 290-292, doi: 10.1126 / science.176.4032.290 .
- ↑ Methods and Standards for Environmental Measurement: Proceedings of the 8th Materials Research Symposium pidettiin National Bureau of Standardsissa. Gaithersburg, Maryland, 20.-24. Syyskuuta 1976, numero 464, s.440.
- ↑ Claus Bliefert: Ympäristökemia . 3. Painos. Wiley-VCH, Weinheim 2002, ISBN 3-527-30374-X , s. 9 ( rajoitettu esikatselu Google -teoshaussa).
- ↑ Savupiipun vaara. Julkaisussa: Berliner Kurier. 15. marraskuuta 2006, käytetty 17. elokuuta 2014 .
- ↑ a b Vihreä W: Johdatus sisäilman laatuun: hiilimonoksidi (CO). United States Environmental Protection Agency, käytetty 16. joulukuuta 2008 .
- ^ A. Hahn, K. Begemann, R. Burger, M. Friedemann, J. Hillebrand, H. Meyer, R. Kolbusa, M. Gessner: Ärztliche Mitteilungen bei Vergiftungen 2008 . Toim.: Federal Institute for Risk Assessmentin lehdistötoimisto. Berliini 2010, ISBN 3-938163-54-2 , s. 58 .
- ↑ Vältä myrkyllisiä kaasuja pellettisäiliöstä. Federal Institute for Risk Assessment, 17. heinäkuuta 2014, luettu 12. elokuuta 2014 .
- ↑ Sabine Sickinger, Stefan Sellmeier, Oliver Meisenberg, Sebastian Schöttner: Hiilimonoksidimyrkytys ilmanvaihtolaitteilla? Julkaisussa: palontorjunta . Ei. 7 , 2011, s. 538-540 .
- ^ Queenslandin terveyden tupakoinnin hallintakäytäntö. (Ei enää saatavilla verkossa.) Ohjeet, arkistoitu alkuperäisestä 15. marraskuuta 2014 ; Haettu 1. maaliskuuta 2010 .
- ↑ Toni Fischer et ai.: Tupakansavun aiheuttama ilmansaaste ravintoloissa . Julkaisussa: ETH Zurich (Toim.): International Archives of Occupational and Environmental Health . nauha 41 , 1978, s. 267-280 ( ucsf.edu - ethz.ch (PDF) tiivistelmä [näytetty 26. elokuuta 2015 mennessä]).
- ↑ D. Talbi, E. Herbst: Tähtienvälisen hiilidioksidin kaasufaasituho: Laskelmat CO 2: n ja H 2: n ja CO 2: n ja H: n välisistä reaktioista . Julkaisussa: Astronomy and Astrophysics . nauha 386 , ei. 3 , 2002, s. 1139-1142 , doi : 10.1051 / 0004-6361: 20020312 .
- ↑ a b M. Oppenheimer, A. Dalgarno: Hiilimonoksidin muodostuminen ja lämpötasapaino tähtienvälisissä pilvissä. Julkaisussa: Astrophysical Journal. Volume 200, 1975, s. 419-425, bibcode : 1975ApJ ... 200..419O . doi: 10.1086 / 153805 .
- ^ TR Ayers: Ulkoisen fotosfäärin lämpöhaarautuminen. In: Solar Photosphere: rakenne, konvektio ja magneettikentät. Julkaisussa: Proceedings of the 138. Symposium of the International Astronomical Union. Springer, 1989, ISBN 0-7923-0529-9 , s.23-28 .
- ^ Gordon Newkirk Jr.: Hiilimonoksidi aurinkokunnassa. Julkaisussa: Astrophysical Journal. Vuosikerta 125, 1957, s.571 , bibcode : 2005A & A ... 438.1043W . doi: 10.1051 / 0004-6361: 20042550 .
- ↑ Pierre Connes et ai.: Hiilimonoksidi Venuksen ilmakehässä. Julkaisussa: Astrophysical Journal. Vuosikerta 152, 1968, s. 731-743, bibcode : 1968ApJ ... 152..731C . doi: 10.1086 / 149590 .
- ^ Lewis D.Kaplan, Janine Connes, Pierre Connes: Hiilimonoksidi Marsin ilmakehässä. Julkaisussa: Astrophysical Journal. Vuosikerta 157, 1969, s. L187, postinumero : 1969ApJ ... 157L.187K ; doi: 10.1086 / 180416 .
- ^ R.Olut: Hiilimonoksidin havaitseminen Jupiterissa. Julkaisussa: Astrophysical Journal. Nide 200, 1975, s. L167-L169, tuotenumero : 1975ApJ ... 200L.167B . doi: 10.1086 / 181923 .
- ↑ Keith S.Noll et ai.: Hiilimonoksidin havaitseminen Saturnuksessa. Julkaisussa: Astrophysical Journal. Vuosikerta 309, 1986, s. L91-L94, tuotenumero : 1986ApJ ... 309L..91N . doi: 10.1086 / 184768 .
- ↑ MA Lopez-Valverde, E.Lellouch, A.Coustenis: Titanin ilmakehän hiilimonoksidifluoresenssi. Julkaisussa: Icarus. Vuosikerta 175, 2005, s. 503-521, doi: 10.1016 / j.icarus.2004.12.015 .
- ↑ A. Marten et ai.: Ensimmäiset havainnot CO: sta ja HCN: stä Neptunuksessa ja Uraanissa millimetrin aallonpituuksilla ja vaikutukset ilmakehän kemiaan. Julkaisussa: Astrophysical Journal. Nide 406, 1993, s. 285-297, bibcode : 1993ApJ ... 406..285M . doi: 10.1086 / 172440 .
- ↑ K. Lodders: Hiilimonoksidin alkuperä Neptunuksen ilmakehässä. Julkaisussa: Icarus. Nide 112, 1994, s. 368-375, doi: 10.1006 / icar.1994.1190 .
- ↑ Detlev Möller: Ilma: kemia, fysiikka, biologia, puhtaus, laki. Verlag de Gruyter, 2003, ISBN 3-11-016431-0 , s.17.
- ↑ Ken Croswell: Typpi Pluton ilmakehässä. Julkaisussa: KenCroswell.com. 20. kesäkuuta 1992. Haettu 28. kesäkuuta 2013 .
- ↑ QM Konopacky, TS Barman, BA Macintosh, C.Marois: Hiilimonoksidin ja veden imeytymislinjojen havaitseminen eksoplaneetan ilmakehässä. Julkaisussa: Science. Vuosikerta 339, 2013, s. 1398-1401, doi: 10.1126 / science.1232003 .
- ↑ Halley : Flyby 13. maaliskuuta 1986. julkaisussa: ESA.int. ESA, käytetty 28. kesäkuuta 2013 .
- ↑ Michael A.DiSanti: Todisteita hallitsevasta alkuperäisestä hiilimonoksidin lähteestä komeetassa C / 1996 B2 (Hyakutake). Julkaisussa: Journal of Geophysical Research. Vuosikerta 108, 2003, s. 5061, doi: 10.1029 / 2002JE001961 .
- ↑ Michael A.DiSanti, Michael J.Mumma, Neil Dello Russo, Karen Magee-Sauer, Robert Novak, Terrence W.Rettig: Kahden hiilimonoksidilähteen tunnistaminen komeetissa Hale-Bopp. Julkaisussa: Nature. Osa 399, 1999, s. 662-665, doi: 10.1038 / 21378 .
- ^ Matthew C.Senay, David Jewitt: Kooman muodostuminen, joka johtuu hiilimonoksidin vapautumisesta komeetista Schwassmann-Wachmann 1. Julkaisussa: Nature. Nide 371, s.229-230 , doi: 10.1038 / 371229a0 .
- ↑ Damon P. Simonelli, James B. Pollack, Christopher P. Mckay, Ray T. Reynolds, Audrey L. Summers: hiilitase ulomman aurinko sumu. Julkaisussa: Icarus. Osa 82, 1989, s. 1-35, doi: 10.1016 / 0019-1035 (89) 90020-1 .
- ↑ Muriel Gargaud, Ricardo Amils: Encyclopedia of Astrobiology. Osa 1, Springer, 2011, ISBN 978-3-642-11271-3 , s. 245–246 ( rajoitettu esikatselu Googlen teoshaussa ).
- ↑ Craig Kulesa: Yleiskatsaus: Molecular Astrophysics and Star Formation. 17. lokakuuta 1999, käytetty 27. heinäkuuta 2014 .
- ↑ Gerrit L.Verschuur: Tähtienvälinen asia: esseitä uteliaisuudesta ja tähtitieteellisestä löydöstä. Springer, 2013, ISBN 978-3-7643-6696-4 , s.247 .
- ^ WB Burton, MA Gordon: Hiilimonoksidi galaksissa. III. Sen jakautumisen yleinen luonne päiväntasaajan tasossa. Julkaisussa: Astronomy and Astrophysics. Vuosikerta 63, 1978, s. 7-27, bibcode : 1978A & A .... 63 .... 7B .
- ^ Klaus Weissermel , Hans-Jürgen Arpe : Teollinen orgaaninen kemia . 3. Painos. VCH, Weinheim 1997, ISBN 3-527-28838-4 , s. 15 .
- ^ Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner: Teollinen epäorgaaninen kemia . 2. painos. Wiley-VCH, Weinheim 2000, ISBN 978-3-527-29849-5 , s. 15 .
- ↑ a b Jürgen Bierhals: Hiilimonoksidi . Julkaisussa: Ullmann's Encyclopedia of Industrial Chemistry . 6. painos. Wiley-VCH, Weinheim 2002, ISBN 978-3-527-30385-4 .
- ^ A b Karl-Heinz Schmidt, Ingo Romey, Fritz Mensch: Kivihiili, maaöljy, maakaasu: kemia ja tekniikka. Vogel Verlag, 1981, ISBN 3-8023-0684-8 , s.56-64 .
- ^ A b c d Karl-Heinz Schmidt, Ingo Romey, Fritz Mensch: Kivihiili, maaöljy, maakaasu: kemia ja tekniikka. Vogel Verlag, 1981, ISBN 3-8023-0684-8 , s.65 .
- ↑ a b c d e A. F. Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 102 painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s.898.
- ↑ R. Conrad: Uudet kemialliset prosessit. Julkaisussa: Chemical Engineer Technology - CIT. Osa 42, 1970, s. 1555-1568, doi: 10.1002 / cite.330422410 .
- ^ Gaurav Nahar, Valerie Dupont: Vedyn tuotanto yksinkertaisista alkaaneista ja hapetetuista hiilivedyistä ceria-zirkonium-tuettujen katalyyttien päällä: Katsaus. Julkaisussa: Renewable and Sustainable Energy Reviews . Osa 32, 2014, s.777-796, doi: 10.1016 / j.rser.2013.12.040 .
- ↑ Ekkehard Fluck, Carl Mahr: Epäorgaaninen perusharjoittelu . 6. painos. VCH, Weinheim 1985, ISBN 3-527-26032-3 , s. 234 .
- ↑ Georg Brauer (toim.), Yhteistyössä Marianne Baudler ja muut: Handbook of Preparative Inorganic Chemistry. Kolmas, uudistettu painos. Osa II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3 , s. 621-622.
- ^ A b c d Karl-Heinz Schmidt, Ingo Romey, Fritz Mensch: Kivihiili, maaöljy, maakaasu: kemia ja tekniikka. Vogel Verlag, 1981, ISBN 3-8023-0684-8 , s.175-176 .
- ^ Allen I.Katz, David Schiferl, Robert L.Mills: Uudet vaiheet ja kemialliset reaktiot kiinteässä hiilimonoksidissa paineen alla. Julkaisussa: The Journal of Physical Chemistry. Osa 88, 1984, s. 3176-3179, doi: 10.1021 / j150659a007 .
- ↑ M.Lipp, WJ Evans, V.Garcia-Baonza, HE Lorenzana: Hiilimonoksidi: Korkeapainepolymeroidun vaiheen spektroskooppinen karakterisointi. Julkaisussa: Journal of Low Temperature Physics. Osa 111, 1998, s. 247-256, doi: 10.1023 / A: 1022267115640 .
- ↑ N. Rademacher, L. Bayarjargal, W. Morgenroth, B. Winkler, J. Ciezak-Jenkins: Kiinteän hiilimonoksidin valmistus ja karakterisointi korkeassa paineessa timanttilasilasissa. (PDF) DESY, 2011, käytetty 9. elokuuta 2014 .
- ↑ http://www.uni-magdeburg.de/isut/TV/Download/Kapitel3_VerbrnungSS2003.pdf
- ↑ Linus Pauling: Kemian perusteet. Verlag Chemie, 1969, ISBN 3-527-25392-0 , s.149 .
- ^ JE Huheey, EA Keiter, RL Keiter: Epäorgaaninen kemia: rakenteen ja reaktiivisuuden periaatteet. de Gruyter, 2003, ISBN 3-11-017903-2 , s.173 .
- ^ AF Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 102 painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s.1789.
- ↑ B. Rosenblum, A. Nethercot C. Townes: Isotopic massasuhteilla, magneettiset momentit ja Horoskooppi Electric dipolimomentin hiilimonoksidia. Julkaisussa: Physical Review. Osa 109, 1958, s. 400-412, doi: 10.1103 / PhysRev.109.400 .
- ^ AF Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 102 painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s.900 .
- ↑ L.Gattermann, JA Koch: Aromaattisten aldehydien synteesi. Julkaisussa: Reports of the German Chemical Society. Osa 30, 1897, s. 1622-1624, doi: 10.1002 / cber.18970300288 .
- ↑ WA Herrmann : 100 vuotta metallikarbonyyliä. Mahdollinen löytö tekee historiaa. Julkaisussa: Chemistry in our time . Osa 22, nro 4, 1988, s. 113-122, doi: 10.1002 / ciuz.19880220402 .
- ^ A b Wilhelm Keim, Arno Behr, Günther Schmitt: Teollisen kemian perusteet. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , s.104 .
- ↑ Bayerin hiilimonoksidiputken Dormagen-Krefeld / Uerdingen käyttöönotto lopetettiin toistaiseksi. (Ei enää saatavilla verkossa.) Nordrhein-Westfalenin korkein hallinto-oikeus, 18. joulukuuta 2007, arkistoitu alkuperäisestä 14. heinäkuuta 2014 ; Haettu 13. heinäkuuta 2014 .
- ^ Wilhelm Keim, Arno Behr, Günther Schmitt: Teollisen kemian perusteet. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , s.179-182 .
- ↑ Andrei Y. Khodakov, Wei Chu, Pascal Fongarland: Advances in the Development of Novel Cobalt Catalysts for Fischer-Tropsch Synthesis of Long-Chain Hydrocarbons and Clean Fuels. Julkaisussa: ChemInform. Osa 38, 2007, s. 1692-1744, doi: 10.1002 / chin.200733255 .
- ↑ PL Spath, DC Dayton: Alustava seulonta - Tekninen ja taloudellinen arviointi synteesikaasusta polttoaineisiin ja kemikaaleihin painottaen biomassasta johdetun synteesikaasun mahdollisuuksia. (PDF) julkaisussa: NREL / TP510-34929. National Renewable Energy Laboratory, joulukuu 2003, käyty 16. elokuuta 2014 .
- ^ A b Wilhelm Keim, Arno Behr, Günther Schmitt: Teollisen kemian perusteet. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , s. 185-187.
- ^ A b Wilhelm Keim, Arno Behr, Günther Schmitt: Teollisen kemian perusteet. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , s.239-240 .
- ↑ a b Ideoiden perinne: muurahaishappo. Joulukuu 2012, käytetty 11. heinäkuuta 2014 .
- ^ Wilhelm Keim, Arno Behr, Günther Schmitt: Teollisen kemian perusteet. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , s.241-243 .
- ^ Joseph R. Zoeller, Victor H. Agreda, Steven L. Cook, Norma L. Lafferty, Stanley W. Polichnowski, David M. Pond: Eastman Chemical Company -etikkahappoanhydridiprosessi. Julkaisussa: Catalysis Today . Osa 13, 1992, s. 73-91, doi: 10.1016 / 0920-5861 (92) 80188-S .
- ↑ A. Gossauer: Biomolekyylien rakenne ja reaktiivisuus. Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2 , s.155 .
- ↑ Jürgen Falbe, Helmut Bahrmann: Homogeeninen katalyysi tekniikassa. Julkaisussa: Chemistry in our time. Osa 15, 1981, s. 37-45, doi: 10.1002 / ciuz.19810150203 .
- ↑ L. Mond, C. Langer, F. Quincke: Hiilimonoksidin vaikutus nikkeliin. Julkaisussa: J. Chem. Soc. 1890, 57, s. 749-753 ( doi: 10.1039 / CT8905700749 ).
- ↑ Ludwig Mond, Heinrich Hirtz, Matthewman Dalton Cowap: Huomautus haihtuvasta kobolttiyhdisteestä hiilimonoksidin kanssa. Julkaisussa: Chem. News. Vuosikerta 98, 1908, s. 165; Chem. Abs. Voi. 2, 1908, s. 3315.
- ↑ Dirk Steinborn: Organometallisen kompleksisen katalyysin perusteet. Teubner, Wiesbaden 2007, ISBN 978-3-8351-0088-6 , s.83 .
- ^ Wilhelm Keim, Arno Behr, Günther Schmitt: Teollisen kemian perusteet. Otto Salle Verlag, 1985, ISBN 3-7935-5490-2 , s.391 .
- ^ Günther Neroth, Dieter Vollenschaar: Rauta ja teräs. Julkaisussa: Wendehorst rakennusmateriaalitiede. Vieweg + Teubner Verlag, 2011, ISBN 978-3-8351-0225-5 , s.637-702.
- ↑ David R.Lide (toim.): CRC Handbook of Chemistry and Physics . 90. painos. (Internet-versio: 2010), CRC Press / Taylor ja Francis, Boca Raton, FL, Heat of Combustion, s.5-70.
- ↑ L. Mond, C. Langer, F. Quincke: Hiilimonoksidin vaikutus nikkeliin. Julkaisussa: J. Chem. Soc. Vuosikerta 57, 1890, s. 749-753, doi: 10.1039 / CT8905700749 .
- ↑ Eckard Amelingmeier et ai.: RÖMPP Lexikon Chemie. Nide 4, 10. painos, 1996–1999, Georg Thieme Verlag, ISBN 978-3-13-200031-5 , s.
- ↑ Ala -Saksin osavaltion kuluttajansuoja- ja elintarviketurvallisuusvirasto : kala näkee punaisen - tuoreen kalan käsittely, varastointi ja kuljetus
- ↑ Basel-Stadtin kantonin terveysosasto: tonnikalalihan laiton värjäys. In: gd.bs.ch . 28. toukokuuta 2019. Haettu 28. toukokuuta 2019 .
- ↑ Ludwig Bergmann, Clemens Schaefer: Kokeellisen fysiikan oppikirja, nide 6. Kiinteä. Gruyter, 2005, ISBN 3-11-017485-5 , s. 335-336.
- ↑ K. Veera Reddy: Molekyylien symmetria ja spektroskopia. New Age Science Ltd., 2005, ISBN 81-224-1142-8 , s.381 .
- ^ Asetus turkiseläinten pitämisestä . 6 § Tappaminen . (Ei enää saatavilla verkossa.) 29. syyskuuta 1998, arkistoitu alkuperäisestä 8. heinäkuuta 2012 ; Haettu 29. elokuuta 2014 .
- ^ Karl-Heinz Schmidt, Ingo Romey, Fritz Mensch: Hiili, maaöljy, maakaasu: kemia ja tekniikka. Vogel Verlag, 1981, ISBN 3-8023-0684-8 , s.152 .
- ^ Matthias Felsch: Aktion T4, Eutanasian ensimmäinen vaihe kansallissosialismissa , München 2003.
- ↑ Barbara Schwindt: Majdanekin keskitys- ja tuhoamisleiri: toiminnallinen muutos ”lopullisen ratkaisun” kontekstissa , Verlag Königshausen ja Neumann, 2005, s. 161 s.
- ↑ JA Raub, M.Mathieu-Nolf, NB Hampson, SR Thom: Hiilimonoksidimyrkytys-kansanterveydellinen näkökulma . Julkaisussa: Toxicology . nauha 145 , ei. 1. huhtikuuta 2000, s. 1–14 , doi : 10.1016 / S0300-483X (99) 00217-6 , PMID 10771127 .
- ^ Maria E. Stefanidou, Constantine P. Maravelias, Artemis A. Dona, Constantine M. Pistos, Chara A. Spiliopoulou, Sotirios A. Athanaselis: Hiilimonoksidiin liittyvät kuolemat Kreikassa. Julkaisussa: The American Journal of Forensic Medicine and Pathology. Vuosikerta 33, 2012, s.128-131 , doi: 10.1097 / PAF.0b013e318252eca9 .
- ^ A b Nathaniel Cobb: Tahattomat hiilimonoksidiin liittyvät kuolemat Yhdysvalloissa, 1979-1988. Julkaisussa: JAMA: The Journal of the American Medical Association. Vuosikerta 266, 1991, s.659 , doi: 10.1001 / jama.1991.03470050059023 .
- ↑ Jorge A. Guzman: Hiilimonoksidimyrkytys. Julkaisussa: Critical Care Clinics. Vuosikerta 28, 2012, s. 537-548, doi: 10.1016 / j.ccc.2012.07.007 .
- ↑ Hiilimonoksidimyrkytys sisätiloissa lisääntyy. Federal Institute for Risk Assessment, 3. helmikuuta 2010, katsottu 9. elokuuta 2014 .
- ↑ hiilimonoksidi. Haettu 29. elokuuta 2014 .
- ↑ Markus Fritz: Leikkaa ja kirkas. 100 × ympäristö. Bibliographisches Institut AG, Mannheim 1977, ISBN 3-411-01706-6 , s.18 .
- ↑ a b c Ingo Wirth, Hansjörg Strauch: Oikeuslääketiede: Perustiedot tutkivaan käytäntöön. Verlag Kriminalistik, 2012, ISBN 978-3-7832-0021-8 , s.196-198 .
- ^ GS Lipman: Hiilimonoksidimyrkyllisyys korkealla . Julkaisussa: Wilderness & Environmental Medicine . nauha 17 , ei. 2 , 2006, s. 144-145 , PMID 16805152 .
- ↑ Environmental Health Criteria (EHC) varten Hiilimonoksidi , pääsee 29 marraskuu 2014.
- ↑ JP Collman, JI Brauman, TR Halbert, KS Suslick: O 2: n ja CO: n sitoutumisen luonne metalloporfyriineihin ja heme -proteiineihin. Julkaisussa: Proceedings of the National Academy of Sciences (PNAS). Osa 73, nro 10, lokakuu 1976, s. 3333-3337, PMC 431107 (ilmainen koko teksti).
- ↑ Klaus Ellinger, Harald Genzwürker (toim.): Kurssikirja hätälääketiede. Suunniteltu valtakunnalliseen opetussuunnitelmaan ylimääräinen hätälääketiede. Deutscher Ärzte-Verlag, 2011, ISBN 978-3-7691-0613-8 , s.620 .
- ↑ Hu & Speizer : Ympäristö- ja työvaarat . Hiilimonoksidi. Julkaisussa: Harrison's Principles of Internal Medicine. 14. painos. McGraw-Hill, New York, s.2533.
- ↑ Luettelo työperäisen altistuksen raja-arvoista ja lyhytaikaisista arvoista. BG Bau, tammikuu 2006, käytetty 17. elokuuta 2014 .
- ↑ CR Henry, D. Satran, B. Lindgren, C. Adkinson, CI Nicholson, TD Henry: Sydänvamma ja pitkäaikainen kuolleisuus kohtalaisen vaikean hiilimonoksidimyrkytyksen jälkeen . Julkaisussa: JAMA . nauha 295 , ei. 4 , tammikuu 2006, s. 398-402 , doi : 10.1001 / jama.295.4.398 , PMID 16434630 .
- ^ S1 suuntaviiva työn vaikutuksen alaisena hiilimonoksidin (hiilimonoksidi) ja Saksan Society for Occupational Medicine and Environmental Medicine. In: AWMF verkossa (vuodesta 2011)
- ↑ M.Coulange, A.Barthelemy, F.Hug, AL Thierry, L.De Haro: Uuden pulssin CO-oksimetrin luotettavuus hiilimonoksidimyrkytyksen uhreille. Julkaisussa: Undersea Hyperb Med. Volume 35, No. 2, March-April 2008, s.107-111, PMID 18500075 .
- ^ AA Cevik et ai.: PSS: n, CO-Hb-tasojen ja CO-myrkytyksen sairaalahoidon välisen suhteen välinen suhde. Julkaisussa: The International Journal of Clinical Practice. Vuosikerta 60, nro 12, 2006, s. 1558-1564, PMID 16918999 .
- ↑ Weaver et ai.: Hiilimonoksidimyrkytys: kognitiivisten seurausten riskitekijät ja hyperbarisen hapen rooli. Julkaisussa: American Journal of Respiratory and Critical Care Medicine. Vuosikerta 176, nro 5, 2007, s. 491-497, PMID 17496229 .
- ↑ Weaver et ai. Hyperbaarinen happi akuuttiin hiilimonoksidimyrkytykseen. Julkaisussa: The New England Journal of Medicine . Vuosikerta 347, nro 14, lokakuu 2002, s. 1057-1067, PMID 12362006 .
- ↑ Neuvoja tupakoitsijoille apteekissa - National Smoking Quit Program Bern, 2008 ... 16. lokakuuta 2014, luettu 30. maaliskuuta 2017. - HWZ: 3–6 tuntia, nukku 4–8 tuntia.
- ↑ Daunderer: Clinical Toxicology-Kaasut: Hiilimonoksidi HI-4,3 33. Erg-Lfg. 1/88 (1988), käytetty 30. maaliskuuta 2017.
- ↑ a b Cathérine Simone Gebhard : Tutkimukset erytropoietiinin erityksen hiilimonoksidiin liittyvän stimulaation säätelystä rotalla . Tübingen 2007, DNB 983723877 , urn : nbn: de: bsz: 21-opus-27538 (väitöskirja).
- ↑ hiilimonoksidi. Julkaisussa: Neurology Lexicon. Haettu 29. elokuuta 2014 .
- ↑ P. Weydt: Reseptorivälitteiset kalsiumsignaalit viljellyissä ihmisen glioomasoluissa. Tectum Verlag , 2000, ISBN 3-8288-8137-8 , s.14 .
- ^ RF Schmidt, F. Lang: Ihmisten fysiologia. Oppiminen ja muisti. Springer-Verlag , ISBN 978-3-540-32908-4 , s.225 .
- ^ PA Berg: Krooninen väsymys ja fibromyalgiaoireyhtymä. Springer-Verlag, 2003, ISBN 3-540-44194-8 , s.37 .
- ↑ "Hyvä" asia hiilimonoksidissa - immunologia: tulehdusta ehkäisevä vaikutus suolistossa. 24. joulukuuta 2005, käytetty 29. elokuuta 2014 .
- ^ Refaat AF Hegazi, Kavitha N.Rao, Aqila Mayle, Antonia R.Sepulveda, Leo E.Otterbein, Scott E.Plevy: Hiilimonoksidi parantaa kroonista hiiren koliittia heme- oksigenaasi 1 -riippuvaisen reitin kautta. Julkaisussa: Journal of Experimental Medicine. Vuosikerta 202, 2005, s. 1703-1713, doi: 10.1084 / jem.20051047 .
- ↑ Atsunori Nakao, Gaetano Faleo, Hiroko Shimizu, Kiichi Nakahira, Junichi Kohmoto, Ryujiro Sugimoto, Augustine MK Choi, Kenneth R.McCurry, Toru Takahashi, Noriko Murase: Ex vivo -hiilimonoksidi estää sytokromi P450: n hajoamisen ja iskemian siirteet . Julkaisussa: Kidney International . nauha 74 , 2008, s. 1009-1016 , PMID 11035334 .
- ↑ Atsunori Nakao, Augustine MK Choi, Noriko Murase: Hiilimonoksidin suojaava vaikutus elinsiirrossa . Julkaisussa: Journal of Cellular and Molecular Medicine . nauha 10 , ei. 3 , 1. kesäkuuta 2006, s. 650-671 , doi : 10.1111 / j.1582-4934.2006.tb00426.x , PMID 16989726 .
- ↑ M.Baum: Loppuveden hiilimonoksidimittaukset naisilla, joilla on raskauden aiheuttama hypertensio ja preeklampsia . Julkaisussa: American Journal of Obstetrics and Gynecology . nauha 183 , ei. 4 , lokakuu 2000, s. 900-903 , doi : 10.1067 / mob.2000.109047 , PMID 11035334 .
- ^ S. Bainbridge, E. Sidle, G. Smith: Tupakansavun välittömät istukan vaikutukset suojaavat naisia preeklampsialta: hiilimonoksidin ja antioksidanttijärjestelmien erityisroolit istukassa . Julkaisussa: Medical Hypoteses . nauha 64 , ei. 1 , 2005, s. 17-27 , doi : 10.1016 / j.mehy.2004.06.019 , PMID 15533604 .
- ↑ Roberta Foresti, Mohamed G.Bani-Hani, Roberto Motterlini: Hiilimonoksidin käyttö terapeuttisena aineena: lupaukset ja haasteet . Julkaisussa: Intensive Care Medicine . nauha 34 , ei. 4. huhtikuuta 2008, s. 649-658 , doi : 10.1007 / s00134-008-1011-1 , PMID 18286265 .
- ^ Y. Liu, WB Whitman: Metanogeenisten arkeioiden metabolinen, fylogeneettinen ja ekologinen monimuotoisuus. Julkaisussa: Annals of the New York Academy of Sciences. Vuosikerta 1125, maaliskuu 2008, s.171-189 , doi: 10.1196 / annals.1419.019 . PMID 18378594 . (Arvostelu).
- ↑ E.Oelgeschläger, M.Rother: Hiilimonoksidista riippuvainen energia-aineenvaihdunta anaerobisissa bakteereissa ja arkeassa. Julkaisussa: Archives of microbiology. Osa 190, nro 3, syyskuu 2008, s.257-269, doi: 10.1007 / s00203-008-0382-6 . PMID 18575848 . (Arvostelu).
- ^ W. Martin, MJ Russell: Biokemian alkuperästä emäksisen hydrotermisen tuuletusaukon kohdalla. Julkaisussa: London Society of London Society. Sarja B, Biologiset tieteet. Vuosikerta 362, nro 1486, lokakuu 2007, s. 1887-1925, doi: 10.1098 / rstb.2006.1881 . PMID 17255002 . PMC 2442388 (ilmainen koko teksti). (Arvostelu).
- ↑ a b Lothar Gremer, Vitali Svetlitchnyi, Ortwin Meyer: Eläminen hiilimonoksidin kanssa: Epätavallisten sekametallikeskusten biologinen katalyysi. BioSpektrum -numerossa 5, 2001, 7. vuosi. PDF (ilmainen koko teksti).
- ↑ Georg Fuchs (toim.): Yleinen mikrobiologia. Perusti Hans Günter Schlegel , 8. painos. Georg Thieme Verlag, Stuttgart, New York 2007, ISBN 978-3-13-444608-1 , s.344 .
- ↑ karboksidobakteerit. Julkaisussa: Compact Lexicon of Biology . Spektrum.de, käytetty 27. syyskuuta 2014 .
- ↑ Steven Heylen, Johan A.Martens: Edistys kohti yksinkertaista kromogeenistä hiilimonoksidin havaitsemista. Julkaisussa: Angewandte Chemie. Vuosikerta 122, 2010, s.7794-7795, doi: 10.1002 / anie.201002569 .
- ↑ a b c Jürgen Fessmann, Helmut Orth: Soveltava kemia ja ympäristöteknologia insinööreille: opas opintoihin ja toimintaan. Verlag ecomed, 2002, ISBN 3-609-68352-X , s.177-178 .
- ^ AF Holleman , E. Wiberg , N. Wiberg : Epäorgaanisen kemian oppikirja . 102 painos. Walter de Gruyter, Berliini 2007, ISBN 978-3-11-017770-1 , s.488.














































